Abstrak
- Interaksi jaring makanan umumnya dianggap terstruktur berdasarkan ukuran dan terjadi pada tingkat individu atau kelompok dalam spesies, namun banyak model ekologi dan uji teori menetapkan nilai tingkat spesies untuk menentukan posisi trofik atau relung. Studi semacam itu mengabaikan potensi perubahan perilaku konsumen dan dinamika trofik berdasarkan ontogenetik atau ukuran dalam spesies yang dapat terjadi seiring pertumbuhan individu.
- Kami menggunakan analisis isotop stabil δ 15 N dan δ 13 C untuk mengeksplorasi efek ukuran tubuh pada struktur trofik dan relung komunitas ikan di salah satu cekungan sungai terbesar di Australia—Murray-Darling. Pertama, kami menguji apakah Posisi Trofik (TP) dan δ 13 C berskala dengan massa tubuh dalam dan di antara spesies dan serikat fungsional (predator; mikro-karnivora; omnivora; algivora-detritivora). Kedua, kami menguji apakah lebar relung isotop berskala dengan ukuran tubuh dalam dan di antara spesies atau kelas massa komunitas yang berkisar dari <1 hingga >8192 g.
- Terdapat hubungan positif antara massa tubuh individu dan TP atau δ 13 C pada 12/14 spesies, termasuk dua predator, tujuh mikrokarnivora, dan tiga omnivora, tetapi tidak pada algivora-detritivora. Berbeda dengan penskalaan positif berbasis ukuran TP dan δ 13 C dalam spesies, tidak ditemukan hubungan penskalaan antara TP atau δ 13 C dan massa tubuh di antara spesies. Elips Bayesian yang dipasang pada TP dan δ 13 C menunjukkan bahwa lebar relung trofik isotopik bervariasi dalam dan di antara spesies, tetapi tidak berskala positif atau negatif dengan massa tubuh pada tingkat organisasi biologis apa pun.
- Pentingnya struktur trofik berbasis ukuran dalam spesies dalam studi kami kontras dengan bukti sebelumnya yang menunjukkan bahwa jaring makanan sungai tidak terstruktur ukuran. Model jaring makanan dan uji teori yang mengasumsikan TP tunggal, tingkat spesies, atau δ 13 C tidak menangkap dinamika trofik berbasis ukuran intraspesifik yang kompleks dari komunitas ikan sungai. Sebaliknya, hasil keluasan relung kami menunjukkan bahwa keragaman isotop sumber daya makanan yang mendukung komunitas ikan tidak berskala dengan ukuran tubuh. Hasil yang kontras ini dapat dijelaskan oleh pencarian makan yang optimal di mana predator yang lebih besar, mikro-karnivora, dan omnivora dari beberapa spesies secara selektif memakan sumber daya yang lebih berenergi, TP lebih tinggi, dan diperkaya δ 13 C sambil menghindari makanan yang lebih rendah energi, TP lebih rendah, dan habis δ 13 C.
1. PENDAHULUAN
Dalam beberapa dekade terakhir, peran ukuran tubuh sebagai elemen penataan kunci dalam jaring makanan telah dieksplorasi secara ekstensif (Jacob et al., 2011 ; Thompson et al., 2012 ). Ukuran tubuh memainkan peran mendasar dalam kemampuan fisik hewan untuk menangkap dan mengonsumsi mangsa dan mengarah pada pola umum, tetapi tidak universal, di mana konsumen lebih besar dari mangsa. Pengamatan bahwa ukuran tubuh adalah pusat ekologi trofik berasal dari Elton (1927), namun pengembangan pendekatan berbasis ukuran untuk teori dan aplikasi ekologi merupakan area penelitian yang semakin aktif (Blanchard et al., 2017 ; Li et al., 2023 ; Riede et al., 2011 ; Woodward et al., 2005 ). Karena pentingnya ukuran tubuh, sifat ekologi pemersatu yang mudah dikumpulkan, pendekatan berbasis ukuran telah menghasilkan wawasan tentang struktur dan fungsi jaring makanan darat, air tawar, dan laut (Potapov et al., 2021 ; Trebilco et al., 2013 ; Woodward & Hildrew, 2002 ). Selain kegunaannya untuk memahami aspek fundamental dari struktur dan fungsi ekosistem, pendekatan berbasis ukuran telah berkontribusi pada pemahaman yang lebih baik tentang dampak gangguan ekologi dan antropogenik seperti penangkapan ikan komersial (Jennings & Blanchard, 2004 ), spesies invasif, pengaturan aliran sungai (Kopf et al., 2019 ) dan perubahan iklim (Yvon-Durocher et al., 2011 ).
Dalam jaring-jaring makanan di mana konsumen lebih besar dari mangsanya, posisi trofik dan ukuran relung dapat meningkat seiring dengan massa tubuh (Arim et al., 2010 ; Potapov et al., 2019 ). Namun, tidak semua konsumen lebih besar dari mangsanya, dan posisi trofik serta ukuran relung tidak selalu berskala dengan peningkatan ukuran tubuh. Misalnya, jaring-jaring makanan kompleks yang mencakup karnivora darat pemburu berkelompok (Hirt et al., 2020 ; Owen-Smith & Mills, 2008 ), komunitas makroinvertebrata bawah tanah (Potapov et al., 2021 ) dan parasit (Sabadel & MacLeod, 2022 ; Thompson et al., 2012 ) tidak sesuai dengan prediksi sederhana tentang peningkatan posisi trofik seiring dengan ukuran tubuh. Lebar relung trofik dapat diukur menggunakan isotop stabil dan secara umum dianggap sebagai ukuran keragaman jenis makanan yang mendukung pola makan hewan (Layman et al., 2012 ). Lebar relung trofik dapat meningkat seiring dengan ukuran tubuh (Brändle et al., 2002 ), namun bukti yang kontras tidak menunjukkan adanya hubungan (Costa, 2009 ; Pearre, 1986 ), relung yang lebih sempit pada predator terbesar (Costa et al., 2008 ; Scharf et al., 2000 ), atau bahkan pola berbentuk punuk (Lanszki et al., 2019 ) di mana hewan berukuran sedang menempati relung terbesar. Meskipun ada kerangka kerja pengujian hipotesis (Hammerschlag-Peyer et al., 2011) ), saat ini tampaknya tidak ada konsensus tentang bagaimana atau apakah lebar relung trofik umumnya berskala dengan ukuran tubuh atau ontogeni dalam dan di antara spesies dalam suatu komunitas.
Interaksi makan biasanya terjadi pada tingkat individu atau kelompok dalam spesies, namun banyak model ekologi dan uji teori menetapkan nilai rata-rata atau maksimum spesifik spesies tunggal untuk menentukan posisi trofik atau ceruk spesies. Studi semacam itu mengabaikan potensi perubahan ontogenetik dan berbasis ukuran dalam perilaku konsumen dan dinamika trofik yang dapat terjadi saat individu tumbuh (Nakazawa, 2015 ; Werner & Gilliam, 1984 ; Woodward et al., 2010 ). Misalnya, selain makan pada tingkat trofik yang lebih rendah, juvenil dari beberapa yang disebut ‘predator puncak’ juga bisa menjadi mangsa. Sebaliknya, beberapa ikan dan reptil herbivora dan detritivor adalah karnivora saat juvenil dan beralih ke pola makan berbasis tumbuhan atau alga saat dewasa (Werner & Gilliam, 1984 ). Pola-pola ini menunjukkan bahwa baik variasi berbasis ukuran dalam spesies maupun perbedaan antar spesies dalam ekologi trofik merupakan faktor penting yang menentukan dinamika jaring makanan. Model jaring makanan yang mengasumsikan satu posisi trofik atau relung tunggal untuk suatu spesies tidak mungkin menangkap dinamika trofik intraspesifik yang kritis. Demikian pula, model berbasis ukuran atau pengujian teori ekologi yang ketat, yang mengabaikan identitas spesies atau perbedaan kelompok makan fungsional (misalnya herbivora; detritivora; omnivora) mungkin tidak menangkap interaksi jaring makanan yang penting.
Berbeda dengan persepsi umum bahwa ekosistem terstruktur berdasarkan ukuran, konsumen dataran banjir sungai menarik karena mereka sering menunjukkan hubungan yang lemah atau tidak signifikan antara ukuran tubuh dan posisi trofik (Burress et al., 2016 ; Layman et al., 2005 ; Ou et al., 2017 ; Potapov et al., 2019 ). Dataran banjir sungai memiliki berbagai sumber produksi primer berbasis karbon terestrial dan akuatik yang kompleks (misalnya tanaman C3 dan C4 terestrial, fitoplankton, alga bentik, dan makrofita), dan oleh karena itu konsumen dalam ekosistem sungai mencakup beragam kumpulan omnivora, herbivora, atau detritivora yang berevolusi bersama untuk memanfaatkan beragam sumber makanan (Winemiller, 2004 ). Bahasa Indonesia: Di seluruh spesies ikan air tawar secara global, posisi trofik tidak berskala positif dengan ukuran tubuh, sebagian karena kekayaan spesies yang tinggi dari herbivora berbadan sedang hingga besar dan detritivora di sungai tropis (Kopf et al., 2021 ). Namun, ketika analisis difokuskan pada spesies karnivora, atau predator individu, maka hubungan ukuran tubuh-posisi trofik positif tampaknya lebih umum (Fraley et al., 2020 ; Keppeler et al., 2020 ). Ukuran tubuh juga memengaruhi mobilitas hewan, kebutuhan energi (Arim et al., 2007 ), habitat dan kopling sumber daya (Keppeler et al., 2021 ) dan dapat memainkan peran penting dalam memengaruhi pemanfaatan sumber daya makanan berbasis karbon sungai-dataran banjir akuatik dan terestrial (Davis et al., 2012 ; Jardine et al., 2017 ; Pusey et al., 2020 ). Meskipun sudah lama diakui pentingnya variasi intraspesies dalam dinamika komunitas dan jaring makanan (Nakazawa, 2015 ; Woodward & Hildrew, 2002 ; Woodward & Warren, 2007 ; Zhao et al., 2014 ), pendekatan untuk mendeskripsikan relung trofik masih umum menggunakan estimasi tingkat spesies yang kemungkinan mengabaikan dinamika trofik penting dalam spesies.
Kami menggunakan Analisis Isotop Stabil (SIA) δ 15 N dan δ 13 C untuk mengeksplorasi pengaruh ukuran tubuh pada struktur trofik komunitas ikan dan lebar relung isotop di salah satu cekungan sungai terbesar di Australia—Murray-Darling. Kami menguji apakah estimasi posisi trofik dan skala δ 13 C berbasis δ 15 N dengan kelas massa tubuh individu, tingkat spesies, atau komunitas dan apakah pola bervariasi di antara spesies atau serikat fungsional (Predator; Mikro-Karnivora; Omnivora; Algivora-Detritivora). Karena pentingnya kendala morfologi berbasis ukuran intraspesifik dalam menangkap mangsa dan keterbatasan energi (Arim et al., 2007 ), kami berhipotesis bahwa TP predator individu dan mikrokarnivora akan berskala positif dengan ukuran tubuh individu, tetapi tidak pada omnivora atau algivora-detritivora karena TP spesies dengan pola makan nabati diharapkan kurang terpengaruh oleh kendala makan berbasis ukuran. Karena beragamnya rentang serikat trofik, termasuk omnivora besar dan herbivora-detritivora dan karnivora kecil di komunitas ikan dataran banjir sungai, kami tidak menduga TP akan berskala positif dengan massa tubuh agregat komunitas seperti yang terjadi di beberapa ekosistem laut (Jennings et al., 2001 ), atau di antara spesies, yang telah didokumentasikan sebelumnya pada ikan dataran banjir sungai (Jennings et al., 2001 ; Kopf et al., 2021 ; Layman et al., 2005 ; Ou et al., 2017 ; Riede et al., 2011 ). Kami berhipotesis bahwa δ 13 C dapat meningkat seiring dengan ukuran tubuh dalam dan di antara spesies dan kelas ukuran. Makanan berukuran kecil seperti zooplankton, serangga, dan larva chironomid, yang dapat memakan sumber makanan darat, detrital, dan sestonik yang kekurangan δ 13 C, umum ditemukan dalam makanan individu berbadan kecil dan ikan pada tahap awal kehidupan (Davis et al., 2012 ; Humphries et al., 2013 ; Kaminskas & Humphries, 2009 ), sementara sumber alga bentik yang diperkaya δ 13 C dan kaya akan asam lemak merupakan bagian besar dari makanan ikan sungai (Jardine et al., 2015 ).
Kami menguji apakah lebar relung trofik isotopik sisik ikan dengan ukuran tubuh pada tingkat komunitas, spesies, dan dalam spesies. Kami berhipotesis bahwa lebar relung trofik dapat meningkat seiring dengan ukuran tubuh dalam dan lintas spesies dan kelas ukuran komunitas. Individu, spesies, dan kelas ukuran ikan yang lebih besar diharapkan dapat mengakses dan mengonsumsi lebih banyak jenis makanan di seluruh posisi trofik atau sumber basal δ 13 C potensial karena ukuran celah dan kebutuhan energinya yang lebih besar (Arim et al., 2007 ) dan kemungkinan kemampuan pergerakan mencari makan yang lebih besar, yang dapat memperluas kesempatan makan. Sebagai alternatif, mencari makan yang optimal (Werner & Hall, 1974 ) di mana konsumen mengkhususkan diri dan secara preferensial memilih sumber makanan yang lebih sedikit tetapi lebih besar dan berenergi tinggi, sambil menghindari pengembalian energi yang semakin berkurang dari memakan mangsa kecil yang melimpah, dapat mengakibatkan tidak ada perubahan atau penyempitan relung trofik dengan meningkatnya ukuran tubuh (Costa, 2009 ).
2 BAHAN DAN METODE
2.1 Daerah penelitian dan komunitas ikan
Murray-Darling Basin (MDB) adalah salah satu sistem sungai terbesar di Australia berdasarkan luasnya dengan daerah tangkapan yang membentang lebih dari 1 juta km 2 di wilayah tenggara beriklim sedang di benua tersebut (Gambar S1 ). Komunitas ikan air tawar di MDB secara alami miskin, karena hanya terdiri dari 38 spesies asli. Namun, seperti fauna mamalia Australia, komunitas ikan tersebut mencerminkan isolasi geologis yang panjang, ekologi yang khas secara global, dan sejarah evolusi yang unik serta tingkat endemisme yang tinggi (Humphries & Walker, 2013 ). Tidak seperti ikan air tawar di benua lain, mayoritas ikan MDB telah berevolusi dari nenek moyang laut dan beradaptasi untuk bertahan hidup di ekosistem air tawar di benua terkering yang berpenghuni di Bumi. Komunitas ikan MDB mencakup predator puncak berbadan besar, seperti ikan kod Murray, Maccullochella peelii (Ebner, 2006 ), bersama dengan berbagai serikat trofik lainnya termasuk omnivora, insektivora, dan mikro-krustasivora (Stoffels, 2013 ). Dengan sekitar satu predator untuk delapan spesies mangsa, keanekaragaman ikan pemakan ikan di MDB tampak lebih rendah daripada rasio dari belahan bumi utara (Stoffels, 2013 ), dan terdapat keanekaragaman ikan herbivora dan detritivora yang jauh lebih rendah, terutama jika dibandingkan dengan sungai tropis (Winemiller, 2004 ). Setelah puluhan tahun terjadi regulasi sungai dan degradasi lanskap, ikan invasif termasuk ikan mas ( Cyprinus carpio ) dan ikan nyamuk timur ( Gambusia holbrooki ), terkadang, membentuk sebagian besar biomassa ikan (Davies et al., 2010 ) dan berdampak buruk pada jaring makanan dan spesies asli (Kopf et al., 2019 ; Marshall et al., 2019 ).
2.2 Pengambilan sampel ikan, sumber basal dan isotop stabil
Antara Maret dan Mei 2018, jaringan ikan dikumpulkan dari lima sungai besar MDB di bawah kondisi sungai aliran rendah yang stabil tanpa banjir. Sungai yang diambil sampelnya adalah Edward-Wakool (EW), Goulburn (GB), Lachlan (LC), Lower Murray (LM) dan Murrumbidgee (MB). Produsen primer diambil sampelnya dari Sungai Gwydir, tetapi sampel jaringan ikan tidak tersedia dari sistem ini. Klip sirip dari delapan ikan kod Murray tambahan yang berkisar antara 600 hingga 1100 mm TL diambil sampelnya dari Sungai Mid-Murray, dan 36 ikan Golden perch ( Macquaria ambigua ) muda dari Tala Creek di sistem Sungai Murrumbidgee juga disertakan untuk mengisi celah pada individu kecil dan besar. Spesies ikan yang diambil sampelnya merupakan bagian terbesar dari kelimpahan komunitas ikan dan biomassa di ekosistem dataran rendah sungai-dataran banjir MDB (Davies et al., 2010 ), tetapi tidak mencakup beberapa spesies bertubuh kecil yang langka, yang sebagian besar merupakan penghuni daerah hulu atau daerah pesisir sungai. Ikan diambil sampelnya menggunakan perahu elektrofishing dan jaring fyke yang terstandardisasi. Di setiap sungai, ikan diambil sampelnya di 10 lokasi, yang mencakup panjang 20–100 km. Setiap lokasi diambil sampelnya pada satu kesempatan menggunakan 10 jaring fyke dan 2880 detik elektrofishing perahu ‘tepat waktu’. Ikan diidentifikasi dan panjang 50 individu pertama dari setiap spesies per lokasi diukur (mm). Massa tubuh individu diperkirakan dari panjang menggunakan hubungan panjang-berat yang dipublikasikan sebelumnya (Llewellyn, 2011 ).
Ikan utuh atau potongan sirip ekor hingga 30 individu dari setiap spesies ikan per sungai, yang mencakup rentang ukuran tubuh yang diambil sampelnya, dikumpulkan untuk analisis isotop stabil. Potongan sirip ekor (30–50 mm 2 ) dari lobus atas dikumpulkan dari ikan yang lebih besar dari 150 mm, sementara ikan yang lebih kecil dari 150 mm di-eutanasia untuk memastikan jaringan yang cukup untuk analisis isotop stabil dan untuk meminimalkan masalah kesejahteraan hewan pasca-pelepasan. Meskipun kami mengumpulkan ikan yang lebih kecil dari 150 mm secara utuh, kami hanya mengambil sampel potongan sirip ekor dari individu-individu ini untuk analisis isotop stabil. Potongan sirip disimpan dalam tabung sentrifus antilengket 1,5 mL dan ikan utuh dalam kantong plastik zip-lock di atas es dan kemudian dibekukan sebelum persiapan untuk analisis isotop stabil.
Bahasa Indonesia: Untuk menyediakan garis dasar δ 15 N untuk estimasi posisi trofik, dan untuk memperkirakan δ 13 C sumber daya basal, empat sumber daya basal diambil sampelnya selama periode yang sama dengan dilakukannya aktivitas pengambilan sampel komunitas ikan. Ini termasuk dua ulangan dari masing-masing tiga jangkauan dalam setiap sungai yang terletak antara 10 dan 120 km (Gambar S1 ). Di setiap lokasi, sumber daya basal yang diambil sampelnya adalah: (1) perifiton (alga bentik, alga berfilamen dan biofilm terkait); (2) seston (fitoplankton dan partikulat halus tersuspensi); (3) makrofita dan (4) tanaman riparian terestrial. Perifiton dikikis dari puing-puing kayu, batu dan makrofita menggunakan lima bantalan gosok piring bundar berdiameter 2 cm dan ditempatkan dalam kantong zip-lock. Seston dikumpulkan dari sampel air epilimnetik dalam botol 1 L yang telah disaring terlebih dahulu melalui jaring 250-μm dan kemudian disaring ke filter Whatman GF/F yang telah dibakar terlebih dahulu (ukuran pori 0,7 μm). Makrofit, rumput-rumputan terestrial dan daun-daun, benih-benih serta batang-batang tanaman dikumpulkan dari berbagai spesies yang dinilai secara visual dalam jangkauan 500 m di setiap lokasi, dipotong-potong, dimasukkan ke dalam kantong plastik ziplock dan dibekukan.
Sumber daya basal beku, potongan sirip dan ikan bertubuh kecil utuh dicairkan dan dibilas (tidak termasuk kertas saring seston) dengan air murni reverse osmosis dan dikeringkan dalam botol kaca atau cawan petri dalam oven pada suhu 60°C selama 48 jam (Arrington & Winemiller, 2002 ). Jika memungkinkan, potongan sirip dari total sedikitnya 20 individu dari setiap spesies, yang mewakili rentang ukuran tubuh penuh yang diambil sampelnya dan setiap sungai, diproses untuk rasio isotop stabil massal nitrogen ( 15 N/ 14 N) dan karbon ( 13 C/ 12 C) di University of Western Australia. Sampel dianalisis untuk δ15 N dan δ13 C , menggunakan sistem aliran kontinu yang terdiri dari spektrometer massa Delta V Plus yang dihubungkan dengan Thermo Flush 1112 melalui Conflo IV (Thermo-Finnigan/Jerman). Nilai isotop δ 15 N dan δ 13 C dilaporkan dalam kaitannya dengan [‰, Udara] dan [‰, VPDB] masing-masing menurut standar internasional (Skrzypek, 2013 ). Karena rasio C/N (Tabel 1 ) jaringan ikan secara umum lebih tinggi dari 3,5, kami mengoreksi nilai δ 13 C ikan individual untuk konsentrasi lipid menggunakan persamaan (Post et al., 2007 ): δ 13 C terkoreksi = (δ 13 C tidak terkoreksi – 3,32) + (0,99 XC/N), di mana C/N dihitung sebagai % massa C/% massa N. Semua analisis didasarkan pada δ 13 C terkoreksi lipid.
| Jenis | Serikat pemberi makan fungsional | N | Massa rata-rata (g) | Massa rentang (g) | Posisi trofik rata-rata diskalakan | Rentang posisi trofik berskala | Bahasa Indonesia: C/N |
|---|---|---|---|---|---|---|---|
| bidan bidan | HAI | 19 | 185 ± 18 | 43–318 | 3,9 ± 0,09 | 3.5–5.1 | 3,6 ± 0,03 |
| Carassius auratus | HAI | 20 | 63 ± 19 | 7–259 | 3,0 ± 0,10 | 2.4–3.7 | 4,1 ± 0,08 |
| Ikan mas koki | HAI | 75 | 941 ± 93 | 1–2958 | 3,6 ± 0,06 | 2.4–4.6 | 3,6 ± 0,03 |
| Craterocephalus stercusmuscarum | MC | 23 | 0,7 ± 0,1 | 0,1–2,7 | 3,6 ± 0,08 | 2.9–4.6 | 3,8 ± 0,05 |
| Gambusia holbrooki | MC | 28 | 0,5 ± 0,1 | 0,1–1,2 | 3,7 ± 0,15 | 2.9–5.5 | 3,8 ± 0,06 |
| Hypseleotris spp. | MC | 28 | 0,4 ± 0,1 | 0,1–1,4 | 3,4 ± 0,09 | 2.5–4.1 | 4,1 ± 0,13 |
| Macquaria ambigua | P | 110 | 783 ± 65 | 1.9–2303 | 4,2 ± 0,05 | 3.3–5.3 | 3,9 ± 0,04 |
| Melanotenia fluviatilis | MC | 28 | 1,8 ± 0,4 | 0,1–7,2 | 3,4 ± 0,06 | 2.6–4.2 | 4,3 ± 0,15 |
| Jamur Maccullochella peelii | P | 81 | 3451 ± 567 | 0,9–27.132 | 3,7 ± 0,08 | 2.4–5.2 | 3,6 ± 0,02 |
| Nematalosa cerebi | IKLAN | 36 | 37 ± 11 | 0,2–252 | 2,2 ± 0,06 | 1.1–2.8 | 4,0 ± 0,06 |
| Philypnodon grandiceps | MC | 21 | 0,5 ± 0,1 | 0,1–1,6 | 3,0 ± 0,08 | 2.3–3.7 | 3,8 ± 0,11 |
| Filipnodon makrostomus | MC | 15 | 0,3 ± 0,1 | 0,04–0,5 | 3,0 ± 0,09 | 2.4–3.6 | 4,0 ± 0,15 |
| Retropinna semoni | MC | 29 | 0,7 ± 0,1 | 0,3–1,4 | 3,8 ± 0,08 | 3.0–4.7 | 4,0 ± 0,10 |
| Tandanus tandanus | HAI | 5 | 1150 ± 79 | Tahun 905–1315 | 4,3 ± 0,1 | 3.9–4.6 | 3,3 ± 0,04 |
2.3 Guild trofik, posisi dan luas niche
Ikan diklasifikasikan ke dalam empat serikat trofik berdasarkan analisis diet ikan air tawar dewasa Australia oleh Stoffels ( 2013 ). Serikat trofik tersebut meliputi: (1) Predator/Piskivora (P): ikan yang utamanya mengonsumsi ikan dan dalam beberapa kasus krustasea dekapoda dan makroinvertebrata lainnya; (2) Omnivora (O): generalis trofik yang mengonsumsi berbagai fitoplankton, alga bentik dan invertebrata air atau darat; (3) Algivora-Detritivora (AD): ikan yang mengonsumsi detritus atau alga; (4) Mikro-Karnivora (MC): ikan dengan diet yang didominasi oleh serangga, mikrokrustasea air atau invertebrata lainnya. Kami menggabungkan serikat ‘mikrokrustasivora’ dan ‘insektivora air’ (Stoffels, 2013 ) menjadi MC karena beberapa spesies tidak dapat dibedakan dengan jelas antara kedua serikat tersebut.
Posisi trofik (TP) ikan dihitung berdasarkan persamaan (Post, 2002 ; Vander Zanden & Rasmussen, 1999 ): TP = 1+ (δ 15 N konsumen − δ 15 N sumber basal )/TDF, di mana δ 15 N konsumen merupakan tanda tangan ikan individu dan δ 15 N sumber basal merupakan rata-rata δ 15 N sumber basal dalam sungai masing-masing tempat ikan diambil sampelnya termasuk (δ 15 N, rata-rata ± SE): EW (2,85 ± 1,28); LC (4,44 ± 1,98); LM (2,54 ± 1,14) dan MB (3,59 ± 1,61). Faktor diskriminasi trofik (TDF) menggambarkan pergeseran nitrogen antara penyerapannya oleh konsumen dan asimilasinya ke dalam jaringan konsumen. Pertama, kami menggunakan TDF konstan sebesar 3,4, yang merupakan garis dasar umum yang digunakan dalam studi jaring makanan air tawar (Post, 2002 ). Untuk mengevaluasi sensitivitas hasil kami terhadap ketidakpastian yang terkait dengan TDF, kami membandingkan TP model berdasarkan TDF konstan (TP konstan ) dengan yang diskalakan (TP diskalakan ) berdasarkan meta-analisis global (Hussey et al., 2014 ) dan TDF yang diestimasikan untuk predator ikan (5,7), mikrokarnivora (3,4), omnivora (4,3) dan herbivora (3,9) di sungai-sungai Australia (TP Aus.riv .) (Bunn et al., 2013 ). Skala TP (Hussey et al., 2014 ) dihitung berdasarkan persamaan: Skala TP = 1+ (δ 15 N konsumen − δ 15 N sumber basal )/2,94 + 0,22 × (δ 15 N sumber basal − 3,4).
Dengan menggunakan gabungan TP dan δ 13 C, luas relung trofik isotopik ikan dihitung menggunakan paket Bayesian Ellipse dalam R SIBER v 2.1.9 (Jackson et al., 2011 , 2019 ). Area Ellipse Standar Bayesian (SEA B ) dan area elips yang dikoreksi untuk ukuran sampel kecil (SEA c ) dihitung pada tiga tingkat organisasi biologis: (1) dalam spesies termasuk estimasi terpisah untuk juvenil dan dewasa besar dan kecil; (2) pada tingkat spesies termasuk semua individu dari setiap spesies dan (3) pada tingkat berbasis ukuran komunitas termasuk semua individu komunitas yang dikelompokkan dalam kelas massa tubuh log 2 seperti di atas. Pada tingkat dalam spesies, individu diklasifikasikan sebagai juvenil atau dewasa menggunakan estimasi ukuran-pada-dewasa khusus spesies yang dipublikasikan sebelumnya, dan selanjutnya dibagi menjadi kelompok besar atau kecil (misalnya dewasa besar; dewasa kecil; juvenil besar dan juvenil kecil) menggunakan titik tengah antara estimasi yang dipublikasikan dari panjang asimtotik dan ukuran-pada-dewasa, dan titik tengah antara ukuran pada metamorfosis larva-juvenil dan ukuran-pada-dewasa (Tabel S1 ). Untuk menghindari bias pengambilan sampel karena ukuran sampel yang kecil, pengelompokan dengan ukuran sampel lebih kecil dari tujuh dikecualikan dari analisis termasuk Tandanus tandanus dan kelas ukuran kecil dan juvenil dari beberapa spesies. Pengelompokan tingkat berbasis ukuran komunitas mengikuti Jennings et al. ( 2001 ) dan metode spektrum ukuran umum (Sprules & Barth, 2016 ) yang dengannya individu-individu, terlepas dari spesies atau identitas serikat makan fungsionalnya, dikelompokkan ke dalam wadah massa tubuh (g) log 2 umum (<1, 2, 4, 8, 16, 32, 64, 128, 256, 512, 1024, 2048, 4096 dan >8192 g). Untuk rentang massa tubuh ikan yang umum, skala log 2 memberikan lebih banyak derajat kebebasan jika dibandingkan dengan skala lainnya (misalnya log 10 ).
2.4 Skala ukuran tubuh berdasarkan posisi trofik, δ 13 C dan lebar relung
Kami menggunakan model efek campuran linier tergeneralisasi (GLMM) menggunakan R untuk memeriksa apakah TP ikan, tanda tangan δ 13 C, dan luas relung trofik isotopik ikan diskalakan dengan massa tubuh pada tiga tingkat organisasi biologis (dalam spesies, tingkat spesies, dan tingkat komunitas) dan mengeksplorasi apakah pola bervariasi di antara spesies dan serikat trofik. Analisis sensitivitas (Tabel S2 dan S3 ) dijalankan pada model untuk membandingkan hasil berdasarkan TP yang diestimasikan menggunakan masing-masing dari tiga TDF yang berbeda (konstan, berskala, AusRiv). Memperhatikan bahwa model yang didasarkan pada berbagai tingkat organisasi biologis dan estimasi TP menggunakan berbagai TDF tidak dapat dibandingkan secara langsung, kami memberi peringkat model menurut Kriteria Informasi Akaike (AIC) terendah dan mengukur kebaikan kesesuaian menggunakan R 2 marginal dan kondisional yang diestimasikan menggunakan paket Kinerja di R (Lüdecke et al., 2021 ).
Model dalam spesies untuk skala TP dan δ 13 C disesuaikan dengan distribusi Gaussian dengan kemungkinan maksimum (lmerModLmerTest) menurut model lengkap: individu TP atau individu δ 13 C ~ Spesies:log 10 BodyMass individu + TrophicGuild + (1/Sungai) + (1/Keluarga). Sungai dan Keluarga taksonomi (misalnya Cyprinidae) dimodelkan sebagai efek acak untuk memperhitungkan efek potensial yang terkait dengan autokorelasi spasial dan keterkaitan filogenetik. Kami menyesuaikan model lengkap seperti di atas dan membandingkannya dengan model berdasarkan log 10 BodyMass saja sebagai efek tetap, Spesies saja sebagai efek tetap dan interaksi TrophicGuild:log 10 BodyMass. Untuk mengeksplorasi penskalaan massa tubuh TP dan δ 13 C pada tingkat organisasi biologis yang lebih tinggi, kami memasang GLM menggunakan pendekatan tingkat spesies tradisional (misalnya Layman et al., 2005 ) dan pendekatan berbasis ukuran tubuh agregat komunitas log 2 (misalnya Jennings et al., 2001 ). GLM tingkat spesies dipasang ke distribusi Gaussian menurut model lengkap: Mean spesies TP atau Mean spesies δ 13 C ~ log 10 MeanBodyMass spesies . GLM kemudian dipasang ke distribusi Gaussian menurut model lengkap: Komunitas MeanTP atau Mean komunitas δ 13 C ~ log 2 komunitas BodyMassClass . Derajat kebebasan yang tidak memadai mencegah perbandingan model termasuk efek tetap dari serikat trofik.
Skala lebar relung trofik isotopik dengan ukuran tubuh dievaluasi dalam spesies, pada tingkat spesies dan pada tingkat komunitas. Dalam spesies, lebar relung juvenil dan dewasa kecil dan besar (size_stage: LA = dewasa besar; SA = dewasa kecil; LJ = juvenil besar; SJ = juvenil kecil) diperkirakan menggunakan SEA c . Untuk mengevaluasi apakah SEA c bervariasi menurut size_stage dalam setiap spesies, kami memasang GLMM mengikuti persamaan: SEA c _ within_species ~ Species:Size_Stage within_species + 1/trophic discrimination factor (TDF) + 1/family. Perbandingan silang post-hoc menguji perbedaan statistik di antara size_stage dalam spesies. Model dijalankan dengan 1/TDF dan 1/family sebagai efek acak untuk mengevaluasi respons tanpa memandang TDF (berskala, konstan, AusRiv), atau potensi keterkaitan filogenetik. Untuk mengeksplorasi hubungan antara luas relung trofik dan massa tubuh pada tingkat organisasi biologis yang lebih tinggi, kami menyesuaikan estimasi ukuran tubuh agregat tingkat spesies dan komunitas dari SEA c ke GLMM menurut persamaan: SEA c_ tingkat_spesies ~ log 10 MeanBodyMass tingkat_spesies + 1/TDF + 1/famili dan SEA c_ komunitas ~ log 2 BodyMassClass komunitas + 1/TDF + 1/famili.
3 HASIL
Kami mengumpulkan jaringan ( n = 518) dari 14 spesies ikan yang mencakup individu dari serikat makan fungsional mulai dari Predator hingga Algivora-Detritivora dan mencakup lebih dari 4,5 orde besaran massa tubuh dari 0,04 hingga 27.132 g (Tabel 1 ). Ada rentang variasi yang lebih besar dalam TP dalam beberapa spesies ( M. peelii ; M. ambigua ; C. carpio ; G. holbrooki ) daripada yang ada di seluruh rentang TP rata-rata di antara semua spesies dalam komunitas, dan hasil ini secara umum konsisten terlepas dari TDF mana yang digunakan untuk memperkirakan TP (Tabel S3 ). Meskipun perkiraan TP sangat bervariasi tergantung pada TDF, dengan perkiraan berskala umumnya memberikan TP tertinggi dan perkiraan berbasis AusRiv memberikan TP terendah (Tabel S3 ), analisis sensitivitas (Tabel S2 ) menunjukkan bahwa TDF tidak memengaruhi pola hubungan penskalaan ukuran tubuh. Posisi trofik di semua individu dalam komunitas berskala positif dengan log 10 BodyMass sebagai efek tetap, tetapi penambahan Spesies sebagai interaksi lebih parsimon dalam semua analisis sensitivitas (Tabel S2 ). Meskipun daya penjelasan tambahan dari identitas Spesies dalam model individu, TP rata-rata Spesies, menggunakan pendekatan tingkat spesies (Gambar S3 ), tidak berskala positif dengan log rata-rata BodyMass 10 terlepas dari TDF. Tidak seperti pendekatan tingkat spesies tradisional, TP rata-rata individu yang dikumpulkan berdasarkan ukuran komunitas (Gambar S4 ) berskala positif dengan log 2 BodyMassClass kecuali ketika TDF AusRiv digunakan (Tabel S2 ).
Model terbaik yang menjelaskan TP individual lebih kompleks dan mencakup interaksi antara Species:log 10 BodyMass dan guild makan fungsional sebagai efek tetap (Gambar 1 ) dan hasilnya konsisten dalam analisis sensitivitas menggunakan setiap TDF (Tabel S2 ). Posisi trofik berskala positif dengan log 10 BodyMass individual dalam kedua spesies Predator, tiga dari tujuh Mikro-Karnivora, tiga dari empat Omnivora dan negatif tetapi tidak signifikan, menurut 95% CI, dalam satu-satunya Algivora-Detritivora ( N. erebi ). Analisis sensitivitas mengungkapkan pola yang sama ini untuk semua spesies (Gambar S2 ), kecuali TDF tetap gagal mendeteksi penskalaan positif yang signifikan dalam satu spesies ( R. semoni ) . Model alternatif TP, termasuk interaksi antara Species:log 10 BodyMass tanpa guild fungsional dan interaksi antara guild fungsional:log 10 BodyMass, kurang parsimoni (Tabel S2 ).
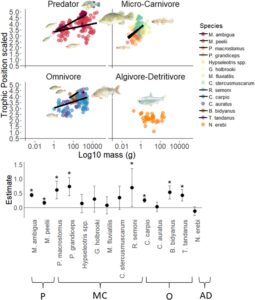
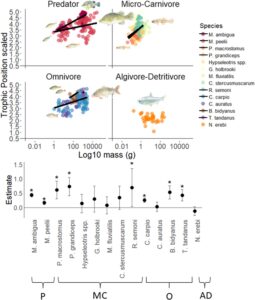
Dengan mencocokkan hubungan skala massa tubuh-TP, model terbaik yang menjelaskan δ 13 C individu mencakup interaksi antara Spesies:log 10 BodyMass dan serikat Trofik sebagai efek tetap (Gambar 2 ; Tabel S4 ). δ 13 C individu berskala positif dengan log 10 BodyMass dalam kedua spesies Predator, lima dari tujuh Mikro-Karnivora, nol dari empat Omnivora dan tidak ada pola skala yang terdeteksi pada satu-satunya Algivora-Detritivora ( N. erebi ). Hubungan skala massa tubuh-δ 13 C positif di antara individu yang selaras dengan sumber basal rata-rata, dan khususnya pada mikro-karnivora menunjukkan ketergantungan yang lebih besar pada sumber makanan detrital terestrial dan sestonik pada individu kecil dan peningkatan ketergantungan pada perifiton dengan peningkatan ukuran tubuh (Gambar 2 ). Model alternatif δ 13 C yang mencakup Spesies atau log 10 BodyMass sendiri sebagai efek tetap, interaksi antara Spesies:log 10 BodyMass dan serikat fungsional kurang hemat (Tabel S4 ). Rata-rata δ 13 C tidak berskala positif dengan rata-rata massa tubuh tingkat spesies atau kelas massa tubuh komunitas log 2 .
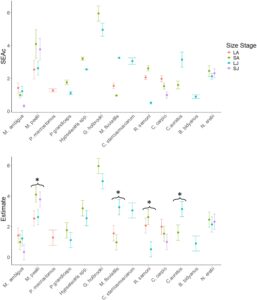
Perkiraan lebar relung trofik isotopik untuk spesies ikan Murray-Darling Basin (SEA c ) (Tabel 2 ) dan kelas massa tubuh log 2 (Tabel 3 ) sensitif terhadap TDF. Konsisten dengan analisis sensitivitas yang dilakukan pada TP, SEA c umumnya terbesar saat menggunakan TDF berskala dan terkecil saat menggunakan AusRiv, sedangkan TDF konstan menunjukkan lebar relung trofik menengah. SEA c dan TP dari mikro-karnivora sama untuk pendekatan konstan dan AusRiv karena TDF yang digunakan untuk keduanya adalah 3,4. GLMM dalam spesies (AIC = 163; R 2 m = 0,79 R 2 c = 0,93; p < 0,001) yang menggabungkan TDF dan famili sebagai efek acak untuk menghilangkan pengaruh variabel-variabel ini, menunjukkan perbedaan signifikan dalam SEA c (Gambar 3 ) di antara juvenil dan dewasa kecil dan besar. Model dalam spesies, yang menggabungkan juvenil dan dewasa besar dan kecil, lebih parsimonius dan memberikan kesesuaian yang lebih baik dibandingkan dengan model yang dipasang dengan spesies saja sebagai efek tetap (AIC = 233; R 2 m = 0,57 R 2 c = 0,77; p < 0,001). Perbedaan signifikan dalam lebar relung trofik antara dewasa atau juvenil besar atau kecil terdeteksi pada empat spesies ( M. peelii , M. fluviatilis , R. semoni, C. auratus ), tetapi pola dalam setiap spesies unik dan tidak secara konsisten meluas, berkontraksi, atau memuncak pada kelas ukuran menengah dari juvenil kecil hingga dewasa besar (Gambar 3 ). Mikrokarnivora invasif berbadan kecil ( G. holbrooki ) memiliki lebar relung trofik terbesar diikuti oleh tahap dewasa kecil dan juvenil kecil dari predator berbadan besar ( M. peelii ), tetapi ada beberapa pola yang konsisten di antara spesies atau serikat trofik (Gambar 3 ). GLMM yang dipasang pada SEA c tingkat spesies (Tabel 2 ) dan tingkat komunitas (Tabel 3 ) menunjukkan bahwa lebar relung trofik tidak berskala positif atau negatif dengan massa tubuh rata-rata spesies atau kelas massa tubuh log 2 komunitas . Meskipun variasi terdeteksi di antara kelas massa tubuh log 2 komunitas , lebar relung trofik secara tak terduga seragam di seluruh pengelompokan berbasis ukuran semua individu yang berkisar dari <1 hingga >8192 g (Tabel 3 ).
| Jenis | Serikat pemberi makan fungsional | SEA c (konstan) | SEA c (berskala) | SEA c (AusRiv) |
|---|---|---|---|---|
| bidan bidan | HAI | 1.6 | 1.9 | 1.2 |
| Carassius auratus | HAI | 2.8 | 3.5 | 2.2 |
| Ikan mas koki | HAI | 2.2 | 2.6 | 1.8 |
| Craterocephalus stercusmuscarum | MC | 2.3 | 2.8 | 2.3 |
| Gambusia holbrooki | MC | 6.0 | 7.6 | 6.0 |
| Hypseleotris spp. | MC | 3.5 | 3.8 | 3.5 |
| Macquaria ambigua | P | 1.6 | 2.0 | 1.0 |
| Melanotenia fluviatilis | MC | 1.9 | 2.2 | 1.9 |
| Jamur Maccullochella peelii | P | 4.4 | 5.4 | 2.7 |
| Nematalosa cerebi | IKLAN | 2.1 | 2.6 | 1.9 |
| Philypnodon grandiceps | MC | 1.4 | 1.7 | 1.4 |
| Filipnodon makrostomus | MC | 1.6 | 1.9 | 1.6 |
| Retropinna semoni | MC | 1.5 | 1.8 | 1.2 |
| Kelas massa tubuh | log 2 Kisaran massa tubuh (g) | SEA c (konstan) | SEA c (berskala) | SEA c (AusRiv) |
|---|---|---|---|---|
| 0,01 | <1 | 3.5 | 4.3 | 3.7 |
| 1 | 1–2 | 4.3 | 5.2 | 4.0 |
| 2 | 2–4 | 2.9 | 3.4 | 2.4 |
| 3 | 4–8 | 3.2 | 3.6 | 1.6 |
| 4 | 8–16 | 5.0 | 5.8 | 2.9 |
| 5 | 16–32 | 6.1 | 7.6 | 3.6 |
| 7 | 32–64 | 4.7 | 5.6 | 3.1 |
| 6 | 64–128 | 0.9 | 0.8 | 1.4 |
| 8 | 128–256 | 2.4 | 3.0 | 1.9 |
| 9 | 256–512 | 2.4 | 2.8 | 1.5 |
| 10 | 512–1024 | 2.4 | 2.9 | 1.3 |
| 11 | Tahun 1024–2048 | 3.8 | 5.0 | 2.6 |
| 12 | tahun 2048–4096 | 3.0 | 4.3 | 1.8 |
| 13 | >8192 | 2.4 | 3.4 | 1.4 |
4 DISKUSI
Ukuran tubuh dalam spesies dan serikat makan memainkan peran penting dalam menentukan posisi trofik, nilai δ 13 C, dan lebar relung isotop dalam studi saat ini. Ini menunjukkan bahwa dinamika trofik komunitas ikan sistem sungai besar kita terstruktur berdasarkan ukuran, tetapi efeknya sangat dimediasi oleh perbedaan berdasarkan ukuran dalam spesies dan variasi di antara spesies dan strategi makan. TP individu yang meningkat seiring dengan ukuran tubuh di seluruh komunitas dan sebagian besar spesies yang dijadikan sampel kontras dengan studi sebelumnya yang menunjukkan bagaimana TP di seluruh spesies ikan air tawar (Keppeler et al., 2020 ; Kopf et al., 2021 ; Layman et al., 2005 ; Ou et al., 2017 ) dan jaring makanan sungai (Potapov et al., 2019 ; Riede et al., 2011 ) sering kali tidak berskala positif dengan ukuran tubuh. Posisi trofik meningkat seiring dengan ukuran tubuh pada 35% dari 65 spesies ikan dari sungai beriklim sedang di Tiongkok (Jia et al., 2024 ) dan pada 40% spesies dari wilayah Nearctic, Neotropis, dan Afrotropis (Keppeler et al., 2020 ). Ada dua kemungkinan penjelasan untuk perbedaan antara prevalensi struktur trofik berdasarkan ukuran dalam penelitian kami dan penelitian sebelumnya pada komunitas sungai dan anak sungai.
Pertama, beberapa penelitian sebelumnya misalnya (Kopf et al., 2021 ; Layman et al., 2005 ; Ou et al., 2017 ; Riede et al., 2011 ) yang menguji asosiasi TP-ukuran tubuh di komunitas sungai telah berfokus pada nilai rata-rata atau maksimum TP dan ukuran tubuh tingkat spesies tunggal, dan karena itu mengabaikan struktur trofik berbasis ukuran intraspesifik penting yang diilustrasikan dalam penelitian kami. Misalnya, ketika kami menerapkan pendekatan rata-rata tingkat spesies tradisional dalam penelitian saat ini, kami juga gagal mendeteksi asosiasi positif antara TP dan ukuran tubuh di seluruh spesies dalam sistem penelitian kami. Predator dengan ukuran maksimum terbesar dalam sistem penelitian kami—ikan kod Murray, sering disebut sebagai predator puncak (Ebner, 2006 ) — tidak memiliki TP tertinggi dan rata-rata makan pada TP yang sama dengan Mikro-Karnivora bertubuh kecil. Ini menunjukkan bahwa meskipun predator, seperti Murray cod, dapat tumbuh menjadi sangat besar, mereka dapat memakan mangsa tingkat trofik yang lebih rendah, seperti dekapoda omnivora atau herbivora-detrivora (Bice et al., 2023 ) dan ikan (Ebner, 2006 ). Hal ini dapat menghasilkan estimasi posisi trofik berbasis isotop yang relatif rendah dan telah terdeteksi pada predator lain, seperti buaya muara ( Crocodylus porosus ) di mana TP menurun pada individu terbesar karena mereka memangsa mamalia darat herbivora dan omnivora besar (Campbell et al., 2022 ; Hanson et al., 2015 ). Sebaliknya, predator berbadan kecil seperti Golden perch ( Macquaria ambigua ) secara konsisten memiliki TP tertinggi, yang mungkin mencerminkan pola makan berdasarkan mangsa tingkat trofik tinggi. Hasil kami konsisten dengan bukti dari ekosistem laut yang terstruktur berdasarkan ukuran yang juga menunjukkan penskalaan TP-ukuran tubuh lintas spesies yang lemah, tetapi penskalaan TP positif yang kuat ketika semua individu dalam komunitas digabungkan berdasarkan kelas massa tubuh (Jennings et al., 2001 ). Demikian pula, penskalaan TP dan ukuran tubuh yang positif di seluruh individu dalam komunitas dalam penelitian kami juga telah dilaporkan dari sungai beriklim sedang di Selandia Baru (Fraley et al., 2020 ) dan Amerika Serikat (McGarvey, 2021 ).
Penjelasan kedua untuk prevalensi struktur trofik berbasis ukuran dalam sistem studi kami adalah kurangnya ikan herbivora dan detritivora berbadan besar di Murray-Darling dibandingkan dengan sungai-sungai tropis yang telah melaporkan pola penskalaan ukuran tubuh TP yang lemah (Layman et al., 2005 ; Ou et al., 2017 ). Ikan herring bertulang ( N. erebi ) adalah satu-satunya spesies ikan yang diketahui benar-benar herbivora atau detritivora (Stoffels, 2013 ) dalam sistem studi kami, dan hasil kami mendukung klasifikasi ini. Hasil kami juga konsisten dengan penelitian sebelumnya yang menunjukkan bahwa hubungan penskalaan massa tubuh-TP umumnya tidak positif untuk herbivora-detritivora (Keppeler et al., 2020 ; Kopf et al., 2021 ), dan penskalaan TP yang negatif lemah konsisten dengan pergeseran trofik yang dilaporkan di N. erebi dari diet berbasis zooplankton yang lebih karnivora saat masih muda menjadi detritus saat dewasa (Pusey et al., 2020 ). Tidak seperti sistem sungai tropis di mana berbagai spesies ikan berbadan besar menempati peran herbivora atau detritivora (Winemiller, 2004 ), peran ini di banyak sungai beriklim sedang, seperti Murray-Darling, tampaknya tidak ada atau ditempati oleh makroinvertebrata. Bahasa Indonesia: Dibandingkan dengan sistem tropis, beragam relung yang mendukung ikan herbivora-detritivora berbadan besar mungkin kurang umum di sungai beriklim sedang karena tingkat produksi primer yang lebih rendah (Davies Jr. et al., 2008 ), penggenangan vegetasi darat yang kurang konsisten (Humphries et al., 2024 ), dan suhu air yang lebih dingin yang memperlambat kemampuan ektotermik untuk mencerna bahan tanaman (Zhang et al., 2020 ). Studi terbaru telah menunjukkan bahwa asosiasi TP-ukuran tubuh positif paling sering terjadi pada spesies karnivora (Keppeler et al., 2020 ) dan oleh karena itu sistem dengan proporsi karnivora yang lebih tinggi akan menunjukkan struktur trofik berbasis ukuran yang lebih kuat. Hasil kami secara umum konsisten dengan pola ini karena individu dari kedua spesies predator menunjukkan asosiasi massa TP-tubuh dalam spesies yang kuat. Berbeda dengan ekspektasi yang didasarkan pada spesies karnivora semata, kami juga mendeteksi peningkatan TP seiring dengan ukuran tubuh individu pada sebagian besar omnivora (3/4 spesies) dan tiga dari tujuh ikan mikro-karnivora.
Selain struktur trofik berbasis ukuran yang terkait dengan TP, kami mendeteksi penskalaan δ 13 C berbasis ukuran individu, yang mencerminkan potensi pergeseran pola makan dalam sumber karbon dengan ukuran tubuh dan ontogeni. Peningkatan absolut dalam nilai δ 13 C dengan ukuran tubuh individu bersifat halus, tetapi konsisten pada beberapa spesies dan selaras dengan sumber basal yang diambil sampelnya dari dataran banjir sungai yang cocok (Gambar 2 ). Data ini secara umum mencerminkan pergeseran dari sumber karbon basal berbasis seston planktonik yang terkuras δ 13 C pada ikan kecil (misalnya termasuk detritus asal terestrial ditambah plankton autotrofik dan heterotrofik) dan juvenil ke sumber karbon perifitik yang diperkaya δ 13 C pada individu yang lebih besar dalam komunitas. Pentingnya sumber makanan sestonik, terutama zooplankton dan mikrokrustasea lainnya, bagi ikan kecil dan perekrutan riwayat hidup awal di sungai (Gilbert, 2022 ; Humphries et al., 2013 , 2020 ; Kaminskas & Humphries, 2009 ; King, 2005 ) sudah mapan dan hasil kami konsisten dengan pentingnya jalur trofik ini bagi ikan muda dan ikan kecil. Demikian pula, pentingnya alga bentik dan perifiton bagi pola makan konsumen merupakan ciri umum jaring makanan sungai besar beriklim sedang, gersang, dan Australia (Bunn et al., 2003 ; Jardine, 2014 ; Jardine et al., 2015 ). Alga bentik dan perifiton merupakan sumber makanan yang sangat bergizi dan kaya akan asam lemak (Jardine et al., 2015 ) dan karenanya dapat dipilih secara istimewa saat konsumen bertambah besar dan memiliki kebutuhan energi yang lebih besar (Arim et al., 2007 ). Vegetasi riparian C3 terestrial yang kekurangan karbon dilaporkan menjadi lebih penting dalam jaring makanan sungai setelah penggenangan dataran banjir (Roach & Winemiller, 2015 ), pada konsumen yang lebih besar (Jardine et al., 2017 ) dan pada ikan herbivora dan omnivora (Davis et al., 2012 ) termasuk N. erebi dewasa (Pusey et al., 2020 ). Tidak mengherankan kami menemukan sedikit bukti akan hal ini karena penelitian kami dilakukan dalam kondisi aliran sungai yang khas di mana banjir tidak terjadi. Penerapan pelacak jaringan makanan dan model pencampuran di masa mendatang (Jardine et al., 2015 ) mungkin berguna untuk mengeksplorasi pentingnya ekologi kekeringan dan banjir (Humphries et al., 2024 ) pada sumber karbon makanan yang mendukung komunitas sungai. Mengingat pentingnya ukuran tubuh individu dalam menentukan TP dan δ 13C, hasil kami menunjukkan bahwa model jaring makanan dan pengujian teori ekologi berbasis ukuran yang secara tradisional menggunakan nilai TP atau δ 13 C spesifik spesies tunggal tampaknya tidak mungkin sepenuhnya menangkap dinamika trofik ontogenetik dan berbasis ukuran dalam spesies dari komunitas ikan sungai.
Meskipun TP dan δ 13 C berskala dengan ukuran tubuh, kami menemukan sangat sedikit bukti yang menunjukkan bahwa lebar relung trofik meningkat atau menurun secara konsisten dengan ukuran tubuh pada tingkat organisasi biologis apa pun. Hasil ini bertentangan dengan hipotesis kami dan literatur sebelumnya, yang menunjukkan bahwa lebar relung trofik meningkat (Brändle et al., 2002 ), menurun (Costa et al., 2008 ; Scharf et al., 2000 ) atau mencapai puncak pada kelas ukuran menengah (Lanszki et al., 2019 ). Tidak ada hubungan antara lebar relung trofik dan ukuran tubuh yang telah terdeteksi sebelumnya (Costa, 2009 ; Pearre, 1986 ) dan hasil ini secara umum menunjukkan bahwa keragaman isotop sumber daya makanan yang mendukung komunitas ikan Murray-Darling praktis invarian sehubungan dengan ukuran tubuh ikan individu, spesies, atau kelas massa tingkat komunitas. Hasil ini agak mengejutkan mengingat sampel kami mencakup 14 spesies ikan, empat serikat trofik, dan berbagai ukuran tubuh dari <1 hingga 27.132 g. Hasil ini menunjukkan bahwa meskipun posisi trofik dan sumber basal yang mendukung ikan Murray-Darling Basin dapat sangat bergantung pada ukuran, keragaman isotop sumber makanan yang mendukung pola makan mereka tidak berskala konsisten dengan ukuran tubuh. Pencarian makan yang optimal (Werner & Hall, 1974 ) di mana konsumen mengkhususkan dan lebih memilih sumber makanan yang lebih besar, atau berenergi lebih tinggi, sambil menghindari pengembalian energi yang semakin berkurang dari memakan mangsa kecil yang melimpah, dapat mengakibatkan tidak ada perubahan atau penyempitan relung trofik dengan peningkatan ukuran tubuh (Costa, 2009 ). Peningkatan permintaan energi seiring dengan ukuran tubuh pada predator, mikrokarnivora, dan beberapa omnivora dapat mendorong strategi makan selektif untuk mangsa dengan posisi trofik lebih tinggi (Arim et al., 2007 ), dan δ 13 C yang lebih kaya yang kami amati pada ikan yang lebih besar konsisten dengan pencarian makan yang optimal untuk memilih mangsa yang kaya akan sumber alga bentik perifitik dan asam lemak esensial terkait (Jardine et al., 2015 ).
Meskipun variasi dalam lebar relung trofik menunjukkan sedikit pola umum mengenai ukuran tubuh, penting untuk menyoroti bahwa terdapat perbedaan besar dalam dan di antara spesies. Misalnya, M. ambigua adalah predator berbadan besar tetapi memiliki salah satu relung trofik isotop tersempit, yang menunjukkan strategi makan khusus dengan posisi trofik tinggi. Sebaliknya, M. peelii adalah predator besar lainnya dalam sistem studi kami, tetapi memiliki relung trofik isotop yang jauh lebih besar, yang konsisten dengan bukti sebelumnya yang menunjukkan bahwa ia adalah predator yang sangat oportunistik (Ebner, 2006 ) yang mencari makan di berbagai posisi trofik dan berbagai sumber basal. Spesies invasif berbadan kecil G. holbrooki memiliki relung trofik isotop terbesar, mendukung pandangan bahwa ia adalah konsumen yang sangat oportunistik yang mencari makan dari berbagai sumber makanan. Dari keempat spesies yang menunjukkan perbedaan signifikan dalam relung trofik dalam spesies, dewasa terbesar biasanya memiliki lebar relung yang lebih kecil atau berukuran sama jika dibandingkan dengan dewasa atau juvenil yang lebih kecil.
Berbagai macam penelitian sebelumnya telah menekankan pentingnya mengintegrasikan pergeseran ontogenetik dan berbasis ukuran individu dengan lebih baik (Bolnick et al., 2011 ; Nakazawa, 2015 ; Raffard et al., 2020 ; Woodward et al., 2010 ; Woodward & Warren, 2007 ; Zhao et al., 2014 ) ke dalam ekologi komunitas dan jaring makanan. Meskipun demikian, analisis jaring makanan masih sering menggunakan metode berbasis spesies atau berbasis serikat makan fungsional untuk mengelompokkan anggota komunitas, dengan sedikit pertimbangan eksplisit tentang bagaimana dinamika trofik dapat berubah dengan ontogeni atau ukuran tubuh individu. Hasil kami menunjukkan bahwa penilaian dalam spesies terhadap posisi trofik dan δ 13 C akan memberikan deskripsi yang lebih baik tentang komunitas ikan sungai-dataran banjir, tetapi agregasi tingkat spesies mungkin sesuai untuk analisis luas relung trofik (Jackson et al., 2011 ).
Pergeseran metodologis untuk lebih menggabungkan ukuran tubuh dalam spesies ke dalam analisis trofik isotopik akan memerlukan rezim pengambilan sampel yang dirancang dengan tepat untuk mengumpulkan rentang individu yang representatif di seluruh kelas ukuran tubuh dan tahap ontogenetik; memerlukan upaya dan biaya pengambilan sampel yang lebih besar dibandingkan dengan metode pengelompokan berbasis spesies atau berbasis serikat makan fungsional tradisional. Mengikuti Jackson et al. ( 2011 ), pengambilan sampel setidaknya 10 individu direkomendasikan, dan oleh karena itu kami menyarankan minimal 10 sampel masing-masing untuk dewasa dan muda yang besar dan kecil untuk menangkap dinamika trofik dalam spesies. Demikian pula, penelitian masa depan dapat memberikan model yang lebih realistis jika distribusi kelas ukuran individu dan kelimpahan spesies (McGarvey, 2021 ) digunakan alih-alih spesies dengan bobot yang sama.
Tanpa memperhitungkan variabilitas dalam garis dasar isotop, proporsi makanan dari sumber basal dan faktor diskriminasi trofik, rasio isotop mungkin tidak mencerminkan makanan (Hette-Tronquart, 2019 ; Hoeinghaus & Zeug, 2008 ). Untuk meminimalkan potensi efek variabilitas dalam garis dasar isotop, kami menstandardisasi estimasi posisi trofik menggunakan pengukuran lokal δ 15 N dari sumber basal. Demikian pula, hasil penskalaan struktur trofik berbasis ukuran kami kuat terhadap analisis sensitivitas yang dilakukan menggunakan faktor diskriminasi trofik (TDF) alternatif, tetapi nilai absolut TP dan lebar relung sangat dipengaruhi dan bervariasi tergantung pada metode (Bunn et al., 2013 ; Hussey et al., 2014 ; Post, 2002 ). Misalnya, menggunakan TDF berskala (Hussey et al., 2014 ), panjang rantai makanan/TP maksimum yang diestimasikan untuk predator adalah 5,3 dengan lebar relung maksimum 5,4, sementara penerapan TDF sungai-dataran banjir dari Australia menyarankan rantai makanan yang jauh lebih pendek dengan maksimum 3,2 untuk predator dan lebar relung maksimum 2,7. Oleh karena itu, studi masa depan yang menaksir arsitektur relung trofik dari jaring makanan sungai-dataran banjir (misalnya Panjang Rantai Makanan) harus mempertimbangkan berbagai TDF dan akan mendapat manfaat dari kuantifikasi proporsi makanan dari sumber basal menggunakan model pencampuran dan penyempurnaan estimasi dari isi lambung. Kekurangan dari desain studi kami meliputi ketidakmampuan untuk mengumpulkan tahap perkembangan larva karena waktu pengambilan sampel, ukuran sampel kecil dari juvenil yang lebih kecil dari beberapa spesies, dan kurangnya penyertaan konsumen lain (misalnya zooplankton; makroinvertebrata) yang selanjutnya akan memperluas pemahaman kita tentang struktur trofik jaring makanan sungai yang besar. Penelitian masa depan yang mendokumentasikan ontogeni berbasis ukuran relung isotop di seluruh taksa dan bagaimana dinamika trofik dapat, atau tidak dapat, terstruktur berdasarkan ukuran di ekosistem lain sangatlah diperlukan.



