Abstrak
- Paradigma ekologi yang dominan menyediakan kerangka kerja teoritis untuk dua sumber karbon dasar bagi jaring makanan sungai: karbon yang difiksasi oleh alga dan makrofita yang terendam (autokton) dan karbon yang difiksasi oleh tumbuhan vaskular terestrial yang memasuki ekosistem perairan sebagai serasah (alokton). Jalur tambahan yang kurang dipelajari bagi karbon untuk memasuki sungai adalah sebagai metana yang diproduksi dalam jumlah kecil melalui metanogenesis oleh archaea metanogenik anaerobik.
- Karena sungai pada umumnya mengandung banyak oksigen, metana tidak sering dianggap sebagai penyumbang utama bagi anggaran karbon sungai. Akan tetapi, metana juga dapat masuk ke sungai melalui rembesan makro gas alam, tempat endapan bawah tanah terhubung ke permukaan melalui retakan dan patahan. Kami meneliti kontribusi metana dari rembesan makro gas alam terhadap jaring makanan dengan membandingkan nilai δ 13 C hewan dan makanannya dari daerah yang kaya akan metana terlarut dengan daerah yang konsentrasi metananya berada pada tingkat latar belakang.
- Hewan yang dikumpulkan dari daerah aliran sungai dengan rembesan makro gas alam mengalami penurunan nilai δ 13 C yang signifikan dibandingkan dengan hewan dari daerah aliran referensi. Di daerah aliran sungai dengan rembesan makro gas alam, metana berfungsi sebagai sumber karbon basal utama bagi konsumen primer lalat capung ( Tasmanocoenis spp.), yang menyumbang hingga 55% dari total anggaran karbon mereka. Karbon yang berasal dari metana bertahan di berbagai tingkat trofik dari jaring makanan rembesan makro gas alam, mensubsidi hingga 19% karbon pada Decapoda dan 28% pada ikan karnivora.
- Di antara Decapoda, karbon yang berasal dari daratan mendominasi kontribusi biomassa, memasok hingga 55% karbon untuk Macrobrachium australiense dan 56% untuk Parataya australiensis . Kontribusi karbon autokton tertinggi terdapat pada lalat capung, dengan hingga 30% karbon mereka difiksasi oleh alga.
- Temuan kami menetapkan prevalensi jalur konsumen utama metana–bakteri metanotropik yang berasal dari gas alam. Kami menekankan signifikansinya sebagai saluran energi yang berpotensi mendominasi di sungai dengan konsentrasi metana terlarut yang tinggi, yang menunjukkan redundansi preferensi makan pada tingkat trofik yang rendah. Selain itu, kami memberikan informasi yang berguna untuk penggabungan berbagai sumber karbon dalam jaring makanan sungai.
Baca Ringkasan Bahasa Sederhana gratis untuk artikel ini di blog Jurnal.
1. PENDAHULUAN
Semua organisme memerlukan sumber karbon untuk tumbuh dan bereproduksi, apakah itu CO 2 yang digunakan oleh tanaman autotrofik atau karbon organik kompleks yang diperoleh hewan dari makanan mereka. Namun, sumber karbon basal yang mendukung jaring makanan sungai cenderung bervariasi baik secara temporal maupun spasial (Brett et al., 2017 ). Paradigma dominan ekologi air tawar (misalnya Junk et al., 1989 ; Thorp & Delong, 1994 ; Vannote et al., 1980 ) mengusulkan kerangka kerja teoritis untuk dua sumber karbon basal primer yang berasal dari fotosintesis untuk sungai: karbon autokton dan karbon alokton. Karbon autokton terdiri dari karbon yang telah difiksasi dalam ekosistem perairan (misalnya oleh alga atau makrofita yang terendam, Thorp & Delong, 2002 ). Karbon alokton dihasilkan dari produksi primer oleh tanaman terestrial yang memasuki ekosistem akuatik sebagai materi partikulat (misalnya biji, bunga, daun, dan cabang) dan terdiri dari komponen karbon yang tidak larut dan larut (misalnya lindi, Mitrovic & Baldwin, 2016 ). Tingkat di mana satu sumber basal atau yang lain mendukung ekosistem tertentu biasanya sangat bergantung pada konteks dan spesifik ekosistem (misalnya Hall et al., 2001 ; McInerney et al., 2019 ). Di dalam sungai dataran banjir, sumber karbon alokton yang berasal dari terestrial dapat melimpah tetapi sering dianggap lebih membandel daripada sumber autokton labil, yang mudah dikonsumsi oleh hewan dan dapat mengandung molekul berkualitas tinggi yang penting untuk pertumbuhan dan reproduksi somatik hewan (misalnya lipid, Brett et al., 2017 ; McInerney et al., 2023 ).
Jalur tambahan yang kurang dipelajari bagi karbon untuk memasuki jaring makanan sungai adalah sebagai metana yang berasal dari kemosintetik (mengingat bahwa CH4 yang difiksasi oleh bakteri dalam ekosistem juga dapat dianggap autokton, tetapi di sini kita membedakannya dari karbon autokton yang berasal dari fotosintesis yang dijelaskan di atas). Di perairan permukaan, metana biasanya diproduksi dalam jumlah kecil melalui metanogenesis oleh archaea metanogenik anaerobik (Jones et al., 1987 ). Mikroba ini menghuni lingkungan anoksik, seperti sedimen dasar sungai, tepian sungai, daerah lahan basah dan danau yang berdekatan, karena metanogenesis hanya terjadi tanpa adanya oksigen (Conrad, 2020 ). Meskipun metanogenesis sebagian besar terjadi di sedimen lahan basah dan danau, metanogenesis juga dapat terjadi di kolom air ketika kondisi anaerobik bertahan di kedalaman selama periode stratifikasi termal dan oksigen (Grey, 2016 ; Sorrell & Boon, 1992 ). Demikian pula, metanogenesis dapat terjadi di kolom air sungai jika stratifikasi terjadi selama periode berhenti mengalir. Meskipun penelitian terbaru menunjukkan prevalensi karbon isotopik ringan yang berasal dari metana dalam jaring makanan sungai kapur (misalnya Sampson et al., 2019 ; Shelley et al., 2017 ; Trimmer et al., 2015 ), metana biasanya tidak dianggap sebagai sumber karbon yang signifikan di sungai karena umumnya sungai teroksigenasi dengan baik saat mengalir.
Meskipun tidak umum, metana juga dapat memasuki sungai melalui makroseeps gas alam (Burrows et al., 2021 ), di mana endapan metana yang dekat dengan permukaan meresap ke sungai (Pearce et al., 2023 ). Rembesan dapat menyebabkan masuknya metana secara langsung ke kolom air pada konsentrasi beberapa kali lipat di atas yang dihasilkan secara lokal oleh metanogenesis (Burrows et al., 2021 ; Oshkin et al., 2014 ). Metana terlarut yang berasal dari makroseeps gas alam dapat berfungsi sebagai sumber energi tambahan untuk karbon kontemporer (autokton dan alokton) bagi organisme akuatik, karena bakteri pengoksidasi metana (metanotrof) mengubah metana menjadi biomassa dan energi (Kohzu et al., 2004 ). Ketika invertebrata memakan alga atau mengonsumsi mikroorganisme yang menggunakan karbon yang berasal dari metana, mereka mengasimilasi karbon ini ke dalam jaringan mereka sendiri, yang pada gilirannya dapat ditransfer ke tingkat trofik berikutnya (misalnya ikan, burung, dan mamalia, Grey, 2016 ).
Peran metana terlarut dalam mendukung jaring makanan sungai di berbagai tingkat trofik masih kurang dipahami, dengan sebagian besar penelitian difokuskan pada ekosistem laut dan danau (misalnya MacAvoy et al., 2008 ; Ravinet et al., 2010 ). Secara konseptual, tiga jalur energi yang berbeda dalam ekosistem perairan dapat dipisahkan menjadi: 1/sumber energi, 2/penggerak energi dan 3/pengeluar energi (Gambar 1 , dimodifikasi dari Jones & Grey, 2011 ). Sumber energi meliputi sinar matahari dan CO 2 , serasah terestrial dari vegetasi riparian, dan metana yang terlarut dalam kolom air dari rembesan bentik. Penggerak energi meliputi autotrof akuatik (misalnya alga) yang menghasilkan biomassa melalui fotosintesis, bakteri dan jamur heterotrofik yang menguraikan serasah terestrial dan karbon organik terlarut (DOC) yang berasal dari terestrial, dan bakteri metanotrofik yang menggunakan metana sebagai sumber karbon (energi). Penghambur energi dapat memperoleh karbon melalui salah satu dari tiga jalur potensial atau dari konsumsi hewan dalam ordo trofik yang lebih rendah. Namun, sejauh mana metana ditransfer di antara tingkat trofik berikutnya dibandingkan dengan dua sumber karbon lainnya (terutama ketika dalam konsentrasi terlarut yang tinggi) tidak dipahami dengan baik.

Di sini, kami berangkat untuk mengeksplorasi kontribusi metana yang berasal dari gas alam terhadap jaring makanan sungai. Kami menggunakan rasio isotop stabil C (δ 13 C) dan N (δ 15 N) yang dikumpulkan dari sumber daya dasar dan hewan untuk mengeksplorasi dinamika trofik di dalam Sungai Condamine, tempat metana yang berasal dari gas alam melimpah. Berbeda dengan metana yang dihasilkan in situ oleh archaea anaerobik, metana dari makroseeps gas alam di Sungai Condamine sudah tua, berasal dari Walloon Coal Measures (fitur sedimen Jurassic dari cekungan Surat), dan terbentuk sejak Pleistosen Akhir (Baublys et al., 2015 ). Tujuan pertama kami adalah untuk memeriksa apakah sumber karbon dasar untuk jaring makanan sungai berbeda antara lokasi dengan konsentrasi metana terlarut yang tinggi dan lokasi di mana metana terlarut berada pada tingkat latar belakang. Tujuan kedua kami adalah melacak karbon yang berasal dari metana melalui jaring makanan sungai dan mengukur kontribusi relatif karbon yang berasal dari autotrof terestrial (alokton), autotrof akuatik (autokton), dan makrosepi gas alam (metana) terhadap organisme dari berbagai ordo trofik. Mengingat tingginya konsentrasi metana yang terdapat dari makrosepi gas alam, kami memperkirakan bahwa sumber karbon dari organisme ordo trofik yang lebih rendah akan berbeda secara signifikan antara lokasi referensi dan lokasi rembesan metana. Kami juga mengantisipasi bahwa karbon yang berasal dari metana akan dimobilisasi dari konsumen primer yang memakan metanotrof dan melewati serikat trofik yang lebih tinggi untuk akhirnya menjadi sumber karbon ketiga bagi dua spesies ikan karnivora. Atau, ada kemungkinan juga bahwa metana dikonsumsi oleh bakteri metanotropik, yang tidak menjadi bagian dari makanan hewan sungai. Jika yang terakhir benar, maka karbon yang berasal dari metana kemungkinan akan tetap berada dalam lingkaran mikroba di dasar jaring makanan, dengan kelebihan metana dari rembesan hilang begitu saja ke atmosfer.
2 BAHAN DAN METODE
2.1 Deskripsi situs
Enam lokasi studi dipilih di sepanjang jangkauan enam kilometer Sungai Condamine, yang terletak di wilayah Buruŋgam, Queensland barat daya, Australia (lihat Burrows et al., 2021 untuk deskripsi lengkap). Tiga lokasi referensi (1–3), yang tidak terpengaruh oleh makroseeps gas alam, terletak di hulu lokasi rembesan. Tiga lokasi makroseeps gas alam (4–6) terletak di bagian sungai tempat gelembung metana masuk ke sungai melalui patahan yang tinggi di profil geologi. Rembesan metana bervariasi di antara ketiga lokasi; Lokasi 4 didominasi oleh volume besar gelembung kuat melalui benthos berbatu, di atas sekitar 40 m sungai. Fluks gas yang diukur selama periode studi di Lokasi 4 berkisar antara 100 hingga 1155 L min −1 . Makroseeps di Lokasi 5 terjadi di area kecil, sekitar 1–2 m 2 , dan melalui benthos berpasir, yang mengarah ke aliran kecil gelembung kecil di atas sekitar 40 m. Situs 6 juga terjadi melalui benthos berpasir, menciptakan aliran konstan dari banyak gelembung kecil tetapi lebih dari sekitar 80 m panjang sungai. Total fluks volumetrik di Situs 6 berkisar lebih dari 80–100 L min −1 . Debit di Sungai Condamine di situs studi dicirikan oleh periode pelepasan air yang tidak teratur dari Chinchilla Weir di hulu, diselingi oleh peristiwa aliran besar yang didorong oleh peristiwa hujan yang lebih tinggi di daerah tangkapan air. Peristiwa aliran besar (~15.000 ML hari −1 ) terjadi pada bulan April 2018 sebelum memulai kampanye pengambilan sampel, yang diikuti oleh peristiwa yang lebih kecil pada akhir Februari 2018 (~6000 ML hari −1 ). Peristiwa aliran besar lebih lanjut (~ 25.000 ML hari −1 ) terjadi pada akhir Desember 2018. Debit pada volume terakhir setara dengan peningkatan sekitar 8 m di tinggi sungai. Di waktu lain, aliran kecil sekitar 150 ML hari -1 diikuti oleh periode ketika aliran kecil atau tidak ada sama sekali terjadi di sungai.
2.2 Pengambilan sampel
Pengambilan sampel terjadi pada enam kesempatan antara Agustus 2017 dan Maret 2019. Konsentrasi metana terlarut diukur di setiap lokasi (Lampiran S1 ). Seston dikumpulkan dengan melewatkan antara 100 dan 300 mL air sungai melalui serat kuarsa (QF) yang telah dibakar terlebih dahulu (550 °C). Lima sampel dikumpulkan di setiap lokasi, dan filter dibekukan sebelum dikembalikan ke laboratorium. Biofilm permukaan dikumpulkan dari puing-puing kayu dan sedimen dasar. Permukaan kayu digosok dengan lembut dengan sikat gigi baru di setiap lokasi dan waktu; isinya dipindahkan ke tabung steril dan dibekukan. Mini sediment corerer (diameter sekitar 2 cm) digunakan untuk mengumpulkan bagian atas sekitar 1 cm sedimen. Sedimen dipindahkan ke wadah steril dan dibekukan. Lima sampel biofilm dan sedimen dikumpulkan dalam setiap jangkauan. Zooplankton dikumpulkan dengan menarik jaring zooplankton (ukuran mata jaring 50-μm) melalui kolom air sebanyak 50 kali. Sebagian besar fitoplankton cukup kecil untuk tidak dikumpulkan dalam jaring dengan ukuran mata jaring ini, tetapi sampel diperiksa secara manual di bawah mikroskop Wild M3, dan semua alga dan serpihan yang tersisa disingkirkan. Jaring sapu dengan bukaan 300 × 300 mm dan ukuran mata jaring 250-μm digunakan untuk mengumpulkan makroinvertebrata, ikan nyamuk timur ( Gambisia holbrooki ) dan ikan mas gudgeon ( Hypseleotris spp.) dari zona litoral. Sampel dibilas melalui saringan 250-μm (Nielsen et al., 2016 ) sebelum dikembalikan ke laboratorium. Semua sampel dikeringkan beku sebelum mengirimnya ke laboratorium eksternal untuk analisis isotop.
2.3 Isotop stabil
Untuk analisis isotop stabil, semua sampel ditimbang ke dalam kapsul aluminium foil dan dibakar dalam spektrometer massa Europa ANCA-GSL yang dilengkapi dengan penganalisa isotop stabil Sercon 20–22 IRMS (presisi [1 SD]: δ 13 C = 0,10‰, δ 15 N = 0,20‰ dan rasio C/N = 0,1) tanpa pengasaman (Europa Ltd., Crewe, Inggris Raya). Semua nilai isotop diberikan dalam per mil (‰), dan notasi standar δ digunakan untuk menggambarkan perbedaan relatif dalam rasio isotop antara sampel dan standar yang diketahui (belemnit Vienna Pee Dee).
2.4 Pernyataan replikasi
| Skala inferensi | Skala penerapan faktor minat | Jumlah replikasi pada skala yang sesuai |
|---|---|---|
| Individu | Komposisi δ 13 C individu | 1352 sampel isotop stabil organisme individu |
| Taksa | Taksa δ 13 Komposisi C | Sumber daya (3) dan hewan (7) taksa sampel isotop stabil: Sedimen n = 173; Biofilm n = 200; Seston n = 200; Zooplankton n = 30; Ephemeroptera n = 102; Hemiptera n = 223; Udang n = 137; Udang sungai n = 135; Ikan nyamuk timur n = 70; dan Ikan mas gudgeon n = 72 |
| Masyarakat | Jangkauan makroseep gas alam dan jangkauan referensi | 3 lokasi di setiap jangkauan, diambil sampelnya 6 kali, ~5 sampel per taksa, per waktu pengambilan sampel |
2.5 Kesejahteraan hewan
Pengambilan sampel lapangan dan pengumpulan hewan dilakukan berdasarkan persetujuan izin Queensland General Fisheries no. 192073 dan izin etik CSIRO 2017–2011.
2.6 Analisis data
2.6.1 Tujuan 1—Apakah metana terlarut di kolom air dari rembesan bentik masuk ke dalam jaring makanan sungai?
Untuk Tujuan 1, kami menggunakan PERMANOVA dalam PRIMER v7 (Anderson et al., 2008 ; Clarke & Gorley, 2015 , α ≤ 0,05, 9999 permutasi data mentah, jumlah kuadrat tipe III) untuk menghitung kesamaan Euklides pada data yang belum ditransformasi. Kami menggunakan model 3-faktor (tetap) (Jangkauan: 2 level, rembesan metana dan hulu, Waktu: 6 level, mewakili 6 tanggal pengumpulan, Taksa: 10 level, mewakili organisme sungai) untuk menguji perbedaan antara nilai δ 13 C dari sumber makanan (sedimen, biofilm dan seston) dan hewan (zooplankton, Ephemeroptera ( Tasmanocoenis spp.), Hemiptera (Corixidae), udang ( Parataya australiensis ), udang sungai ( Macrobrachium australiense ), ikan nyamuk timur dan ikan mas gudgeon) di makro-rembesan gas alam dan lokasi referensi pada enam kesempatan antara Agustus 2017 dan Maret 2019. Di semua enam perjalanan dan semua taksa, data kami terdiri dari n = 1352 nilai δ 13 C.
2.6.2 Tujuan 2—Kuantifikasi kontribusi metana terhadap biomassa hewan pada berbagai tingkat trofik dalam zona rembesan
Berdasarkan pemahaman kami tentang perilaku makan hewan-hewan di Sungai Condamine dan bukti dari literatur, kami mengidentifikasi tiga tingkat trofik di antara hewan-hewan yang kami sampel. Kami menempatkan zooplankton dan Ephemeroptera ke tingkat trofik satu; Hemiptera, udang, dan udang sungai ke tingkat trofik 2; dan ikan mas gudgeon dan ikan mosquitofish timur ke tingkat trofik tiga. Pengaturan ini tidak serta-merta menentukan bahwa masing-masing kelompok ini secara langsung memakan yang lain, tetapi lebih kepada jumlah langkah trofik bagi karbon untuk bergerak melalui jaring makanan. Kami juga menggunakan data δ 15 N untuk menghitung Posisi Trofik (TP), terutama untuk visualisasi jaring makanan kami. Untuk masing-masing hewan yang kami kumpulkan dalam zona makrosepi gas alam, kami menerapkan rumus sederhana yang diadaptasi dari Vander Zanden dan Rasmussen ( 1999 ):
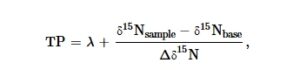
di mana λ adalah tingkat trofik sumber daya basal (seston dan biofilm = 1), δ 15 N sampel adalah rasio isotop nitrogen dari hewan sampel, δ 15 N basa adalah rasio isotop nitrogen dari sumber daya basal, dan Δδ 15 N adalah peningkatan rata-rata N per tingkat trofik (3,4‰). TP secara umum sesuai dengan tingkat trofik yang kami identifikasi dari pengetahuan dan literatur lokal, meskipun zooplankton lebih tinggi dari yang diharapkan, kemungkinan mencerminkan interaksi predator-mangsa dalam kelompok yang luas ini.
Untuk menentukan kontribusi relatif terhadap biomassa hewan dari tiga sumber karbon basal potensial kami (metana (makroseep), akuatik (alga) dan terestrial (serasah)), kami menggunakan model pencampuran Bayesian menggunakan nilai δ 13 C dari tujuh taksa hewan yang dikumpulkan dari dalam zona makroseep gas alam. Tidak ada perbedaan signifikan antara nilai δ 15 N untuk hewan yang dikumpulkan di lokasi referensi dan lokasi metana; dengan demikian, kami mengambil pendekatan konservatif dan menggunakan model 3-sumber isotop tunggal (δ 13 C) yang disederhanakan.
Kami menggunakan model pencampuran isotop tunggal dalam paket MixSIAR di R (Stock & Semmens, 2016 ) untuk memperkirakan kontribusi relatif dari tiga sumber karbon terhadap hewan. Nilai rata-rata (±SD) untuk δ 13 C dihitung untuk setiap sumber karbon basal potensial; metana: -56,3‰ ± 3,05, terestrial -29,7‰ ± 0,83 dan akuatik -19,00‰ ± 2,98 . Nilai anggota akhir terestrial diambil dari sampel serasah redgum ( Eucalyptus camaldulensis ), pohon riparian dominan di antara lokasi kami. Nilai anggota akhir akuatik adalah median sampel alga air tawar yang dilaporkan oleh Bunn et al.
Model kami dirancang untuk memperkirakan kontribusi sumber ketika beberapa sumber memungkinkan, dalam kasus kami, dengan tiga sumber. Namun, keakuratan model bergantung pada validitas asumsi yang dibuatnya. Ini termasuk mengasumsikan bahwa faktor diskriminasi trofik konstan dan diketahui, dan bahwa sumber terwakili dengan baik oleh nilai rata-rata δ 13 C. Model MixSIAR dijalankan dengan empat rantai dengan panjang 20.000.000, dengan burn-in 6000.000, dan penipisan setiap iterasi ke-500. Konvergensi model dinilai menggunakan diagnostik Gelman-Rubin dan Geweke, serta pemeriksaan visual plot jejak. Rantai yang kurang konvergen ditangani dengan menghapus outlier secara berulang dengan z -score lebih besar dari 2 dan residual yang melebihi ±2 SD dari mean. Untuk analisis model pencampuran kami, kami hanya tertarik untuk memeriksa data yang dikumpulkan dari dalam rembesan metana (Lokasi 4, 5 dan 6) untuk masing-masing dari tujuh taksa hewan untuk menentukan kontribusi relatif metana, sumber karbon terestrial dan akuatik.
3 HASIL
3.1 Konsentrasi metana
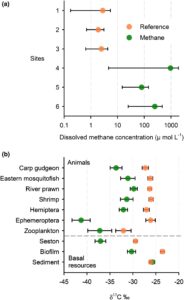
Konsentrasi metana terlarut di antara tiga lokasi rembesan metana tinggi dan bervariasi, berkisar antara 1,5 hingga 2873,8 μ mol L −1 dibandingkan dengan konsentrasi jejak yang diamati (0,1–7,9 μ mol L −1 ) di antara lokasi referensi hulu (Gambar 2a ). Konsentrasi metana rata-rata (±95% CI) di daerah rembesan metana berkisar dari 79,6 (±64,8,0) μ mol L −1 di Lokasi 5 hingga 962,9 ± 958,2 μ mol L −1 di Lokasi 6. Di dalam daerah acuan, konsentrasi metana rata-rata (±95% CI) berkisar dari 1,9 ± 1,2 μ mol L −1 di Lokasi 2 hingga 2,8 ± 2,6 μ mol L −1 di Lokasi 1. Jejak kadar metana yang terdeteksi di antara lokasi hulu kemungkinan merupakan produk metana biogenik dari sedimen dan lebih terkonsentrasi selama periode aliran sungai rendah. Meskipun konsentrasi metana terlarut bervariasi dari waktu ke waktu, konsentrasi tersebut umumnya meningkat antara 2 dan 3 orde besaran di lokasi rembesan metana dibandingkan dengan lokasi acuan hulu.
3.2 Tujuan 1—Apakah metana terlarut di kolom air berperan dalam jaring makanan sungai?
Kami mendeteksi perbedaan signifikan dalam nilai δ 13 C antara taksa yang dikumpulkan dari jangkauan rembesan metana dibandingkan dengan yang dikumpulkan di hulu rembesan metana, meskipun interaksi signifikan diamati (Gambar S1 ; Tabel 1 ). Uji berpasangan menunjukkan bahwa ada perbedaan signifikan antara nilai δ 13 C dari semua taksa yang dikumpulkan dari jangkauan rembesan metana dibandingkan dengan jangkauan hulu kecuali sedimen (Tabel S1 ), dengan taksa yang dikumpulkan dari dalam zona rembesan metana secara konsisten menampilkan nilai δ 13 C yang lebih terkuras daripada yang dikumpulkan di hulu (Gambar 2b ). Di antara sampel yang dikumpulkan dari lokasi rembesan metana, nilai rata-rata (±SD) δ 13 C berkisar dari −54,5 ± 4,98 pada bulan Agustus 2018 hingga −22,2 ± 0,40 pada bulan Desember 2018, keduanya untuk Ephemeroptera. Di antara sampel yang dikumpulkan dari lokasi di hulu jangkauan rembesan metana, nilai rata-rata (±SD) δ 13 C berkisar dari −42,0 pada bulan Agustus 2018 untuk zooplankton hingga −20,1 ± 1,78 untuk Ephemeroptera pada bulan Agustus 2018. Selama keseluruhan periode sampel, perbedaan terbesar antara nilai rata-rata (±95% CI) δ 13 C diamati di antara Ephemeroptera (−41,28 ± 1,98: jangkauan rembesan metana dibandingkan dengan −26,16 ± 1,04: jangkauan hulu) dan kesamaan terbesar diamati di antara sampel sedimen (−25,74 ± 0,49: jangkauan rembesan metana dibandingkan dengan −26,10 ± 0,34: jangkauan hulu, Tabel 2 ). Di antara taksa yang tersisa, nilai rata-rata δ 13 C dalam jangkauan rembesan metana 4,9‰–7,6‰ lebih terkuras dibandingkan dengan jangkauan di hulu (Gambar 2b ; Tabel 2 ).
| Sumber | df | Pseudo- F | P |
|---|---|---|---|
| Mencapai | 1 | 495.46 | 0,0001 |
| Waktu | 5 | 3.438 | 0,0071 tahun |
| Taksa | 9 | 68.166 | 0,0001 |
| Jangkauan × waktu | 5 | 4.5343 | 0,0010 |
| Jangkauan × taksa | 9 | 22.747 | 0,0001 |
| Waktu × taksa | 45 | 4.4783 | 0,0001 |
| Jangkauan × waktu × taksa | 43 | 3.9488 | 0,0001 |
| Taksa | Jangkauan makrosepi gas alam | Jangkauan referensi | ||
|---|---|---|---|---|
| Berarti | ±95% CI | Berarti | ±95% CI | |
| Ikan Mas Gudgeon | -33,66 | 1.30 | -27.30 | 0.69 |
| Ikan nyamuk timur | -31,09 | 1.57 | -26,22 | 0.54 |
| Palaemonidae | -29,81 | 0,77 | -26,33 | 0.44 |
| Suku Atyidae | -31,34 | 1.38 | -26,04 | 0.49 |
| Hemiptera | -32,07 | 0,91 | -27,07 | 0,65 |
| Ephemeroptera | -41,28 | 1.98 | -26,16 | 1.04 |
| Zooplankton | -37,21 | 2.61 | -32,07 | 1.67 |
| Seston | -37,06 | 1.17 | -29,44 | 0.39 |
| lapisan biofilm | -30,29 | 0,89 | -23,56 | 0.44 |
| Endapan | -25,74 | 0.49 | -26.10 | 0.34 |
Perbedaan signifikan dalam nilai δ 13 C taksa terdeteksi antara enam waktu pengumpulan sampel kami, dan ada interaksi signifikan antara jangkauan dan waktu. Uji berpasangan menunjukkan bahwa nilai δ 13 C taksa berbeda secara signifikan antara jangkauan rembesan metana dan jangkauan hulu pada semua tanggal pengumpulan (Tabel S2 ). Ada juga interaksi ‘jangkauan × waktu × taksa’ yang signifikan. Uji berpasangan menunjukkan bahwa meskipun nilai δ 13 C zooplankton secara keseluruhan berbeda antara jangkauan metana dan jangkauan hulu (Tabel S1 ), perbedaannya tidak signifikan pada tanggal sampel mana pun (Tabel S3 ).
3.3 Tujuan 2—Kuantifikasi kontribusi metana terhadap biomassa hewan pada berbagai tingkat trofik dalam jangkauan makrosepi gas alam
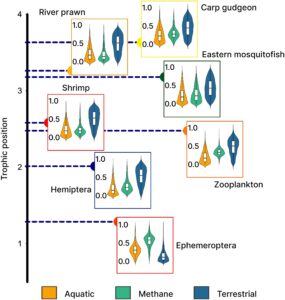
Analisis data δ 15 N mengindikasikan bahwa Ephemeroptera (1,3) menempati TP terendah dalam jaring makanan kita dan ikan mas gudgeon (3,6) menempati TP tertinggi. 5 taksa sisanya berkisar antara 2,0 (Hemiptera) dan 3,3 (udang sungai, Gambar 3 ). Model pencampuran Bayesian MixSIAR memperlihatkan bahwa dalam jangkauan rembesan metana, sumber karbon metana dan terestrial mendominasi kontribusi terhadap hewan (Gambar 3 ). Kontribusi median metana terhadap kandungan karbon hewani tertinggi di antara Ephemeroptera (55%) dan zooplankton (33%) dan terendah di antara udang sungai (16%). Metana bertahan dalam jumlah yang relatif tinggi pada karnivora vertebrata ikan mas gudgeon (median = 28%) dan ikan mosquitofish timur (median = 24%). Kontribusi karbon terestrial median tertinggi di antara Hemiptera (55%), udang (56%) dan udang sungai (55%) dan terendah untuk Ephemeroptera (13%). Kontribusi karbon yang berasal dari alam asli paling tinggi terdapat pada Ephemeroptera (median = 30%) dan ikan mas gudgeon (median = 23%), namun pada seluruh taksa lainnya kontribusinya rendah (median ≤ 20%).
4 DISKUSI
Kami menemukan dukungan kuat untuk hipotesis pertama kami, yang menunjukkan bahwa nilai δ 13 C dari tujuh hewan yang kami sampel di zona makroseep gas alam secara signifikan lebih terkuras daripada taksa hewan yang sama yang dikumpulkan dari lokasi referensi, yang mengonfirmasi penggabungan metana gas alam ke jaring makanan kontemporer. Investigasi kami juga menghasilkan dukungan untuk hipotesis kedua kami, yang mengungkap persistensi karbon yang berasal dari metana pada hewan di beberapa tingkat trofik jaring makanan sungai dalam jangkauan makroseep gas alam. Karbon yang berasal dari metana biogenik dimobilisasi dari konsumen primer yang memakan metanotrof dan dipindahkan ke serikat trofik yang lebih tinggi dan menjadi sumber karbon ketiga yang signifikan untuk dua spesies ikan karnivora—ikan nyamuk timur (24%) dan ikan mas gudgeon (28%). Dalam jangkauan makroseep gas alam, metana berfungsi sebagai sumber karbon basal utama untuk konsumen primer lalat capung (yang sebagian besar termasuk dalam genus Tasmanocoenis spp.), yang berkontribusi 55% dari total anggaran karbon mereka. Setelah metana, karbon yang berasal dari daratan (alokton) muncul sebagai penyumbang utama bagi hewan, sementara karbon yang berasal dari perairan (autokton) hadir dalam proporsi yang sederhana di semua taksa. Di antara Decapoda, karbon yang berasal dari daratan mendominasi kontribusi biomassa, memasok hingga 55% karbon untuk udang sungai dan 56% untuk udang, sementara kontribusi karbon autokton umumnya lebih rendah (≤20%). Temuan kami menunjukkan bahwa untuk lokasi di mana metana terlarut jauh di atas konsentrasi latar belakang, metana mudah diserap ke dalam jaring makanan sungai, membentuk jalur konsumen utama metana gas alam–bakteri metanotropik, yang menggarisbawahi signifikansinya sebagai saluran energi yang berpotensi dominan dalam ekosistem yang dicirikan oleh konsentrasi metana terlarut yang tinggi.
4.1 Pola penambahan metana ke dalam jaring makanan
Metana dapat menjadi sumber karbon utama bagi organisme yang hidup di akuifer dataran banjir sungai yang bercabang (DelVecchia et al., 2016 ); namun, di aliran sungai dan anak sungai, sebagian besar penelitian difokuskan pada pemahaman peran metana dari metanogenesis in situ daripada metana yang berasal dari gas alam (Stanley et al., 2016 ). Konsentrasi metana terlarut dalam jangkauan makro-rembesan gas alam sangat tinggi (hingga 2873,8 μ mol L −1 ) dibandingkan dengan konsentrasi fluvial global metana yang berasal dari metanogenesis di sungai (≤386 μ mol L −1 ; Stanley et al., 2016 ). Biofilm dan seston secara signifikan terkuras δ 13 C dalam lokasi makro-rembesan gas alam dibandingkan dengan lokasi referensi. Deplesi biofilm dan seston δ 13 C dapat disebabkan oleh penggabungan langsung bakteri metanotropik dalam sampel atau dari organisme fotosintetik dalam sampel yang memanfaatkan karbon dioksida yang berasal dari metana, yaitu CO 2 yang timbul dari metanotropik. Menyelesaikan kontribusi relatif dari setiap jalur berada di luar cakupan studi ini, tetapi kemungkinan keduanya merupakan kontributor.
Di antara hewan, kontribusi terhadap biomassa dari gas alam metana paling tinggi pada konsumen primer zooplankton dan Ephemeroptera, yang terakhir sebagian besar terdiri dari Tasmanocoenis spp. Tasmanocoenis spp. adalah pemakan detrital bentik dan cenderung mengonsumsi bakteri metanotropik secara langsung dari biofilm dan akumulasi detrital di benthos. Nilai δ 13 C untuk Tasmanocoenis spp. lebih terkuras daripada biofilm yang terkumpul di dalam jangkauan rembesan metana, yang menunjukkan potensi seleksi preferensial bakteri pengoksidasi metana (MOB) dari biofilm. Nutrisi serangga yang sebagian besar didasarkan pada bakteri sebagai pengganti organisme eukariotik telah ditunjukkan di tempat lain (Pranal et al., 1996 ), dan ada bukti kuat untuk konsumsi langsung MOB oleh larva chironomid, didukung oleh analisis isotop dan deteksi asam lemak fosfolipid yang mendiagnosis MOB (Deines et al., 2007 ; Kiyashko et al., 2004 ).
Sebaliknya, kebiasaan makan zooplankton sangat bervariasi antara taksa, meskipun banyak spesies adalah pemakan planktonik (Sommer & Sommer, 2006 ). Karbon yang berasal dari metana dapat memasuki jaring makanan pelagis secara langsung melalui penyaringan MOB oleh zooplankton cladocera (Deines & Fink, 2011 ), dan meskipun penambahan MOB dapat mengimbangi jumlah makanan yang terbatas, penulis tidak menemukan bukti untuk peningkatan kualitatif makanan melalui jalur trofik MOB. Sangat mungkin bahwa penggabungan karbon yang berasal dari metana ke dalam biomassa zooplankton di dalam Sungai Condamine terjadi baik dengan memakan langsung bakteri metanotropik dan dengan memangsa organisme lain yang telah mengonsumsi MOB (misalnya protozoa, Murase & Frenzel, 2008 ). TP zooplankton yang lebih tinggi dibandingkan dengan invertebrata lain dalam penelitian ini dapat menjadi indikasi dari lingkaran makan mikroinvertebrata yang memusatkan karbon yang berasal dari metana dalam kelompok ini.
Meskipun penambahan metana terbesar ke biomassa diamati di antara Ephemeroptera dan zooplankton, nilai δ 13 C yang terkuras secara signifikan dalam makroseeps bertahan hingga tingkat vertebrata dalam jaring makanan kita. Bukti asimilasi karbon biogenik yang berasal dari metana ke seluruh jaring makanan akuatik telah didokumentasikan dari ekosistem danau (Sanseverino et al., 2012 ) dan terdapat banyak literatur yang mengeksplorasi subsidi karbon ke jaring makanan laut di dekat rembesan dingin (misalnya Niemann et al., 2013 ), meskipun studi air tawar yang mengeksplorasi peran metana gas alam dalam ekosistem sungai masih sedikit. Kontribusi karbon metanogenik terhadap biomassa vertebrata di Sungai Condamine (24%; ikan mosquitofish timur, 28%: ikan mas gudgeon) lebih tinggi daripada kontribusi yang didokumentasikan dari ekosistem danau, di mana karbon yang berasal dari metana dari konsorsium mikroba berkontribusi hingga 17% terhadap biomassa ikan (Ravinet et al., 2010 ). Ikan mas gudgeon merupakan ikan karnivora yang memangsa makroinvertebrata dan zooplankton (Balcombe & Humphries, 2006 ) dan di sini, mereka kemungkinan besar memakan Ephemeroptera dan zooplankton kaya metana secara langsung yang keduanya melimpah di zona rembesan metana.
Menariknya, kontribusi median karbon terestrial untuk kedua spesies ikan tersebut hampir sama (~45%). Hal ini mengejutkan, karena meskipun ikan nyamuk timur juga karnivora, mulut mereka yang terbalik (superior) beradaptasi untuk makan di permukaan dan mereka lebih menyukai daerah pesisir dan permukaan habitat perairan, dibuktikan oleh penelitian yang menggambarkan proporsi tinggi serangga terestrial dalam makanan mereka (García-Berthou, 1999 ; Specziár, 2004 ). Kami berharap bahwa adaptasi dan perilaku makan ini akan mengarah pada ketergantungan yang lebih besar pada subsidi karbon terestrial oleh ikan nyamuk timur daripada ikan mas gudgeon, tetapi di sini kami tidak mengamati pola ini.
Meskipun subsidi metana terus berlanjut pada karnivora vertebrata, kontribusi metana tertinggi terjadi pada hewan di dasar jaring makanan. Pola ini tidak mengejutkan mengingat kontribusi titik sumber metana dalam zona makrosemburat gas alam. Sementara konsumen primer yang dikumpulkan dalam zona makrosemburat gas alam kemungkinan besar memakan bakteri metanotropik secara langsung, mereka juga memiliki kapasitas untuk beremigrasi keluar dari jangkauan atau berimigrasi dari jangkauan hulu (baik secara pasif maupun aktif). Predator zona rembesan metana kemungkinan besar memakan taksa endemik dan imigran, yang berpotensi melemahkan sinyal karbon yang berasal dari metana. Predator mungkin juga telah masuk dan keluar dari zona rembesan metana, memakan sebagian mangsa dari luar jangkauan rembesan metana. Dengan demikian, kami memperkirakan sinyal yang berasal dari metana akan terus melemah dengan peningkatan TP dan mobilitas hewan.
Selama periode studi, Sungai Condamine mengalami beberapa variasi hidrologi yang signifikan, dengan periode hampir berhenti mengalir yang diselingi oleh banjir yang meningkatkan tinggi sungai sebanyak 8 m (dari <~4000 ML hari -1 hingga ~25.000 ML hari -1 ; Gambar S2 ). Kami berharap bahwa fluktuasi debit sebagian besar bertanggung jawab atas variabilitas tinggi dalam konsentrasi metana terlarut yang tercatat di antara lokasi makroseep gas alam, meskipun mereka tidak tercermin secara kuat di antara nilai δ 13 C terintegrasi-waktu dari hewan yang tetap relatif konsisten setelah puncak debit (Gambar S2 ). Kami berharap bahwa selama periode aliran tinggi, konsentrasi metana terlarut menurun dan bahwa selama aliran rendah yang terjadi adalah sebaliknya. Namun, kami tidak memiliki data yang cukup untuk mengeksplorasi pola lebih lanjut, dan aspek hidrolik dari studi ini memerlukan penyelidikan lebih lanjut (yaitu peran debit dalam interaksi signifikan antara jangkauan dan waktu yang kami amati dari nilai δ 13 C sumber daya dan hewan).
4.2 Karbon terestrial versus karbon akuatik?
Kontribusi relatif sumber karbon allochthonous dibandingkan dengan sumber karbon autochthonous terhadap tingkat trofik yang lebih tinggi dalam jaring makanan sungai sering diperdebatkan (misalnya Brett et al., 2017 ), dan ketergantungan dapat bervariasi secara spasial dan temporal dalam tipe ekosistem. Dalam ekosistem sungai dataran rendah Australia, karbon yang berasal dari daratan dapat berlimpah (McInerney et al., 2017 ; Rees et al., 2020 ) karena dataran banjir yang didominasi Eucalyptus camaldulensis , meskipun umumnya kualitas makanannya lebih buruk daripada karbon yang difiksasi oleh autotrof akuatik (McInerney et al., 2023 ), dengan implikasi untuk ordo trofik yang lebih tinggi (McInerney et al., 2022 ). Kami terkejut melihat ketergantungan yang tinggi pada karbon terestrial oleh Decapoda (udang dan udang sungai) dibandingkan dengan metana atau karbon yang berasal dari perairan, karena penelitian sebelumnya telah menunjukkan ketergantungan yang kuat pada sumber perairan, dan khususnya, cyanobacteria (Burns & Walker, 2000 ). Burns dan Walker ( 2000 ) melaporkan nilai δ 13 C sebesar −25,44‰ hingga −26,37‰, n = 5 untuk udang dan −21,32‰ hingga −25,68‰, n = 5 untuk udang sungai dari daerah dataran banjir Murray River dan mengaitkan makanan utama mereka (berdasarkan isi usus dan SIA) dengan cyanobacteria berfilamen (δ 13 C; −24,4 ± 1,6) yang mencakup sebagian besar biofilm dalam jangkauan studi mereka. Nilai δ 13 C udang dan udang sungai , bahkan dalam jangkauan referensi kami, lebih terkuras daripada nilai yang dilaporkan oleh Burns dan Walker ( 2000 ), dengan nilai rata-rata kami di ujung bawah rentangnya (rata-rata (±95% CI); −26,0 ± 0,5 n = 71 dan −26,3 ± 0,4 n = 85 masing-masing), dan jauh lebih dekat ke anggota akhir terestrial kami (−29,7‰) daripada anggota akhir akuatik kami (−19,00‰). Lebih jauh, nilai rata-rata zona referensi (±95% CI) biofilm δ 13 C kami lebih diperkaya (−23,6 ± 0,4, n = 99), menunjukkan bahwa Decapod dalam penelitian kami memiliki ketergantungan yang lebih besar pada sumber makanan yang mengandung karbon yang berasal dari sumber terestrial daripada yang dilaporkan oleh Burns dan Walker ( 2000 ). Ini dapat mencakup biofilm bakteri dan jamur, tetapi juga mikroinvertebrata yang bergantung pada detritus dan bahan organik terestrial untuk makanan, misalnya Rotifera. Meskipun sangat bergantung pada karbon yang berasal dari daratan di antara semua taksa kita (kecuali Ephemeroptera), karbon autotrofik tetap menjadi kontributor kuat bagi biomassa hewan untuk beberapa taksa, memasok 30% karbon ke konsumen primer Ephemeroptera dan 23% ke ikan mas pemakan invertebrata. Kami berharap bahwa sumber karbon yang melimpah, dalam kasus penelitian kami dari metana dan serasah redgum yang membandel, mudah dimasukkan ke dalam biomassa hewan melalui jalur yang diuraikan dalam Gambar 1 , tetapi karbon autokton yang labil (meskipun berkontribusi lebih sedikit terhadap biomassa keseluruhan) tetap menjadi sumber penting molekul esensial (misalnya asam lemak tak jenuh ganda rantai panjang). Analogi yang tepat di sini mungkin sereal sarapan dengan buah di atasnya; sereal menyediakan karbohidrat yang diperlukan untuk aktivitas (karbon terestrial membandel berkualitas rendah) dan buah menyediakan nutrisi esensial (karbon alga berkualitas tinggi yang kaya akan asam lemak esensial) untuk memenuhi kebutuhan nutrisi untuk pertumbuhan dan reproduksi somatik. Ketergantungan hewan pada satu sumber atau lainnya kemungkinan bersifat dinamis dan akan diatur oleh ketersediaan sumber tertentu dan energi yang dibutuhkan untuk mendapatkannya (sensu, McInerney et al., 2023 ).
5 KESIMPULAN
Meskipun keterkaitan jaring makanan yang luas yang melibatkan karbon yang berasal dari metana telah ditunjukkan di antara sungai-sungai yang diberi makan air tanah (misalnya Sampson et al., 2019 ; Shelley et al., 2014 ), prevalensi dan kekuatan keterkaitan metana yang berasal dari gas alam dalam jaring makanan sungai masih belum pasti. Di sini, kami mengidentifikasi integrasi karbon kemoautotrofik di sungai-sungai dengan besaran yang sebanding dengan yang ditunjukkan di antara makroseeps laut (misalnya kontribusi terhadap biomassa predator >10%; MacAvoy et al., 2002 , 2008 ). Ekologi sungai telah difokuskan pada peran dua sumber karbon basal pada jaring makanan: 1/karbon autokton dan 2/karbon alokton. Di sini, kami menunjukkan terjadinya jalur ketiga: jalur metana gas alam–bakteri metanotrofik–konsumen primer. Kami menggarisbawahi signifikansinya sebagai saluran energi yang berpotensi mendominasi di sungai dengan konsentrasi metana terlarut yang tinggi, yang menunjukkan redundansi preferensi makan pada tingkat trofik yang rendah. Kami juga membandingkan kontribusi relatif terhadap kandungan karbon hewan dari 1/autotrof akuatik yang menghasilkan biomassa melalui fotosintesis, 2/bakteri dan jamur heterotrofik yang menguraikan serasah terestrial dan DOC yang berasal dari terestrial dan 3/bakteri metanotrofik yang menggunakan metana sebagai sumber karbon (energi). Kami menetapkan bahwa untuk beberapa invertebrata sungai bentik, sumber utama karbon basal dapat berasal dari makrosepi gas alam.



