ABSTRAK
Danau Tana, Danau Cagar Biosfer Dunia UNESCO. Danau ini mengandung 50% air tawar dan tanah subur di Ethiopia, yang mendukung urbanisasi, pertanian, dan irigasi, yang berdampak pada ekosistemnya. Memahami dampak degradasi zona penyangga pada plankton dan kualitas air sangat penting untuk pemanfaatan sumber daya yang berkelanjutan. Oleh karena itu, pengumpulan data dilakukan dari Desember 2020 hingga Mei 2021 di zona penyangga, dua zona non-penyangga, dan wilayah pelagis di bagian utara dan timur laut Danau Tana dua kali sebulan. Studi ini menyoroti variabilitas spasial yang signifikan dalam kualitas air dan komposisi plankton, yang menekankan peran penting zona penyangga untuk menjaga kesehatan Danau Tana. Suhu air, oksigen terlarut (DO), kedalaman Secchi, total padatan terlarut (TDS) dan konsentrasi nutrisi bervariasi secara signifikan di seluruh lokasi, dengan zona penyangga yang terdegradasi (Seraba dan Kirrigna) menunjukkan kondisi yang lebih buruk dibandingkan dengan daerah penyangga (Debresina) dan pelagis. Komunitas fitoplankton didominasi oleh Chlorophyceae (46,15%), diikuti oleh Bacillariophyceae (30,77%), Cyanophyceae (19,23%) dan Euglenophyceae (3,85%). Microcystis adalah genus yang paling melimpah di semua lokasi tetapi kurang lazim di daerah zona penyangga. Komposisi zooplankton juga bervariasi secara signifikan, dengan Rotifera mendominasi atas Copepoda dan Cladocera. Konsentrasi klorofil- a (Chl- a ), indikator biomassa fitoplankton, tertinggi di daerah penyangga dan pelagis, menunjukkan korelasi positif dengan DO dan korelasi negatif dengan suhu dan kekeruhan. Aktivitas manusia berdampak signifikan terhadap kualitas air dan keanekaragaman plankton, sebagaimana dibuktikan oleh korelasi yang kuat dengan skor penilaian gangguan manusia (HDA). Perbedaan signifikan diamati antara lokasi untuk sebagian besar parameter, kecuali suhu, kandungan oksigen dan keanekaragaman zooplankton. Konsentrasi rata-rata Chl -a lebih tinggi di daerah pelagis (2,64 µg/L) dan Debresina (5,3 µg/L) dibandingkan dengan Seraba (2,34 µg/L) dan Kirrigna (2,48 µg/L). Temuan ini menekankan kebutuhan mendesak bagi para pembuat kebijakan dan pemangku kepentingan untuk melindungi dan memulihkan zona penyangga Danau Tana.
1 Pendahuluan
Zona penyangga adalah area perlindungan yang dibangun di antara lingkungan yang berbeda untuk meminimalkan dampak pada sistem air atau mengurangi dampak buruk. Ini umumnya digunakan untuk mengurangi dampak lingkungan antropogenik dan alami. Zona penyangga dapat berupa vegetasi alami atau terkelola dan sangat penting untuk melindungi ekosistem seperti Danau Tana (Stendera dan Johnson 2006 ). Fungsinya adalah menyaring sedimen, sisa tanaman, puing, mikroorganisme, nutrisi dan pestisida dari limpasan, sehingga meminimalkan kontaminasi ekosistem yang berdekatan. Mereka juga mencegat limpasan dataran tinggi dan menyaring polutan melalui proses seperti imobilisasi, penyimpanan dan konversi kimia (Stendera dan Johnson 2006 ). Selain mitigasi dampak, zona penyangga meningkatkan keanekaragaman hayati dengan menyediakan habitat bagi invertebrata air, plankton dan ikan. Degradasi zona ini mengganggu komunitas plankton dan layanan ekosistem, mempercepat penurunan kualitas air (Soranno et al. 2009 ). Namun, Danau Tana, danau terbesar di Ethiopia, telah kehilangan banyak zona penyangga alaminya karena dampak antropogenik (Goshu dan Aynalem 2017 ), terutama melalui konversi lahan basah, eksploitasi berlebihan sumber daya lahan basah, pemukiman dan budidaya garis pantai. Dengan demikian, degradasi telah meningkatkan masuknya sedimen langsung, nutrisi dan polutan ke danau, khususnya di zona litoral (Wondie 2018 ). Goshu dan Aynalem ( 2017 ) juga mencatat berkurangnya efisiensi penyaringan nutrisi dan memburuknya risiko eutrofikasi. Fluktuasi air musiman, banjir selama musim hujan dan penyusutan di musim kemarau semakin mendorong pertanian garis pantai, memperparah stres (Mequanent dan Mingist 2019 ; Mequanent et al. 2025 ).
Danau Tana merupakan sumber Sungai Nil Biru dan menjadi rumah bagi keanekaragaman hayati yang unik di dunia, termasuk 28 spesies ikan, 17 di antaranya termasuk dalam kawanan Labeobarbu spp. endemik (Getahun dan Dejen 2012 ). Namun, ekosistem danau menghadapi tekanan antropogenik yang meningkat, seperti pertanian intensif, perluasan irigasi, penggunaan agrokimia berlebihan, limbah yang tidak diolah, dan pengelolaan daerah aliran sungai yang tidak memadai, yang semuanya mengancam kualitas air dan keanekaragaman hayati (Mequanent et al. 2025 ). Akibatnya, sebagian besar zona penyangga alami danau telah diubah menjadi daerah pertanian, sehingga ekosistem rentan terhadap degradasi (Wondie 2018 ).
Danau (Danau Tana) juga menjadi rumah bagi lebih dari 180 spesies plankton (85 fitoplankton, 95 zooplankton), yang menunjukkan spesies tropis dan sedang; ini mungkin karena danau ini merupakan danau dataran tinggi (Wondie et al. 2007 ). Daerah garis pantai mendukung keanekaragaman yang lebih besar daripada daerah pelagis; hal ini disebabkan oleh heterogenitas habitat (Mequanent et al. 2025 ). Namun, degradasi zona penyangga alami danau yang penting untuk penyaringan nutrisi dan stabilisasi garis pantai telah meningkat karena tekanan antropogenik (Kahsay et al. 2022 ), yang berisiko kelebihan nutrisi dan gangguan habitat yang memengaruhi komunitas plankton dan dinamika trofik (Setegn et al. 2009, 2010 ). Meskipun sebelumnya telah banyak penelitian, seperti penelitian yang difokuskan pada perikanan (Getahun dan Dejen, 2012 ) dan pengaruh irigasi (Mequanent dan Mingist, 2019 ; Mequanent et al., 2021 , 2022 ), namun peran zona penyangga dalam dinamika keanekaragaman plankton masih kurang diteliti.
Untuk mengatasi hal ini, studi terkini membandingkan komposisi, kelimpahan, biomassa, dan dinamika plankton di empat lokasi di bagian utara dan timur laut Danau Tana: Debresina (lahan basah yang dilindungi dengan vegetasi yang rapat di dekat Biara Debresina Maryam), Seraba (zona penyangga yang terdegradasi), Kirrigna (garis pantai yang tandus dan tidak dilindungi), dan wilayah pelagis (perairan terbuka), yang, karena tidak dapat diakses oleh manusia, merupakan kondisi perairan terbuka. Selain itu, area-area ini diprioritaskan karena tekanan antropogenik yang tinggi, termasuk proyek irigasi Megech Seraba, polusi dari Kota Gondar melalui Sungai Megech dan anak-anak sungainya (sungai Dimaza, Keha, Angereb, dan Shina), serta tekanan dari Kota Gorgora. Dengan demikian, dengan membandingkan plankton dan kualitas air di seluruh lokasi ini, studi ini memberikan rekomendasi yang dapat ditindaklanjuti untuk menjaga sistem Danau Tana. Artinya, dari temuan-temuan ini, para pembuat kebijakan dapat mengambil tindakan untuk pemulihan dan pengembangan zona penyangga Danau Tana.
2 Bahan dan Metode
2.1 Deskripsi Daerah Penelitian
Penelitian ini dilakukan di Danau Tana (ketinggian sekitar 1830 m), danau air tawar terbesar di Ethiopia, yang menyumbang hampir setengah dari pasokan air tawar negara itu, terletak di Ethiopia Timur Laut antara garis lintang 10°58′–12°47′ LU dan garis bujur 36°45′–38°14′ BT. Danau tersebut, sebuah danau kawah yang terbentuk dua juta tahun yang lalu karena aktivitas vulkanik, adalah sumber Sungai Nil Biru. Ini adalah danau mesotrofik yang dangkal (kedalaman rata-rata 8 m, kedalaman maksimum 14 m), keruh dan tercampur dengan baik, dan tidak memiliki termoklin (Wondie et al. 2007 ). Danau Tana adalah sumber daya alam yang penting dan dianggap sebagai salah satu dari 250 wilayah danau teratas di dunia dalam hal keanekaragaman hayati (Worku 2017 ). UNESCO telah menetapkannya sebagai ekosistem Cagar Biosfer Dunia (Damtie et al. 2017 ). Danau dan lahan basah yang berdekatan secara langsung dan tidak langsung mendukung mata pencaharian lebih dari 500.000 orang (Vijverberg et al. 2009 ). Danau ini dialiri oleh sejumlah sungai, termasuk Gelgel Abbay, Gumara, Ribb, Megech, Dirma, Gelda, Arno-Garno dan sekitar 30 aliran musiman (Getahun dan Dejen 2012 ). Sungai Gilgel Abay dan Megech memasuki danau dari sisi barat daya dan utara, sedangkan sungai Gumara dan Rib masuk dari timur (Getahun dan Dejen 2012 ). Sungai Nil Biru adalah aliran keluar alami danau, sedangkan Tana Belles adalah aliran keluar buatan.
Danau ini telah berubah secara signifikan karena pengaruh antropogenik pada garis pantai dan lahan basah riparian (Taffese et al. 2014 ). Meningkatnya tren penggunaan lahan pertanian di dalam daerah tangkapan air danau telah berdampak besar pada masukan sedimen dan nutrisi (Andualem dan Gebremariam 2015 ). Sekitar 55% dari total luas permukaan lahan daerah tangkapan air Danau Tana adalah pertanian, 21,06% adalah air, 10,38% adalah padang rumput, 1,6% adalah lahan basah/rawa, dan 0,39% adalah hutan alam. Dataran banjir di sepanjang perbatasan utara danau (Libo Kemkem dan Dembia) dan timur (Fogera) sering banjir selama musim hujan (Imoobe dan Christopher 2010 ; Vijverberg et al. 2014 ). Selama musim kemarau, dataran banjir ini terutama digunakan untuk pertanian dan penggembalaan ternak. Pertanian campuran (produksi tanaman dan ternak) merupakan praktik pertanian umum di Sub-cekungan Danau Tana. Sebagian besar sedimen besar yang diangkut ke danau diendapkan dan mengendap di badan air (Goshu dan Aynalem 2017 ). Invasi eceng gondok sebagian besar ditemukan di sepanjang pantai timur laut danau (Dersseh et al. 2019 ).
Sampel dikumpulkan dari empat lokasi di bagian utara dan timur laut Danau Tana: tiga dari daerah pesisir (Debresina, Seraba, dan Kirrigna) dan satu dari daerah pelagis (Gambar 1 ). Sisi timur laut Danau Tana dipilih karena berbagai kondisi dan aktivitas manusia di zona penyangga, yang diyakini memengaruhi struktur dan biomassa plankton.
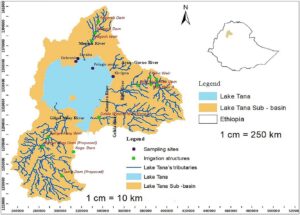
2.2 Pemilihan dan Deskripsi Lokasi Sampel
Lima karakteristik zona penyangga dievaluasi menggunakan penginderaan jauh, sistem informasi geografis (SIG) dan penilaian gangguan manusia (HDA) (Gernes dan Helgen 2002 ), dan juga dilengkapi dengan pengamatan visual (Lampiran S4 ). HDA mengkategorikan gangguan ke dalam lima tingkat (tidak ada [0], minimal [1], sedang [2], tinggi [3] dan parah [4–5]) berdasarkan jenis penggunaan lahan yang ada dan aktivitas antropogenik, dengan gangguan parah termasuk praktik intensif seperti pengambilan air, penyiraman ternak, penangkapan ikan, permukiman, proyek irigasi dan resesi pertanian yang tidak diatur.
Untuk menilai dampak kondisi zona penyangga pada dinamika plankton, sampel dikumpulkan dari empat lokasi di sepanjang area pantai utara dan timur laut Danau Tana: tiga zona litoral (Debresina, Seraba dan Kirrigna) dan satu lokasi pelagis ( Lampiran S1–S4 dan Gambar 2 ). Lokasi-lokasi ini dipilih karena lokasi-lokasi tersebut paling baik untuk mewakili zona penyangga kondisi lingkungan dan gangguan manusia. Debresina (Gambar 2A ), yang berdekatan dengan Biara Debresina-Maryam, menampilkan zona penyangga yang dilindungi dan ditumbuhi vegetasi, sedangkan lokasi pelagis di zona limnetik sebagian besar tidak terpengaruh oleh limpasan pertanian selama musim kemarau. Sebaliknya, Seraba (Gambar 2B ) menunjukkan degradasi yang parah karena tidak memiliki vegetasi penyangga, dan garis pantai tandus Kirrigna tidak memiliki perlindungan penyangga (Gambar 2C ). Deskripsi terperinci dari lokasi pengambilan sampel telah dijelaskan dalam Lampiran S1 –S 4 . Berdasarkan skor HDA, area tersebut tercermin sebagai Seraba (93% gangguan parah), Kirrigna (64% sedang), Debresina (31% minor) dan lokasi pelagis (5,7% minimal), yang sejalan dengan tujuan studi untuk menghubungkan integritas zona penyangga dengan kualitas air dan keanekaragaman plankton. Lokasi pengambilan sampel terlihat pada Gambar 1 dan 2 .

2.3 Pengumpulan Data
Untuk menilai dampak degradasi zona penyangga pada kualitas air dan keanekaragaman plankton di bagian utara dan timur laut Danau Tana, sampel plankton dan kualitas air dikumpulkan dari empat lokasi dua kali sebulan antara Desember 2020 dan Mei 2021. Setiap kejadian pengambilan sampel telah dilakukan dengan tiga kali replikasi. Periode ini sengaja dipilih karena pada musim kemarau, hal itu memastikan keandalan data, karena musim hujan memperkenalkan faktor pengganggu seperti luapan air dari daerah tangkapan air di hulu (efek banjir berlebih) dan aliran balik dari Danau Tana itu sendiri. Fenomena ini mengaburkan pengaruh zona penyangga pada keanekaragaman plankton dan parameter kualitas air, membuat analisis temporal tidak praktis. Lebih jauh, banjir selama musim hujan mempersulit pemilihan lokasi, memperkuat alasan untuk fokus pada musim kemarau. Metodologi terperinci untuk pengambilan sampel plankton dan kualitas air (parameter fisikokimia dan nutrisi) diuraikan dalam bagian berikut.
2.3.1 Pengambilan Sampel Parameter Fisikokimia
Pengambilan sampel beberapa parameter fisikokimia seperti suhu air (°C), DO (mg/L), pH, konduktivitas, total padatan terlarut (TDS), kekeruhan (NTU) dan kedalaman Secchi dilakukan di lokasi dan dicatat menggunakan parameter multi-probe YSI-30. Pengukuran dilakukan dengan tiga kali ulangan di setiap lokasi, dan nilai rata-rata dari ulangan tersebut digunakan untuk analisis. Transparansi air diukur menggunakan cakram Secchi berdiameter 20 cm. Pengukuran dilakukan dan dikumpulkan antara pukul 09:00 dan 13:00 di lokasi pengambilan sampel di daerah pelagis dan tiga zona pesisir di bagian timur laut Danau Tana. Teknik standar (APHA 2017 ) digunakan untuk menganalisis berbagai parameter fisikokimia.
2.3.2 Pengambilan Sampel Nutrisi
Total nitrogen (TN) dan total fosfor (TP) sampel dikumpulkan untuk studi ini karena mereka mencerminkan produktivitas keseluruhan suatu sistem (Wetzel 2001 ). Sampel air untuk analisis TN dan TP dikumpulkan pada kedalaman 20-30 cm, dengan tiga replikasi di setiap lokasi. Sampel komposit dari air yang dikumpulkan disaring dan disimpan dalam botol plastik bersih. Untuk menghindari kontaminasi, sampel dikumpulkan dari kedalaman hingga 20-30 cm di danau sebelum pengambilan sampel plankton. Air permukaan yang dikumpulkan disaring dan disimpan dalam dua botol plastik bersih (0,5 L). Setelah pelabelan, sampel-sampel ini ditempatkan dalam kotak dingin untuk transportasi dan disimpan dalam lemari es pada suhu 4 ° C sampai analisis.
2.3.3 Pengambilan Sampel Plankton
Sampel fitoplankton dan zooplankton dikumpulkan dua kali sebulan dengan menyaring 42 L air sampel menggunakan jaring plankton dengan ukuran mata jaring 40 µm dan diameter 30 cm, dan pengambilan air langsung (pengambilan sampel air) juga dilakukan untuk memasukkan plankton berukuran kecil. Selama pengambilan sampel, tiga kali pengambilan sampel ulangan dilakukan dari setiap lokasi pengambilan sampel. Semua sampel ulangan yang dikumpulkan dihomogenkan dalam satu wadah untuk mendapatkan sampel komposit. Volume air komposit dipekatkan menjadi 100 mL menggunakan botol yang telah dicuci dan segera diawetkan dalam formalin 4% dan larutan iodin Lugol untuk zooplankton dan fitoplankton, masing-masing, hingga sampel diperiksa di laboratorium.
2.4 Pekerjaan Laboratorium
2.4.1 Nutrisi
Investigasi/analisis data untuk nutrisi yang terlarut dalam air dilakukan di laboratorium; sampel air disaring melalui filter fiberglass GF/F 0,45 µm untuk mengonsentrasikan total nitrogen terlarut (TN, mg/L) dan TP (mg/L). Untuk memastikan keakuratan dan meminimalkan kontaminasi, semua peralatan gelas dan unit penyaringan dibersihkan terlebih dahulu dengan air deionisasi yang dicuci dengan asam.
Konsentrasi TP dianalisis menggunakan metode pencernaan persulfat, diikuti oleh metode asam askorbat, sesuai dengan protokol analisis kualitas air standar. Pendekatan ini melibatkan oksidasi semua bentuk fosfor (organik dan anorganik) menjadi ortofosfat melalui pencernaan kalium persulfat, diikuti oleh penentuan kolorimetri ortofosfat menggunakan metode asam askorbat. Kompleks biru yang dihasilkan diukur pada 880 nm menggunakan spektrofotometer. Demikian pula, TN ditentukan menggunakan metode Kjeldahl, yang melibatkan proses dua langkah: (1) pencernaan sampel dengan asam sulfat untuk mengubah senyawa nitrogen organik menjadi ion amonium dan (2) konversi ion amonium menjadi amonia melalui proses distilasi basa. Amonia yang dilepaskan kemudian diukur untuk menentukan kandungan TN dalam sampel asli, seperti yang dijelaskan dalam APHA ( 2017 ).
2.4.2 Plankton
Setelah kerja lapangan, analisis data plankton dilakukan di laboratorium. Pertama, sampel yang diawetkan dihomogenkan secara menyeluruh menggunakan pipet mulut lebar untuk memastikan distribusi organisme yang merata; spesimen dicampur secara menyeluruh. Subsampel 50 mL diekstraksi dengan hati-hati dan dipindahkan ke slide kaca dan cawan Petri untuk pemeriksaan mikroskopis, dan kemudian identifikasi/observasi spesies dilakukan menggunakan mikroskop majemuk terbalik pada perbesaran 20x dan 50x; identifikasi spesies dilakukan menggunakan mikroskop dengan bantuan kunci identifikasi dan alat identifikasi daring. Itu adalah identifikasi taksonomi yang terperinci; fitoplankton dan zooplankton diidentifikasi sebanyak mungkin; organisme diidentifikasi hingga tingkat taksonomi serendah mungkin (sebaiknya tingkat spesies) menggunakan monograf taksonomi, kunci identifikasi (Bellinger dan Sigee 2015 ) dan basis data daring yang diverifikasi. Analisis kuantitatif dilakukan melalui penghitungan langsung, dengan individu yang dihitung menggunakan ruang hitung yang dikalibrasi; individu dalam setiap sampel dihitung menggunakan kisi atau ruang hitung. Hitungan diulang untuk setiap lokasi pengambilan sampel, dan kemudian data diekstrapolasi untuk memperkirakan kelimpahan plankton per liter air; individu per liter (ind/L).
2.4.3 Penentuan Klorofil -a (Chl -a ) Biomassa Fitoplankton
Untuk estimasi Chl -a , sejumlah volume sampel fitoplankton komposit yang sesuai disaring dengan kertas saring serat kaca (GF/F) dan segera dibekukan dalam lemari pendingin (Haier atau HYCD-215) pada suhu -29°C selama 24 jam. Filtrat diekstraksi dengan 3 mL aseton 90% dan ditempatkan dalam lemari pendingin (Haier atau HYCD-215) pada suhu -29°C selama 24 jam. Ekstrak pigmen ditempatkan dalam tabung sentrifus (Sentrifus CL Model IEC) untuk menghilangkan partikel tersuspensi. Sentrifus diputar pada 3000 rpm selama 10 menit untuk menjernihkan sampel. Satu kuvet diisi dengan aseton 90% untuk kalibrasi, dan kuvet yang tersisa diisi dengan masing-masing sampel. Spektrofotometer (NV-203) dihidupkan setidaknya selama 5 menit sebelum digunakan untuk mengukur penyerapan cahaya dalam sampel. Kuvet berisi aseton ditempatkan dalam spektrofotometer, dan pembacaan ditetapkan pada angka nol. Masing-masing sampel ditempatkan dalam spektrofotometer, dan absorbansi dicatat pada panjang gelombang 665 dan 750 µm sebelum dan setelah pengasaman dengan 0,1 mL HCl 1 N (Wetzel dan Likens 2000 ). Total kandungan Chl -a dihitung menggunakan rumus Jeffrey dan Humphrey ( 1975 ):
![]()
di mana 665 b dan 750 b adalah absorbansi pada 665 dan 750 nm sebelum pengasaman, masing-masing, dan 665 dan 750 adalah absorbansi pada 665 dan 750 nm setelah pengasaman, masing-masing. Ve adalah volume ekstrak dalam mL, VI adalah volume sampel yang disaring dalam liter, dan z adalah panjang lintasan kuvet (1 cm).
2.5 Analisis Data
Parameter kualitas air (fisikokimia dan nutrisi) dianalisis menggunakan statistik deskriptif dan disajikan sebagai mean ± simpangan baku (SD). Koefisien korelasi Pearson digunakan untuk menilai hubungan antara setiap parameter fisikokimia, Chl- a dan skor gangguan manusia di lokasi pengambilan sampel. Untuk mengevaluasi perbedaan parameter kualitas air antar lokasi, ANOVA satu arah (analisis varians) dilakukan. Tukey’s HSD post hoc digunakan untuk menguji perbedaan berpasangan yang teridentifikasi. Nilai kualitas air rata-rata di setiap lokasi dibandingkan dengan batas standar air tawar untuk organisme akuatik (Environmental Protection Agency 2018 ).
Untuk analisis keanekaragaman, komposisi, kelimpahan, dan biomassa plankton, estimasi dianalisis dan disajikan menggunakan statistik deskriptif dan ANOVA satu arah, dan analisis dominasi digunakan untuk membandingkan komunitas fitoplankton di seluruh lokasi. Kelimpahan rata-rata (rata-rata ± SD) dihitung untuk setiap takson guna menilai variasi spasial. Perbedaan signifikan diidentifikasi menggunakan ANOVA satu arah ( nilai F dan p ) dan diikuti oleh uji post hoc Tukey’s HSD (dilambangkan dengan huruf superskrip; huruf yang sama menunjukkan tidak ada perbedaan signifikan). Analisis dominasi menentukan spesies yang paling melimpah di setiap lokasi, dengan kelimpahan relatif (RA %) menyoroti kontributor utama bagi struktur komunitas.
Untuk analisis Chl -a , statistik deskriptif memberikan gambaran umum tentang variabilitas produksi Chl -a di berbagai lokasi. Analisis komponen utama (PCA) dengan visualisasi biplot digunakan untuk menyoroti interaksi yang kompleks, khususnya yang melibatkan Chl -a .
Indeks keanekaragaman plankton: Indeks keanekaragaman Shannon (SDI), rata-rata, kisaran, kelimpahan minimum dan maksimum spesies plankton digunakan untuk menggambarkan struktur komunitas plankton (Margurran 1988 ). Indeks keanekaragaman yang paling umum digunakan adalah indeks Shannon–Weiner (Odum 1971 ), dengan menggunakan rumus berikut:
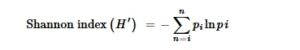
di mana H ′ adalah indeks keanekaragaman Shannon–Wiener;
=
/N ;
adalah jumlah individu spesies ( i ); N adalah jumlah total individu.
Semua jenis pengujian dilakukan pada tingkat keyakinan 95% ( α = 0,05). Untuk analisis statistik, digunakan perangkat lunak R dan perangkat lunak PAST v4.02; Microsoft Excel digunakan untuk perhitungan dasar; dan GIS digunakan untuk pembuatan peta studi.
3 Hasil dan Pembahasan
3.1 Fisikokimia dan Nutrisi
Suhu rata-rata tertinggi terdapat di Seraba (26,04°C ± 1,6°C), dan kandungan DO (mg/L) lebih tinggi di lokasi Debresina dibandingkan dengan lokasi lainnya. Akan tetapi, tidak ada parameter yang menunjukkan perbedaan signifikan secara statistik antar lokasi ( p > 0,05). Sebaliknya, parameter lainnya (kedalaman Secchi, TDS, konduktivitas, kekeruhan, TP dan TN) menunjukkan perbedaan yang sangat signifikan ( p < 0,05) antar lokasi (Gambar 3 ).
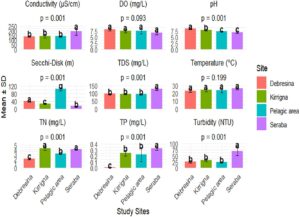
Kisaran suhu air (19,5–27,9°C) di bagian timur laut Danau Tana berada dalam kisaran yang sesuai (14°C–39,5°C) untuk spesies akuatik. Menurut Tibebe et al. ( 2019 ), suhu di bawah 14°C dan di atas 39,5°C berbahaya, terutama bagi spesies tropis. Variasi suhu di antara lokasi tersebut mungkin disebabkan oleh aktivitas antropogenik di zona penyangga yang terdegradasi di sepanjang tepi danau dan daerah aliran sungai. Suhu terendah (23,30°C ± 1,99°C) di lokasi Debresina dapat dikaitkan dengan kapasitas penyangga atau efek naungan dari makrofita yang padat (Wetzel 2001 ).
Nilai DO rata-rata berkisar antara 6,71 mg/L di Seraba hingga 7,99 mg/L di Debresina. Kadar DO di bawah 3 mg/L bersifat stres bagi sebagian besar organisme akuatik, sedangkan nilai 5–6 mg/L biasanya diperlukan untuk mendukung fungsi biologisnya (Campbell dan Wildberger 1992 ). DO mungkin merupakan variabel kualitas air yang paling kritis bagi kehidupan akuatik (Boyd dan Lichtkoppler 1979, 1992 ). Variasi kadar DO mungkin disebabkan oleh difusi langsung dari aktivitas fotosintesis autotrof (Etim et al. 2013) ). DO tertinggi yang diamati di Debresina dapat dikaitkan dengan aktivitas fotosintesis makrofita yang dilindungi dan produk sampingan fotosintesis dari fitoplankton. Sebaliknya, kadar DO terendah di lokasi Seraba dan Kirrigna dapat disebabkan oleh berkurangnya kelarutan oksigen pada suhu yang lebih tinggi. Selain itu, masuknya langsung bahan organik dari lahan pertanian di dekatnya, dekomposisi berikutnya, dan penggunaan lahan basah yang berdekatan secara luas untuk penggembalaan ternak kemungkinan berkontribusi terhadap rendahnya kadar oksigen terlarut di lokasi tersebut. Hal ini menyoroti peran penting dekomposisi oksidatif bahan organik dalam memengaruhi konsentrasi oksigen.
pH badan air berfluktuasi secara diurn, meningkat pada siang hari dan menurun pada malam hari karena dinamika karbon dioksida yang didorong oleh fotosintesis dan aktivitas metabolisme (Boyd dan Lichtkoppler 1979, 1992 ). Dalam penelitian ini, pH berkisar antara 6,89 hingga 8,3 (Gambar 3 ), kisaran yang dianggap cocok untuk kesehatan dan produksi plankton, karena sebagian besar tumbuhan dan hewan akuatik berjuang untuk menoleransi kadar di bawah 5 atau di atas 9, dan kisaran pH optimal untuk plankton adalah 6,5–9, yang sejalan dengan nilai yang ditemukan dalam penelitian ini (Twomey et al. 2009 ). Namun, toleransi beberapa spesies bervariasi; misalnya, cyanobacteria dapat tumbuh subur dalam kondisi pH yang lebih tinggi (hingga 9,5) dan dapat mengalahkan plankton lain di lingkungan yang kaya nutrisi. Ini menyoroti kompleksitas toleransi pH di antara organisme akuatik.
pH rendah (<5) secara konsisten telah dikaitkan dengan kerusakan insang ikan dan kematian plankton, sedangkan penyimpangan sedang (5,5–6,0) dapat mengurangi reproduksi zooplankton (Lien et al. 2023 ). Perubahan iklim juga memperburuk fluktuasi pH diurnal, khususnya melalui eutrofikasi, yang dapat diakibatkan oleh tangkapan air badan air, yang mengintensifkan lonjakan pH siang hari dan penurunan pH malam hari, sehingga meningkatkan stres pada sistem kehidupan akuatik. Selain itu, limpasan nutrisi (terutama nitrogen dan fosfor) dari sumber pertanian memasuki badan air dari daerah tangkapan air bagian atas, yang merupakan hal yang baik untuk mekarnya alga yang selanjutnya memperkuat variasi pH ini (Jeppesen et al. 2011 ).
Kedalaman Secchi rata-rata berkisar dari 13,33 cm di Seraba hingga 105,54 cm di daerah pelagis. Kekeruhan menunjukkan variasi yang signifikan ( p <0,05) di berbagai lokasi pengambilan sampel (Gambar 3 ), mengikuti pola yang sama yang diamati untuk transparansi (Gambar 3 ). Daerah dekat pantai menunjukkan tingkat kekeruhan yang jauh lebih tinggi ( p <0,01) dibandingkan dengan lokasi lepas pantai, kemungkinan karena zona litoral dangkal lebih sensitif terhadap partikel tersuspensi dari berbagai aktivitas manusia; selain itu, pencampuran turbulensi yang disebabkan angin lebih banyak terjadi di daerah pelagis yang lebih dalam (Dokulil dan Teubner 2000 ). Temuan-temuan dalam studi ini sangat selaras dengan penelitian yang dilakukan di area yang sama dalam studi ini (Mequanent et al. 2025 ) dan danau-danau Ethiopia lainnya, seperti Danau Ziway dan Danau Hawassa. Misalnya, variasi serupa dalam kedalaman dan kekeruhan Secchi telah diamati, dengan daerah dekat pantai biasanya menunjukkan kekeruhan yang lebih tinggi karena resuspensi sedimen dan aktivitas manusia, sedangkan daerah pelagis menunjukkan transparansi yang lebih besar (Wondie et al. 2007 ; Tilahun et al. 2022 ). Peran makrofita dalam mengurangi kekeruhan, seperti yang terlihat di lokasi Debresina, konsisten dengan penelitian oleh Horppila dan Nurminen ( 2001 ) dan Gebrehiwot et al. ( 2017 ), yang menemukan bahwa makrofita yang muncul meredam aksi gelombang dan mengurangi resuspensi sedimen. Selain itu, penelitian saat ini menemukan bahwa pantai berpasir, seperti Kirrigna, memiliki kekeruhan yang lebih rendah dibandingkan dengan pantai berlumpur, seperti Seraba, yang didukung oleh temuan dari bagian dan waktu lain di danau yang sama (Danau Tana) di mana substrat berpasir menyaring partikel tersuspensi secara lebih efektif (Wondie et al. 2007 ). Namun, pola yang kontras terdapat di danau yang lebih eutrofik seperti Danau Awassa, di mana daerah pelagis menunjukkan kekeruhan yang lebih tinggi, yang mengakibatkan mekarnya alga daripada di daerah dekat pantai (Tilahun et al. 2022 ). Selain itu, menurut Talling et al. ( 2015 ), lokasi pantai berpasir dapat menyaring air yang bergolak dan mengurangi resuspensi sedimen, sehingga mengurangi kekeruhan dibandingkan dengan pantai berlumpur dan tepi danau. Tentu saja, Danau Awassa lebih kecil dibandingkan dengan Danau Tana.
Nilai rata-rata konduktivitas (µS/cm) berkisar dari 140 di Debresina hingga 191,95 di Seraba (Gambar 3 ). Pembebanan organik dari limbah domestik dan industri, pupuk dan pestisida dapat meningkatkan konsentrasi ion air danau dan, selanjutnya, konduktivitas (Mequanent et al. 2025 ). Seraba, yang merupakan lokasi pengambilan sampel tanpa penyangga, memiliki puncak konduktivitas listrik terbesar, sedangkan lokasi Debresina memiliki konduktivitas listrik terendah. Padatan terlarut yang diukur berkisar dari 94 mg/L (area Pelagis) hingga 129 mg/L (lokasi Seraba) (Gambar 3 ) dan jauh di atas kisaran standar (10–20 mg/L) seperti yang direkomendasikan oleh Dudgeon et al. ( 2006 ). Lonjakan konduktivitas di dekat area perkotaan dan industri karena limbah yang tidak diolah dan limpasan agrokimia (yaitu, tidak ada zona penyangga) (Fetahi 2019 ; Tessema et al. 2020 ), paralel dengan temuan kami bahwa Seraba, lokasi tanpa penyangga, menunjukkan konduktivitas yang lebih tinggi dari beban organik dari daerah tangkapan air. Demikian pula, penelitian di Sungai Yamuna India menemukan tingkat konduktivitas mencapai 250 µS/cm di dekat zona industri, didorong oleh limpasan pertanian dan pembuangan air limbah dari daerah tangkapan airnya (Smith dan Sharman 2013 ). Penelitian terbaru di Ethiopia menyoroti limbah/efluen sebagai kontributor utama polusi ionik (Lemessa et al. 2023 ). Perbedaan juga muncul dalam efek penyangga dari studi danau lembah retakan Ethiopia (Lemessa et al. 2023 ) yang mengonfirmasi konduktivitas yang lebih rendah di zona penyangga bervegetasi, mendukung perbandingan studi ini, Seraba dan Debresina. Sebaliknya, lahan basah Brasil menunjukkan konduktivitas yang lebih tinggi di daerah penyangga karena pencucian mineral alami dari daerah tersebut dan air yang disaring (de Mello Cionek et al. 2021 ), yang menggarisbawahi variabilitas geografis. Mengenai padatan terlarut, temuan studi ini (94–129 mg/L) (Gambar 3 ) selaras dengan studi Danau Tana sejauh ini, di mana levelnya melebihi pedoman karena erosi dan pertanian. Selain itu, penguapan yang disebabkan oleh iklim, faktor utama dalam memusatkan ion selama musim kemarau di Ethiopia, masih belum dibahas dalam pembahasan studi ini (Goshu dan Aynalem 2017 ).
TN dan TP ditemukan memiliki variabilitas spasial yang substansial ( p < 0,05) (Gambar 3 ). Konsentrasi TP minimum (0,01) di Debresina dan maksimum (0,33) di lokasi Seraba ditunjukkan pada Gambar 3. Konsentrasi TN minimum (1,64) dan maksimum (4,864) tercatat di lokasi Debresina dan Kirrigna, masing-masing. Variasi spasial konsentrasi rata-rata TN dan TP secara signifikan lebih tinggi di lokasi litoral dibandingkan dengan daerah pelagis. Tren peningkatan mungkin karena pengayaan nutrisi zona litoral danau dari sumber antropogenik di daerah tangkapan air (Hou et al. 2013 ; Dersseh et al. 2019 ). Konsentrasi TP dan TN yang lebih rendah yang diamati di lokasi Debresina mungkin karena penyerapan oleh komunitas makrofita, bakteri, dan fitoplankton.
Variabilitas spasial TN dan TP dalam ekosistem perairan mencerminkan pengaruh alami dan antropogenik, dengan kesamaan dan kontras yang nyata di seluruh lokasi, yang sejalan dengan TN tinggi yang diamati di lokasi Kirrigna. Demikian pula, di Danau Taihu Tiongkok, TP berfluktuasi antara 0,02 mg/L di perairan terbuka dan 0,35 mg/L di dekat zona akuakultur, yang sangat mirip dengan puncak TP di lokasi Seraba. Namun, berbagai penelitian di Ethiopia melaporkan konsentrasi TN dan TP yang lebih tinggi di daerah pelagis selama mekarnya alga, yang kontras dengan tren yang berfokus pada pesisir yang diamati dalam penelitian ini. Penelitian di Danau Hawassa mengaitkan peningkatan TN dan TP pesisir dengan pembuangan tepi danau dari sumber titik dan nontitik (Lencha et al. 2021 ).
3.2 Komposisi dan Kelimpahan Spesies Fitoplankton
Dalam penelitian saat ini, komunitas fitoplankton didominasi oleh Chlorophyceae (46,15%), diikuti oleh Bacillariophyceae (30,77%), Cyanophyceae (19,23%) dan Euglenophyceae (3,85%) (Lampiran S5 ). Dalam hal kekayaan spesies, Chlorophyceae menunjukkan keanekaragaman tertinggi dengan 24 spesies, diikuti oleh Bacillariophyceae (16 spesies), Cyanophyceae (10 spesies) dan Euglenophyceae (2 spesies). Genera yang menonjol adalah (1) Cyanophyceae ( Microcystis dan Anabaena ) (penghasil toksin potensial); (2) Chlorophyceae ( Scenedesmus dan Pediastrum ) (bioindikator umum); dan (3) Bacillariophyceae: Navicula dan Nitzschia (Lampiran S5 ). Temuan ini selaras dengan penelitian sebelumnya oleh Melaku ( 2017 ) di teluk selatan Danau Tana. Jumlah rata-rata spesies bervariasi secara signifikan antar lokasi ( p < 0,05) (Tabel 1 ); hal ini kemungkinan besar disebabkan oleh perbedaan karakteristik lingkungan yang dipengaruhi oleh ada atau tidaknya zona penyangga.
| Takson | Debresina | Seraba | Kirrigna | Pelagis | Nilai F dan p | Spesies dominan (RA %) di lokasi (ind/L) |
|---|---|---|---|---|---|---|
| Rata-rata ± SD (ind/L) | ||||||
| Tumbuhan Cyanophyta | 10,0 ± 0,93 miliar | 16,2 ± 2,2 jam | 10,3 ± 1,93 miliar | 9,1 ± 3,30 detik | Nilai F = 10,28, p < 0,001 | Microcystis spp. (masing-masing 71,4/84,4/81,4/77,1) |
| Klorofitosis | 10,1 ± 1,93 detik | 2,6 ± 0,35 detik | 4,8 ± 0,69 miliar | 4,6 ± 0,76 miliar | Nilai F = 50,42, p < 0,001 | Oedogonium spp. (masing-masing 37,6/32,1/31,8/26,8) |
| Bakteriofage | 8,8 ± 1,10 per menit | 6,1 ± 1,17 miliar | 8,5 ± 1,42 jam | 6,5 ± 0,77 miliar | Nilai F = 8,76 dan nilai p = 0,001. | Aulacoseira spp. (masing-masing 30,7/47,9/41,6/51,8) |
| Euglenophyta | 0,2 ± 0,07 satu | 0,1 ± 0,02 miliar | 0,1 ± 0,01 b | 0,1 ± 0,04 b | Nilai F = 15,19, p < 0,001 | — |
| Jumlah fitoplankton | 29,5 ± 1,87 jam | 24,5 ± 2,99 miliar | 25,3 ± 1,89 miliar | 20,6 ± 3,90 detik | Nilai F = 10,59, p < 0,001 | — |
Catatan : Huruf yang berbeda (a–c) dalam beberapa bahan mentah menunjukkan perbedaan yang signifikan satu sama lain ( p < 0,05). —(seluruh sel) = Tidak ada spesies dominan yang teridentifikasi di lokasi mana pun.
Kelimpahan fitoplankton menunjukkan variasi spasial yang signifikan di antara lokasi ( p < 0,01) (Tabel 1 ). Total RA tertinggi (ind/L) diamati di Debresina (29,5 ± 1,8), diikuti oleh Kirrigna (25,29 ± 1,89), Seraba (24,5 ± 2,991) dan daerah pelagis (20,6 ± 3,90) (Tabel 1 ). Spesies Microcystis mendominasi semua lokasi, dengan RA melebihi 71,36%. Dominasi Microcystis yang lebih rendah di Debresina (71,36%) dibandingkan dengan lokasi lain (77,07%–84,38%) diyakini karena peran perlindungan zona penyangga dalam mengurangi dampak polusi (Lampiran S6 dan Tabel 1 ).
Studi yang dilakukan di berbagai bagian Danau Tana secara konsisten melaporkan Chlorophyceae sebagai kelompok fitoplankton yang dominan (42%), diikuti oleh Bacillariophyceae (35%) (Goshu dan Aynalem 2017 ). Cyanophyceae jumlahnya lebih sedikit (15%); kemungkinan besar karena polusi nutrisi yang lebih rendah di daerah pelagis. Sebaliknya, danau perkotaan yang sangat tercemar, seperti Danau Hawassa, didominasi oleh Cyanophyceae (55%–60%), yang mungkin disebabkan oleh eutrofikasi. Demikian pula, waduk eutrofik di Brasil melaporkan bahwa Cyanophyceae menyumbang lebih dari 50% fitoplankton, dengan mekarnya Microcystis yang terkait dengan limpasan pertanian dan tidak ada zona penyangga untuk mencegah masuknya limbah ke danau (Assemany et al. 2015) ). Kelimpahan Cyanophyceae yang relatif lebih rendah (19,23%) dalam studi saat ini menunjukkan bahwa eutrofikasi kurang parah di zona penyangga area studi dan fungsi area zona penyangga.
Keanekaragaman hayati plankton dipengaruhi oleh faktor lingkungan internal dan eksternal (Villamagna dan Murphy 2010 ; Liu et al. 2023 ). Dalam studi saat ini, lokasi tanpa zona penyangga, karena pengelolaan daerah aliran sungai yang buruk dan penggundulan hutan, merupakan pemicu stres utama yang berkontribusi terhadap hilangnya keanekaragaman hayati plankton. Temuan ini sejalan dengan Mereta et al. ( 2020 ), yang melaporkan bahwa pembuangan air limbah yang tidak diolah di Danau Hawassa menyebabkan mekarnya sianobakteri beracun; hal ini disebabkan oleh tidak adanya zona penyangga. Demikian pula, Fetahi ( 2019 ) melaporkan bahwa limpasan nutrisi dari pertanian petani kecil di sekitar danau Ethiopia, yang tidak memiliki zona penyangga, menyebabkan eutrofikasi dan berkurangnya keanekaragaman fitoplankton. Demikian pula, dominasi sianobakteri di Danau Erie telah dikaitkan dengan limpasan pupuk (Andersen et al. 2019 ), yang konsisten dengan temuan studi ini.
Zona penyangga yang dilindungi, yang memiliki makrofita akuatik, seperti yang ada di lokasi Debresina, diyakini memainkan peran penting dalam menjaga keanekaragaman plankton, yang serupa dengan pemikiran Richardson et al. ( 2015 ). Serupa dengan temuan penelitian ini, Gebrehiwot et al. ( 2017 ) melaporkan bahwa daerah yang kaya dengan makrofita di Danau Ziway mendukung kekayaan plankton yang lebih tinggi. Pentingnya kompleksitas habitat pesisir telah terdokumentasi dengan baik; Jeppesen et al. ( 2007, 2011 ) melaporkan bahwa danau Denmark dengan makrofita memiliki keanekaragaman plankton 30% lebih tinggi dibandingkan dengan danau keruh. Dengan cara yang sama, González-Piana et al. ( 2018 ) dan Petersen et al. ( 2020) ) menemukan bahwa bendungan di area dengan vegetasi riparian (yang dapat dianggap sebagai area zona penyangga) melindungi komunitas plankton. Hasil ini serupa dengan keberhasilan yang terlihat di Debresina, yang merupakan lokasi penelitian saat ini.
Di zona terdegradasi, Seraba dan Kirrigna, kekeruhan tinggi, DO rendah dan peningkatan suhu diamati (Tabel 1 ). Kondisi ini sejalan dengan temuan Tilahun dan Ahlgren ( 2010 ), yang dikaitkan dengan deforestasi (tidak ada zona penyangga) yang menyebabkan masuknya sedimen dengan penurunan plankton di Danau Abaya. Tilahun dan Ahlgren ( 2010) ) juga melaporkan bahwa peningkatan suhu di danau Lembah Rift mengurangi keanekaragaman copepoda.
Dalam isu lain, kumpulan eceng gondok yang rapat yang diamati di dekat Seraba dan Kirrigna juga mungkin memengaruhi keanekaragaman fitoplankton melalui persaingan nutrisi dan alelopati (Su et al. 2015 ), seperti yang dilaporkan Engdaw ( 2020 ) bahwa eceng gondok dapat menghasilkan zat bioaktif yang menghambat pertumbuhan alga. Selain itu, di beberapa bagian situs yang tidak terdapat eceng gondok, masuknya beban nutrisi yang berlebihan dari limpasan pertanian dan limbah yang tidak diolah semakin memperburuk hilangnya keanekaragaman hayati fitoplankton karena pencegahan penetrasi cahaya. Di sisi lain, dominasi Microcystis di Seraba dan Kirrigna (71%–84% RA) sejalan dengan temuan dari danau Lembah Rift, tempat kadar TP dan TN yang tinggi mendukung cyanobacteria penghasil toksin (Fetahi 2019 ).
3.3 Komposisi dan Kelimpahan Spesies Zooplankton
Sepuluh spesies zooplankton yang signifikan diidentifikasi dalam studi saat ini, termasuk tiga copepoda, tiga cladocera, dan empat rotifera (Tabel 2 ). Rotifera mendominasi komunitas zooplankton, konsisten dengan temuan dari danau-danau Ethiopia (Fetahi 2019 ; Tessema et al. 2020 ). Dalam studi ini, komposisi zooplankton di empat lokasi menunjukkan variasi spasial yang signifikan ( p < 0,05), dengan kepadatan yang lebih tinggi di zona litoral dan kepadatan yang lebih rendah di daerah pelagis. Di antara lokasi litoral (Debresina, Seraba, dan Kirrigna), kelimpahan zooplankton juga bervariasi secara signifikan ( p < 0,05) (Tabel 2 ). Variasi ini selaras dengan studi dinamika zooplankton tropis terhadap faktor-faktor seperti kekeruhan, ketinggian air, suhu, dan stratifikasi (Dejen et al. 2004 ).
| Takson | Debresina | Seraba | Kirrigna | Pelagis | Nilai F | nilai p | Spesies dominan (RA %) (ind / L) |
|---|---|---|---|---|---|---|---|
| Rata-rata ± SD (ind/L) | |||||||
| Kopepoda | 205 ± 30,4 jam | 123 ± 21,8 miliar | 163 ± 26,4 detik | 68 ± 7,7 hari | 37.94 | 0,001 | Siklopoida: 73,3% (D), 74,7% (S), 61,4% (K), 80,8% (P) |
| Ordo Cyclopoida | 150 ± 28,2 jam | 92 ± 20,8 miliar | 100 ± 24,1 miliar | 55 ± 7,6 detik | 19.85 | 0,001 | Termosiklops : 61,4% (D), 53,9% (S), 62,3% (K), 68,3% (P) |
| Mesocyclops spp. | 58 ± 5,2 jam | 43 ± 18,3 inci | 38 ± 11,3 tahun | 17 ± 2,9 detik | Tanggal 13.22 | 0,001 | M. leuckarti : 100% (semua situs) |
| Ordo Calanoida | 55 ± 13,4 jam | 31 ± 5,5 tahun | 63 ± 23,1 jam | 13 ± 2,6 miliar | 16.28 | 0,001 | Eudiaptomus : 100% (semua situs) |
| Cladocera | 150 ± 23,9 tahun | 77 ± 5,5 detik | 94 ± 16,2 SM | 118 ± 24,4 miliar | 16.33 | 0,001 | Bosmina: 39,9% (D), 45,4% (S), 28,5% (K), 50,8% (P) |
| Rotifera | 197 ± 34,3 tahun | 107 ± 19,8 miliar | 112 ± 17,5 tahun | 79 ± 9,6 miliar | Tanggal 31.40 | 0,001 | Brachionus spp.//Brachionus: 33,1% (D), 37,9% (S), 42,1% (K), 58,0% (P) |
| Total | 551 ± 60,2 tahun | 307 ± 27,6 detik | 369 ± 49,4 miliar | 265 ± 24,6 hari | 51.68 | 0,001 | |
Catatan : Huruf-huruf superskrip yang berbeda ( a , b , d ) dalam satu baris menunjukkan perbedaan yang signifikan (Tukey’s HSD, p < 0,05). Huruf-huruf yang sama menunjukkan tidak ada perbedaan yang signifikan. RA % = Kisaran persentase kelimpahan relatif di seluruh lokasi. Singkatan lokasi: D (Debresina), S (Seraba), K (Kirrigna), P (Wilayah Pelagis).
Kelimpahan Cladoceran yang rendah dibandingkan dengan copepoda dan rotifera mungkin disebabkan oleh kekeruhan yang tinggi, tekanan pemangsaan dari nila Nil muda ( Oreochromis niloticus ), dan faktor lingkungan lainnya. Dominasi Rotifera (empat spesies) atas Copepoda dan Cladocera sesuai dengan temuan di danau Lembah Rift Ethiopia (Fetahi et al. 2014 ) dan Danau Tana (Krylov et al. 2020 ). Sebaliknya, kelimpahan Cladoceran dalam penelitian ini (Bosminidae dan Daphniidae) lebih rendah daripada di Danau Hawassa, di mana mereka merupakan 25% dari zooplankton (Beyene et al. 2022 ).
Kepadatan zooplankton mencapai puncaknya di zona litoral (Debresina, Seraba dan Kirrigna) dan terendah di daerah pelagis (Tabel 2 ), yang konsisten dengan temuan dari Danau Ziway, di mana makrofita (yang dapat dianggap sebagai zona penyangga) meningkatkan keanekaragaman hayati litoral dan tinggi (Gebrehiwot et al. 2017 ). Demikian pula, danau dangkal Denmark melaporkan kekayaan zooplankton 30% lebih tinggi di zona litoral yang ditumbuhi vegetasi (Jeppesen et al. 2007 ). Kelimpahan Cladoceran yang rendah dalam penelitian saat ini mungkin disebabkan oleh kekeruhan yang tinggi dan pemangsaan ikan nila ( O. niloticus ), karena itu juga merupakan kasus yang diamati di Danau Hawassa (Fetahi et al. 2014 ). Sebaliknya, Cladoceran mendominasi di Danau Victoria, di mana pemangsaan visual kurang efektif (King et al. 2024 ). ).
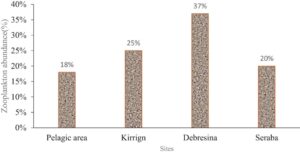
Debresina memiliki kelimpahan zooplankton tertinggi (37% dari total zooplankton), hampir dua kali lipat dari daerah pelagis (18%) (Gambar 4 ), yang konsisten dengan Wudneh ( 1998 ), yang melaporkan bahwa ada kepadatan zooplankton yang lebih tinggi di zona litoral. Tekanan predasi kemungkinan besar menjelaskan kelimpahan pelagis yang lebih rendah (Dejen et al. 2004 ). Copepoda, terutama cyclopoid (73% spesies copepoda), mendominasi, dengan Thermocyclops dan Mesocyclops menjadi yang paling umum dalam penelitian saat ini. Ini sejalan dengan penelitian yang melaporkan dominasi copepoda di danau tropis dan subtropis (Fetahi et al. 2011 ; Enawgaw et al. 2018 ). Ini mungkin merupakan hasil dari migrasi horizontal mereka dari daerah pelagis ke daerah litoral ke dalam makrofita, mencari perlindungan dari predator (Burks et al. 2002 ).
Cladocerans, terutama dari famili Bosminidae, Moinidae dan Daphniidae, kurang melimpah di lokasi terdegradasi (Seraba dan Kirrigna) dibandingkan dengan daerah pelagis, konsisten dengan Dejen et al. ( 2004 ), yang melaporkan bahwa dominasi Cladoceran yang lebih tinggi berada di zona sublittoral. Di daerah pelagis, spesies Bosmina dan Daphnia lebih umum; itu bisa jadi karena berkurangnya predasi ikan (Hirpo 2018 ). Sebaliknya, danau dangkal Denmark menunjukkan kelimpahan Cladoceran yang lebih tinggi di zona litoral karena perlindungan makrofita (di mana makrofita dapat dianggap sebagai daerah penyangga dan tempat berlindung bagi zooplankton dari predator) (Jeppesen et al. 2007 ). Selain itu, danau Ethiopia dengan kekeruhan melebihi 50 NTU secara tidak proporsional menekan Cladocerans, melampaui rata-rata global (Kondowe et al. 2022 ).
3.4 Keanekaragaman Spesies Plankton
Dalam studi saat ini, di bagian utara dan timur laut Danau Tana, SDI ( H ′) untuk fitoplankton berkisar antara 1,90 ± 0,24 hingga 2,90 ± 0,11, yang menunjukkan keanekaragaman sedang. Nilai tertinggi tercatat di lokasi Debresina ( H ′ = 2,90), sedangkan yang terendah berada di Seraba ( H ′ = 1,90), yang menunjukkan sedikit struktur habitat yang cukup stabil (Tabel 3 ). Sebagai perbandingan, Melaku ( 2017 ) melaporkan nilai H ′ rata-rata yang sedikit lebih rendah yaitu 1,6 untuk fitoplankton di Teluk Selatan Danau Tana, yang berpotensi disebabkan oleh perbedaan ketersediaan nutrisi dan tingkat polusi. Demikian pula, Krylov et al. ( 2020 ) menemukan nilai H ′ rata-rata sebesar 1,87 di Danau Tana Timur Laut, yang sangat sesuai dengan temuan studi saat ini.
| planktonik | Indeks Keanekaragaman | Situs | Rata-rata ± SD | Minimum | Maksimum | Pnilai |
|---|---|---|---|---|---|---|
| Fitoplankton | Indeks keanekaragaman Shannon | Debresina | 2,90 ± 0,11 | 2.45 | 3.13 | 0,047 tahun |
| Seraba | 1,90 ± 0,24 | 1.57 | 2.18 | |||
| Kirrigna | 2,58 ± 0,22 | 2.24 | 2.8 | |||
| Daerah pelagis | 2,70 ± 0,36 | 2.22 | 3 | |||
| Rata-rata | 2,50 ± 0,11 | 2.01 | 2.78 | |||
| Zooplankton | Indeks keanekaragaman Shannon | Debresina | 3,98 ± 0,05 | 3.9 | 4.02 | 0,078 tahun |
| Seraba | 3,92 ± 0,06 | 3.8 | 3.96 | |||
| Kirrigna | 3,93 ± 0,01 | 3.7 | 4.07 | |||
| Daerah pelagis | 4,00 ± 0,14 | 3.7 | 4.14 | |||
| Rata-rata | 3,95 ± 0,09 | 3.78 | 4.04 |
Singkatan: SD, deviasi standar.
Sebaliknya, zooplankton menunjukkan keanekaragaman yang tinggi, dengan nilai H ′ berkisar antara 3,92 hingga 4,00 (Tabel 3 ). Ini kontras dengan keanekaragaman zooplankton yang lebih rendah yang dilaporkan di danau-danau Lembah Rift Ethiopia, seperti Danau Hawassa ( H ′ = 2,5–3,2); ini kemungkinan besar karena tekanan antropogenik dan eutrofikasi yang lebih tinggi (Beyene et al. 2022 ). Secara umum, keanekaragaman fitoplankton sedang dan keanekaragaman zooplankton yang tinggi dalam studi ini menunjukkan adanya struktur habitat yang relatif stabil, dengan variasi yang kemungkinan dipengaruhi oleh kondisi lingkungan setempat dan faktor antropogenik, degradasi zona penyangga, yang menyerupai pemikiran Gómez et al. ( 2022 ) dan juga dengan Garcia-Ayllon dan Radke ( 2021 ).
3.5 Biomassa Fitoplankton (Chl- a) )
Konsentrasi Chl -a bervariasi secara signifikan di keempat lokasi penelitian (Debresina, Pelagic, Kirrigna, dan Seraba) dari Desember 2020 hingga Mei 2021 ( p < 0,05). Debresina memiliki rata-rata Chl- a tertinggi (5,30 µg/L), berbeda secara signifikan dari lokasi lainnya ( p < 0,001). Sebaliknya, lokasi pelagis (2,64 µg/L), Kirrigna (2,48 µg/L), dan Seraba (2,34 µg/L) menunjukkan nilai yang lebih rendah dan secara statistik serupa ( p > 0,05) (Tabel 4 ). Nilai Chl -a yang tercatat lebih tinggi di Debresina kemungkinan besar disebabkan oleh adanya kondisi yang menguntungkan, seperti transparansi air yang lebih tinggi, yang meningkatkan ketersediaan cahaya dan fotosintesis; peran zona penyangga. Sebaliknya, lokasi zona penyangga yang terdegradasi (Kirrigna dan Seraba) menunjukkan biomassa fitoplankton yang berkurang, kemungkinan karena peningkatan TDS dan kedalaman Secchi yang lebih rendah, yang menunjukkan masukan partikulat dari limbah tangkapan yang tidak disaring oleh zona penyangga. Daerah pelagis, meskipun tidak jauh berbeda dari lokasi yang terdegradasi, memiliki Chl- a yang sedikit lebih tinggi ; hal ini mungkin mencerminkan kondisi antara daerah tersebut.
| Situs | Parameter | Desember | Januari | Februari | Berbaris | April | Mungkin | Berarti | Kelompok Turki | Situs dan perbandingan dengan nilai p | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| melawan Debresina | Pelagis vs. Pelagis | melawan Kerrigan | melawan Seraba | ||||||||||
| Debresina | Chl -a | Tanggal 9.10 | 7.96 | 5.82 | 3.94 | 3.79 | 1.22 | Jam 5.30 | A | — | 0,0003 | 0,0001 | 0,0001 |
| Pelagis | Chl -a | 5.36 | 3.68 | 2.57 | 1.71 | 1.30 | 1.22 | 2.64 | B | 0,0003 | — | 0,984 | 0,915 |
| Kirrigna | Chl -a | 5.27 | 2.41 | 2.18 | 1.77 | 1.51 | 1.74 | 2.48 | B | 0,0001 | 0,984 | — | 0,992 |
| Seraba | Chl -a | 2.93 | 4.55 | 2.53 | 1.35 | 1.42 | 1.24 | 2.34 | B | 0,0001 | 0,915 | 0,992 | — |
Catatan : Ini juga mencakup perbandingan statistik antara lokasi dengan nilai p yang sesuai. Kelompok yang memiliki huruf yang sama (b) tidak berbeda secara signifikan satu sama lain, dan kelompok dengan huruf yang berbeda (‘a’ vs. ‘b’) berbeda secara signifikan.
Dalam penelitian ini, konsentrasi Chl -a (µg/L) berkisar antara 1,22 hingga 9,1, dengan rata-rata 3,2 (Tabel 4 ). Nilai serupa dilaporkan di Teluk selatan Danau Tana (Melaku 2017 ). Akan tetapi, konsentrasi ini lebih rendah daripada yang diamati di danau air tawar Ethiopia lainnya (Enawgaw et al. 2018 ).
Kisaran Chl -a (1,22–9,1 µg/L) dalam penelitian ini (Tabel 4 ) sejalan dengan Melaku ( 2017 ), yang melaporkan nilai yang hampir sama (1,5–10,2 µg/L) di teluk selatan Danau Tana. Chl -a yang lebih tinggi di Debresina (5,30 µg/L) dibandingkan dengan lokasi yang terdegradasi (Seraba dan Kirrigna) sejalan dengan Zelalem dan Prokin ( 2017). ), yang melaporkan bahwa zona penyangga yang dilindungi meningkatkan biomassa fitoplankton dengan mengurangi limbah dan limpasan sedimen, yang meningkatkan penetrasi cahaya dan meningkatkan fotosintesis.
Zona litoral meningkatkan kejernihan air, mendorong pertumbuhan fitoplankton, yang menjelaskan peningkatan Chl- a di Debresina dan juga sedikit lebih tinggi di area pelagis dibandingkan area penyangga terdegradasi lainnya (Seraba dan Kirrigna). Sebaliknya, lokasi terdegradasi dengan TDS tinggi dan kedalaman Secchi rendah sejalan dengan Enawgaw et al. ( 2018 ), yang melaporkan bahwa masuknya sedimen dan limbah dari area terdegradasi mengurangi penetrasi cahaya dan produksi Chl- a di Danau Chamo. Di sisi lain, yang bertentangan dengan Seraba dan Kirrigna, danau Denmark juga menunjukkan peningkatan transparansi air dan Chl -a di area dengan zona penyangga terlindungi karena filtrasi sedimen (Jeppesen et al. 2007 ).
Puncak Chl- a di Debresina (Tabel 4 ), yang menyerupai temuan Lemma et al. ( 2020 ), di mana mekarnya fitoplankton musim kemarau di Danau Tana disebabkan oleh stratifikasi yang stabil dan ketersediaan cahaya yang tinggi. Selain itu, tingkat Chl- a yang lebih rendah di lokasi yang terdegradasi (Seraba dan Kirrigna) konsisten dengan Tilahun et al. ( 2022 ), yang melaporkan berkurangnya biomassa di danau-danau Lembah Rift Ethiopia akibat dampak sedimentasi.
3.6 Korelasi Antara Parameter Fisikokimia yang Berbeda
Hubungan antara nutrisi, parameter fisikokimia, Chl -a dan skor HDA di bagian timur laut dan utara Danau Tana disajikan dalam Tabel 5 dan Gambar 5. Korelasi positif yang kuat diamati antara Chl -a dan DO ( r = 0,85**), HDA dan kekeruhan ( r = 0,86**), TN dan TP ( r = 0,71**), TDS dan konduktivitas ( r = 0,66**), dan pH dan DO ( r = 0,57**). HDA juga berkorelasi signifikan dengan TDS, konduktivitas, TP dan TN ( r = 0,62–0,67**) tetapi menunjukkan hubungan yang lebih lemah dengan suhu ( r = 0,37) dan kekeruhan ( r = −0,11). Tren ini menunjukkan bahwa aktivitas manusia di sekitar zona penyangga (seperti limpasan dari pertanian dan sumber kota) memengaruhi kualitas air. Dampak serupa telah didokumentasikan di tempat lain (Su et al. 2015 ).
| Parameter | Suhu | MELAKUKAN | Tingkat keasaman (pH) | Kedalaman Secchi | TDS | Daya konduksi | T.P. | Bahasa Inggris | Kekeruhan | Klorofil- a | % skor HDA |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Suhu | 1 | ||||||||||
| MELAKUKAN | -0,89** | 1 | |||||||||
| Tingkat keasaman (pH) | -0,57** | 0,57** | 1 | ||||||||
| SD | -0,20 | 0.16 | 0.27 | 1 | |||||||
| TDS | 0,58** | -0,58** | -0,40* | -0,59** | 1 | ||||||
| Daya konduksi | 0,58** | -0,59** | -0,53** | -0,43* | 0,66** | 1 | |||||
| T.P. | 0,51** | -0,48* | -0,65** | -0,59** | 0,41* | 0.38 | 1 | ||||
| Bahasa Inggris | 0.36 | -0,36 | -0,45* | -0,65** | 0.27 | 0.28 | 0,71** | 1 | |||
| Kekeruhan | 0,56** | -0,49* | -0,44* | -0,78** | 0,56** | 0,55** | 0,67** | 0,65** | 1 | ||
| Klorofil- a | -0,81** | 0,85** | 0,49* | -0,05 | -0,30 | -0,37 | -0,32 | -0,24 | -0,30 | 1 | |
| % skor HDA | 0.37 | -0,31 | -0,31 | -0,97** | 0,62** | 0,54** | 0,62** | 0,67** | 0,86** | -0,11 | 1 |
Singkatan: Chl- a , klorofil- a ; DO, oksigen terlarut; HAD, penilaian gangguan manusia; SD, deviasi standar; TDS, total padatan terlarut; TN, total nitrogen; TP, total fosfor.
*Korelasi signifikan pada level 0,05 (2-tailed).
**Korelasi signifikan pada level 0,01 (2-tailed).
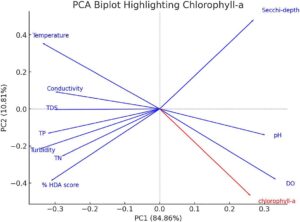
Chl -a berkorelasi negatif dengan suhu ( p < 0,01) tetapi berkorelasi positif dengan DO ( p < 0,01) dan pH ( p < 0,05), yang mencerminkan pengaruh suhu dan fotosintesis fitoplankton terhadap DO di dekat permukaan. Meskipun Chl -a menunjukkan korelasi negatif dengan TDS, konduktivitas, TP, TN dan kekeruhan, namun korelasi ini tidak signifikan secara statistik ( p > 0,05).
Pembacaan kedalaman Secchi berkorelasi negatif kuat dengan HDA ( r = −0,97**) dan kekeruhan ( r = −0,73**), yang menunjukkan kejernihan air berkurang dengan gangguan yang meningkat. DO menunjukkan korelasi negatif dengan suhu ( r = −0,89**) dan konduktivitas ( r = −0,59**), yang sejalan dengan temuan oleh Melaku ( 2017 ). Korelasi negatif yang signifikan antara pH dan konduktivitas ( r = −0,53) juga mendukung hasil Melaku ( 2017 ) tetapi kontras dengan yang dilaporkan oleh Wetzel ( 2001 ). Korelasi negatif antara suhu dan konduktivitas ( r = −0,59**), bersama dengan hubungan terbalik yang hampir sempurna antara HDA dan kedalaman Secchi ( r = −0,97**), lebih lanjut menyoroti dampak gangguan tanpa adanya zona penyangga. Korelasi kuat antara HDA dengan TN/TP ( r = 0,62 − 0,67**) mencerminkan masuknya nutrisi yang kemungkinan disebabkan oleh kurangnya zona penyangga, yang memungkinkan aktivitas subsisten manusia tanpa batas. Temuan ini kontras dengan asosiasi yang lebih lemah yang diamati oleh Godwin dkk. ( 2011 ).
4 Kesimpulan
Berdasarkan temuan-temuan ini, dapat disimpulkan bahwa degradasi zona penyangga berdampak signifikan terhadap kualitas air dan keanekaragaman serta kelimpahan plankton, termasuk biomassa dan produktivitas fitoplankton. Secara khusus, Seraba, tempat zona penyangga terdegradasi, menunjukkan keanekaragaman dan produktivitas fitoplankton yang lebih rendah, serta kelimpahan zooplankton yang berkurang. Tren serupa diamati di dua lokasi lainnya, Kirrigna dan wilayah pelagis. Sebaliknya, lokasi Debresina, dengan zona penyangga yang dilindungi, mendukung biomassa plankton yang lebih tinggi dan struktur plankton yang dinamis dibandingkan dengan wilayah pelagis. Hasil-hasil ini menggarisbawahi peran penting zona penyangga dalam mempertahankan kesehatan ekologi Danau Tana. Akibatnya, studi ini akan menawarkan wawasan berharga bagi para pembuat kebijakan dan pemangku kepentingan tentang pentingnya memulihkan dan mengembangkan zona penyangga demi kesehatan ekosistem Danau Tana.
5 Rekomendasi
Berdasarkan hasil tersebut, para pembuat kebijakan dan pemangku kepentingan harus menyadari pentingnya zona penyangga bagi kesehatan Danau Tana. Menetapkan zona ekologi dengan zona penyangga yang cukup lebar di sepanjang garis pantai danau berdasarkan karakteristik habitat dan layanan ekologi sangatlah penting. Studi ini dapat menjadi titik awal untuk penelitian di masa mendatang dan merupakan indikator informasi dasar yang baik. Namun, studi yang ekstensif dan mendalam diperlukan untuk mencapai kesimpulan yang jelas. Artinya, untuk sepenuhnya memahami dan mengonfirmasi pengaruh zona penyangga pada struktur dan dinamika komunitas plankton, sampel harus dikumpulkan dari berbagai daerah penyangga dan non-penyangga di Danau Tana. Aktivitas manusia, terutama di tepi Seraba dan Kirrigna, seperti penggembalaan bebas dan pertanian resesi, harus dibatasi pada jarak tertentu dari pantai danau untuk melestarikan ekoton. Selain itu, penting untuk meningkatkan kesadaran di antara penduduk pesisir dan memantau secara ketat dampak aktivitas manusia seperti perubahan garis pantai dan sanitasi.



