ABSTRAK
Bahasa Indonesia: Untuk memberikan panduan untuk budidaya aktual Micropterus salmoides , efek stres amonia-nitrogen (amonia-N) atau nitrogen nitrit (nitrit-N) pada aktivitas enzimatik, struktur jaringan dan mikrobiota usus diselidiki. Kelompok eksperimen terdiri dari Kelompok 1 (kelompok kontrol), Kelompok 2 (kelompok stres amonia-N), Kelompok 3 (kelompok pemulihan stres amonia-N), Kelompok 4 (kelompok stres nitrit-N) dan Kelompok 5 (kelompok pemulihan stres nitrit-N). Dalam kelompok-kelompok ini, LC50 amonia-N dan nitrit-N diukur selama 96 jam. Aktivitas superoksida dismutase (SOD), fosfatase asam (ACP) dan fosfatase alkali (AKP) dalam kelompok eksperimen menunjukkan tren peningkatan pertama dan kemudian penurunan. Aktivitas SOD Kelompok 1, 3 dan 5 secara signifikan lebih tinggi daripada Kelompok 2 pada 192 jam, sedangkan indeks malondialdehid (MDA) secara signifikan lebih rendah daripada Kelompok 2 dan 4. Aktivitas ACP dan AKP Kelompok 1, 3 dan 5 secara signifikan lebih tinggi daripada Kelompok 2 dan 4 pada 192 jam. Pengamatan histologi mengungkapkan sel-sel hati secara bertahap memburuk dengan meningkatnya durasi stres; Kelompok 3 dan 5 kurang parah daripada Kelompok 2 dan 4. Insang mirip dengan insang hati. Setelah stres amonia-N, Proteobacteria, Actinobacteria dan Candidatus Bacilloplasma menurun, sedangkan Fusobacteriota, Mycoplasma dan Cetobacterium meningkat. Setelah stres nitrit-N, Firmicutes, Actinobacteria dan Candidatus Bacilloplasma menurun, sedangkan Fusobacteriota, Aeromonas , Cetobacterium dan Mycoplasma meningkat. Selama masa pemulihan, Fusobacteriota, Cetobacterium, dan Mycoplasma terus meningkat. Keanekaragaman mikroba pada Kelompok 3 dan 5 lebih tinggi daripada Kelompok 2 dan 4. Sebagai kesimpulan, 50 mg/L amonia-N atau 45 mg/L nitrit-N menyebabkan perubahan aktivitas enzim, kerusakan pada hati dan insang, serta perubahan pada mikrobiota usus. Selain itu, kondisi fisiologis M. salmoides membaik setelah pemulihan tetapi tidak kembali ke keadaan sebelum stres.
1 Pendahuluan
Ikan bass hitam largemouth ( Micropterus salmoides ), asli Amerika Utara, adalah ikan buruan populer yang cocok untuk akuakultur komersial, mengingat kemampuan beradaptasinya terhadap berbagai kondisi, pertumbuhan cepat, daging yang lezat dan empuk, dan tidak adanya tulang intermuskular. Ikan ini telah menjadi salah satu spesies akuakultur air tawar utama di Tiongkok (Bai et al. 2008 ; Gu dan Nie 2016 ). Menurut Buku Tahunan Statistik Perikanan Tiongkok 2023, produksi M. salmoides di Tiongkok melampaui 800.000 ton pada tahun 2022 (Administrasi Perikanan dan Perikanan, Kementerian Pertanian, dan Urusan Pedesaan Republik Rakyat Tiongkok 2023 ). Mengingat nilai pasar spesies ini, mengoptimalkan teknik pembiakan dan meningkatkan hasil pembiakan dapat membantu memenuhi permintaan konsumen yang terus meningkat.
Studi telah menunjukkan bahwa kadar amonia-N dan nitrit-N yang berlebihan—polutan paling umum dalam akuakultur—dapat menyebabkan stres oksidatif pada hewan akuatik, yang memengaruhi pertumbuhan, perkembangan, fungsi fisiologis, dan kelangsungan hidup mereka (Cheng et al. 2019, 2020 ). Terutama dalam akuakultur intensif dengan kepadatan tinggi, jumlah pemberian pakan dalam jumlah besar dan konsumsi pakan berprotein tinggi dapat dengan mudah menyebabkan beban metabolik pada ikan dan meningkatkan ekskresi amonia mereka (Sun et al. 2007 ). Konsentrasi amonia-N yang tinggi dapat sangat membatasi metabolisme, pertumbuhan, dan kelangsungan hidup ikan (Frances et al. 2000 ). Nitrit-N juga merupakan polutan lingkungan utama di seluruh dunia. Nitrit-N yang berlebihan dapat berdampak signifikan pada ikan dan bahkan menyebabkan kematian (Deane dan Woo 2007 ). Studi telah menunjukkan bahwa efek amonia-N dan nitrit-N pada ikan terutama terwujud dalam tiga aspek: kerusakan pada jaringan dan organ, seperti hati dan insang; dampak negatif pada sistem enzim antioksidan; dan perubahan pada keragaman mikrobiota usus (Frances et al. 2000 ; Deane dan Woo 2007 ; Zhao et al. 2019 ). Misalnya, konsentrasi tinggi amonia-N di lingkungan telah terbukti menyebabkan lisis nuklir dan vakuolisasi sel organ di Ctenopharyngodon idella (Zhao et al. 2019 ), Carassius auratus (Wu et al. 2020 ) dan Pelteobagrus fulvidraco (Chen et al. 2016 ), yang menyebabkan kerusakan jaringan. Zhang et al. ( 2015 ) menyarankan bahwa amonia-N mengaktifkan mekanisme regulasi osmotik filamen insang sebagai bagian dari respons pertahanan, disertai dengan proliferasi sel-sel yang mensekresi klorida, yang mengakibatkan obstruksi pernapasan. Perusakan filamen insang menunjukkan penurunan aktivitas superoksida dismutase (SOD) untuk membersihkan spesies oksigen reaktif (ROS). Di bawah tekanan nitrogen amonia yang tinggi, total kapasitas antioksidan (T-AOC) dan aktivitas SOD di hati ikan nila ( Oreochromis niloticus × Oreochromis aureus ) menunjukkan tren penurunan pertama dan kemudian peningkatan dengan waktu paparan yang lama (Han et al. 2015 ). Di bawah tekanan amonia-N akut, aktivitas SOD di hati C. idella menunjukkan tren peningkatan pertama dan kemudian penurunan (Xing et al. 2016 ). Kroupova et al. ( 2008 ) menemukan bahwa epitel pernapasan lobulus insang di girus punctata menunjukkan edema dan proliferasi yang signifikan di bawah konsentrasi nitrit-N yang tinggi. Chen et al. ( 2023) menunjukkan bahwa stres nitrit-N tidak mengubah keragaman alfa mikrobiota usus ikan nila tetapi secara signifikan mengubah komposisi spesies.
Dalam sebuah penelitian mengenai efek stres amonia-N atau nitrit-N pada M. salmoides , Yang et al. ( 2019 ) menyelidiki efek amonia-N pada laju konsumsi oksigen dan titik mati lemas. Hasil penelitian menunjukkan bahwa, dalam rentang konsentrasi amonia-N 0–8,61 mg/L, seiring dengan peningkatan konsentrasi amonia-N, laju konsumsi oksigen larva M. salmoides menunjukkan tren peningkatan pertama dan kemudian penurunan, dan titik mati lemas meningkat seiring dengan peningkatan konsentrasi amonia-N. Yang ( 2020 ) menunjukkan bahwa stres amonia-N dapat menyebabkan kerusakan hati dan meningkatkan aktivitas enzim antioksidan pada M. salmoides . Dalam studi lain tentang M. salmoides , Zheng ( 2020 ) mempelajari efek dari berbagai konsentrasi amonia-N dalam percobaan toksisitas akut, dan hasil menunjukkan bahwa konsentrasi setengah mematikan (LC50) amonia-N pada juvenil pada 96 jam adalah 63,34 mg/L, dan konsentrasi aman adalah 6,33 mg/L. Selain itu, ketika konsentrasi amonia-N adalah 28,5 mg/L, fungsi sel di beberapa organ rusak setelah 96 jam pengobatan stres. Wei et al. ( 2024 ) menyelidiki efek stres amonia-N pada struktur jaringan dan mikrobiota usus M. salmoides juvenil . Penulis melaporkan bahwa setelah 48 jam stres, amonia-N 25 dan 50 mg/L menyebabkan jaringan hati rusak, termasuk pembubaran hepatosit, vakuolisasi, dan susunan yang tidak teratur. Selain itu, stres amonia-N 50 mg/L meningkatkan jumlah sel goblet, lebar vili, dan ketebalan lapisan otot di usus. Selain itu, paparan stres amonia-nitrogen selama 48 jam secara signifikan memengaruhi keragaman alfa dan beta mikrobiota usus. Yang ( 2024 ) mengemukakan bahwa stres akut akibat nitrit-N dapat menyebabkan keracunan pada M. salmoides dan menyebabkan perubahan histopatologis pada filamen insang dan hati.
Meskipun efek toksik amonia-N atau nitrit-N pada M. salmoides telah terdokumentasi dengan baik, fokusnya adalah pada efek terpisah; yaitu, perubahan status hipoksia, organ jaringan, aktivitas enzim atau keanekaragaman mikrobiota usus. Yang kurang adalah pendekatan yang lebih sistematis terhadap efek stres nitrogen dan penyelidikan pemulihan dari stres ini. Selye ( 1956 ) membagi stres menjadi tiga tahap: periode peringatan, adaptasi (atau kompensasi) dan kelelahan. Respons stres yang tepat dapat mempertahankan homeostasis internal dan meningkatkan kemampuan adaptif tubuh. Namun, ketika tingkat stres melebihi kisaran toleransi organisme, homeostasis internal terganggu, yang mengarah pada berbagai perubahan patologis yang akhirnya menyebabkan kematian. Oleh karena itu, penting untuk mengeksplorasi efek pemulihan ikan setelah periode stres kimia. Mengambil M. salmoides dalam akuakultur sebagai contoh, indikator kualitas air, seperti amonia-N dan nitrit-N, sering berfluktuasi selama periode pembiakan. Bila indikator-indikator ini melampaui standar, pengelola akuakultur mengambil langkah-langkah untuk mengurangi stres (seperti menambahkan air tawar atau obat-obatan yang tepat) untuk memperbaiki indikator kualitas air dan kondisi ikan. Namun, karena ikan telah mengalami stres kimia selama kurun waktu tertentu, perlu diselidiki sejauh mana stres ini memengaruhi fisiologi ikan, bahkan setelah kondisi air membaik dan ikan tampak pulih.
Dalam konteks peningkatan manajemen akuakultur, kami meneliti efek stres amonia-N dan nitrit-N serta pemulihannya pada M. salmoides dalam eksperimen toksisitas terkendali. Pertama-tama kami mengukur konsentrasi semi-mematikan dan konsentrasi aman amonia-N dan nitrit-N pada M. salmoides selama 96 jam. Kemudian kami menetapkan lima kelompok stres amonia-N dan nitrit-N serta pemulihannya untuk membandingkan aktivitas enzim yang terkait dengan antioksidan dan metabolisme, struktur jaringan, dan perubahan mikrobiota usus pada setiap kelompok. Tujuan dari penelitian ini adalah untuk memberikan panduan bagi budidaya M. salmoides yang sebenarnya .
2 Bahan dan Metode
2.1 Hewan Percobaan dan Kondisi Penelitian
Percobaan dilakukan di Institut Perikanan Air Tawar Zhejiang, Huzhou, Tiongkok. M. salmoides , setelah dibesarkan dari tahap penetasan hingga dewasa di kandang luar ruangan, ditangkap dan ditempatkan di tangki dalam ruangan, tempat mereka diaklimatisasi selama 7 hari; M. salmoides yang terdistribusi secara merata dan sehat secara fisik dipilih secara acak untuk percobaan. Sebanyak 540 ikan digunakan. Berat tubuh rata-rata ikan yang dipilih adalah 502,79 ± 42,99 g dan panjang tubuh 25,84 ± 0,92 cm. Wadah percobaan adalah tangki pembiakan plastik polipropilena yang berisi 100 L air. Suhu air dipertahankan pada 25°C ± 1°C dan pH 7,5–8,0. Tangki dilengkapi dengan inflasi berkelanjutan untuk mempertahankan konsentrasi oksigen terlarut sedikitnya 7 mg/L.
2.2 Metode
2.2.1 Uji Toksisitas Akut Awal Amonia-N dan Nitrit-N
Sebelum penambahan perlakuan, terdapat 12 ikan dewasa yang sehat di setiap tangki percobaan. Sebanyak 365 ekor digunakan. Pemberian pakan dihentikan 24 jam sebelum percobaan, dan percobaan pendahuluan dilakukan dengan stres amonia-N dan nitrit-N. Larutan induk amonia-N 10 g/L disiapkan dengan aerasi selama 48 jam dengan air ledeng dan amonium klorida (kadar analitis), dan larutan induk nitrit 10 g/L disiapkan dengan aerasi selama 48 jam dengan air ledeng dan natrium nitrit (kadar analitis). Tidak ada zat ion klorida yang ditambahkan ke dalam air. Uji toksisitas akut amonia-N dilakukan dengan menggunakan empat gradien konsentrasi massa dan satu kelompok kontrol yang ditetapkan pada interval logaritmik yang sama dengan konsentrasi massa total amonia nitrogen sebesar 0, 50, 100, 150, dan 200 mg/L. Uji toksisitas nitrit-N akut dilakukan dengan menggunakan empat gradien konsentrasi massa, dan satu kelompok kontrol ditetapkan pada interval logaritmik yang sama. Konsentrasi massa nitrit-N adalah 0, 45, 90, 180 dan 360 mg/L. Tiga ruang paralel disiapkan untuk setiap konsentrasi massa, masing-masing berisi 100 L larutan uji, dan 12 ekor ikan ditempatkan di setiap ruang. Selama percobaan, setengah dari larutan uji diganti setiap 24 jam untuk mempertahankan konsentrasi massa amonia-N dalam larutan uji. (Hasil uji pendahuluan menunjukkan bahwa konsentrasi massa amonia-N dan nitrit-N dapat dipertahankan pada 95% atau lebih dari konsentrasi massa yang ditetapkan pada 24 jam.) Jumlah ikan yang mati pada 24, 48 dan 96 jam dicatat, dan ikan yang mati segera dikeluarkan.
2.2.2 Uji Stres dan Pemulihan Amonia-N dan Nitrit-N
Berdasarkan hasil uji awal toksisitas akut, tidak terjadi kematian pada M. salmoides dalam air dengan konsentrasi massa 50 mg/L amonia-N dan 45 mg/L nitrit-N. Namun, ikan mulai mati dengan meningkatnya konsentrasi amonia-N dan nitrit-N. Oleh karena itu, konsentrasi massa amonia-N 50 mg/L dan konsentrasi massa nitrit-N 45 mg/L dipilih sebagai konsentrasi stres. Lima gradien konsentrasi eksperimen disiapkan, yaitu, Kelompok 1 (kelompok kontrol, konsentrasi amonia-N 0 mg/L), Kelompok 2 (kelompok stres amonia-N, konsentrasi amonia-N total 50 mg/L), Kelompok 3 (kelompok pemulihan stres amonia-N; air perawatan diganti dengan air bersih setelah 96 jam stres amonia-N pada 50 mg/L; ikan pulih selama 96 jam tambahan), Kelompok 4 (kelompok stres nitrit-N, konsentrasi nitrit-N 45 mg/L) dan Kelompok 5 (kelompok pemulihan stres nitrit-N; air perawatan diganti dengan air bersih setelah 96 jam stres nitrit-N pada 45 mg/L; ikan pulih selama 96 jam tambahan), dengan tiga replikasi paralel ditetapkan untuk setiap konsentrasi. Sebanyak 180 ikan digunakan. Setiap kotak paralel berisi 100 L larutan uji, dan 12 ikan ditempatkan di kotak uji untuk eksperimen stres amonia-N, nitrit-N, dan pemulihan. Enam ekor ikan dikumpulkan dari setiap kelompok setelah 96 jam, dan enam ekor ikan lainnya dikumpulkan setelah 192 jam. Ikan-ikan tersebut dibius menggunakan MS-222 100 mg/L dan dibedah di atas nampan es untuk segera membuang jaringan hati, usus, dan insang. Metode eutanasia ikan mengikuti standar etika untuk perawatan hewan percobaan. Sampel hati dan usus disimpan pada suhu -80°C untuk mengukur aktivitas enzim dan mikrobiota, dan sampel hati dan insang ditempatkan dalam larutan Bonn untuk pemotongan jaringan dan pengamatan.
2.2.3 Persiapan Sampel Jaringan
Pada jam ke-96 dan ke-192, enam ekor ikan dipilih secara acak dari setiap tangki perlakuan dan dibunuh. Hati dan insang segera dikeluarkan, dan sebagian jaringan hati dan insang diawetkan dalam nitrogen cair untuk persiapan selanjutnya untuk analisis enzim. Sisa jaringan hati dan insang disiapkan untuk slide. Hati dan insang (lengkungan insang ketiga diambil) difiksasi dengan larutan Bonn selama 24 jam, didehidrasi langkah demi langkah dengan etanol, dibuat transparan dengan xilena, ditanamkan dalam parafin, diiris dengan mikrotom 5-µm, diwarnai dengan hematoksilin-eosin dan disegel dengan gom netral. Jaringan usus dipotong terbuka dengan gunting steril, dan isinya dikikis perlahan dengan pisau bedah dan ditempatkan dalam sampel dalam nitrogen cair dan dipindahkan ke freezer −80°C untuk digunakan nanti dalam analisis mikrobioma. Sampel yang disiapkan diperiksa di bawah mikroskop biologis (Olympus, Tokyo, Jepang) dan difoto.
2.2.4 Mengukur Aktivitas Enzim Antioksidan dan Terkait Imun
Hati yang telah dipotong yang telah disimpan dalam nitrogen cair diikuti dengan penyimpanan pada suhu sangat rendah (−80°C) digunakan untuk menyiapkan sampel homogenat untuk analisis enzim. Homogenat jaringan disiapkan dengan menambahkan 9 mL garam fisiologis per gram jaringan sampel, dan jaringan digiling, dipindahkan ke tabung sentrifus 2 mL dan disentrifus pada 1006,2( × g ) pada suhu 4°C selama 10 menit (nama sentrifus adalah Multifuge X4R Pro, buatan Jerman). Supernatan yang dihasilkan dibagi menjadi beberapa bagian kecil dan disimpan sementara dalam lemari es (lemari es Haier, spesifikasi dan modelnya adalah BCD-190WDCO, buatan Tiongkok) pada suhu 4°C. Aktivitas dan kandungan SOD (nomor produk A001-3-2), malondialdehid (MDA) (nomor produk A003-1-2), fosfatase asam (ACP) (nomor produk A060-2-1) dan fosfatase alkali (AKP) (nomor produk A059-2-1) diukur menggunakan kit reagen dari Institut Penelitian Bioteknologi Nanjing Jiancheng. Operasi yang relevan dilakukan sesuai dengan petunjuk produsen kit reagen, dan semua kit reagen yang digunakan berasal dari batch yang sama.
2.2.5 Analisis Perbedaan Komposisi dan Keanekaragaman Mikrobiota Usus
Jaringan usus yang telah disiapkan (lihat Bagian 2.2.3) digunakan untuk menyelidiki mikrobiota ikan dari masing-masing kelompok perlakuan. Total DNA diekstraksi dari masing-masing kelompok, DNA bakteri usus digunakan sebagai cetakan, sekuens bakteri diperkuat menggunakan primer universal, dan perubahan mikrobiota usus masing-masing kelompok dibandingkan. Analisis sampel meliputi analisis sekuensing Illumina PE250 dan bioinformatika. DNA genomik yang diekstraksi dari sampel dikenakan amplifikasi reaksi berantai (PCR), kuantifikasi fluoresensi, konstruksi pustaka Illumina PE250, dan sekuensing Illumina PE250. Pembacaan PE yang diperoleh dari sekuensing Illumina PE250 pertama-tama dirangkai berdasarkan hubungan tumpang tindih, dan kualitas sekuens dikontrol dan difilter. Setelah membedakan antara sampel, pengelompokan unit taksonomi operasional (OTU) dan analisis taksonomi spesies dilakukan. Berdasarkan hasil analisis pengelompokan OTU, berbagai analisis indeks keanekaragaman dilakukan pada OTU, serta deteksi kedalaman sekuensing. Berdasarkan informasi taksonomi, analisis statistik struktur komunitas dilakukan pada berbagai tingkat taksonomi.
2.3 Analisis Statistik
Metode unit probabilitas digunakan untuk menghitung konsentrasi massa semi-letal 96 jam (96 jam LC50) amonia-N dan nitrit-N dalam ikan. Konsentrasi massa aman (SC) dihitung sebagai 0,1 × 96 jam LC50. Semua data disajikan sebagai mean ± SD dan digunakan untuk menilai distribusi normalitas dan keseragaman. Setelah transformasi arcsine, data yang diperoleh untuk setiap percobaan dianalisis dengan analisis varians (ANOVA) menggunakan perangkat lunak SPSS (versi 17.0; IBM, Armonk, NY, AS) untuk menentukan perbedaan antar kelompok. Uji post hoc perbandingan berganda Tukey dilakukan ketika signifikansi terdeteksi. Signifikansi statistik ditetapkan pada p < 0,05.
3 Hasil
3.1 Toksisitas Akut Amonia-N dan Nitrit-N pada M. salmoides
Hasil penelitian menunjukkan bahwa tidak terjadi kematian pada M. salmoides dalam air dengan konsentrasi massa 50 mg/L amonia-N dan 45 mg/L nitrit-N. Namun, ikan mulai mati pada konsentrasi massa 100 mg/L amonia-N dan 90 mg/L nitrit-N, dan tingkat kematian meningkat dengan meningkatnya konsentrasi amonia-N dan nitrit-N. Konsentrasi semi-letal (LC50) amonia-N dalam M. salmoides pada 96 jam ditetapkan sebesar 120,56 mg/L melalui interpolasi linier, dan konsentrasi aman adalah 12,06 mg/L. LC50 nitrit-N untuk M. salmoides pada 96 jam adalah 195,47 mg/L, dan konsentrasi aman adalah 19,55 mg/L (Tabel 1 dan 2 ).
| Konsentrasi amonia-N (mg/L) | Angka kematian 24 jam (%) | Angka kematian 48 jam (%) | Angka kematian 96 jam (%) |
|---|---|---|---|
| angka 0 | 0 ± 0,00 per menit | 0 ± 0,00 per menit | 0 ± 0,00 per menit |
| 50 | 0 ± 0,00 per menit | 0 ± 0,00 per menit | 0 ± 0,00 per menit |
| 100 | 5,57 ± 9,64 miliar | 22,23 ± 9,58 hari | 33,33 ± 16,65 hari |
| 150 | 11,13 ± 9,64 detik | 33,33 ± 16,65 hari | 66,63 ± 16,65 derajat Fahrenheit |
| 200 | 38,87 ± 9,64 tahun | 61,07 ± 9,58 derajat Fahrenheit | 94,43 ± 9,64 gram |
| Konsentrasi Nitrit-N (mg/L) | Angka kematian 24 jam (%) | Angka kematian 48 jam (%) | Angka kematian 96 jam (%) |
|---|---|---|---|
| angka 0 | 0 ± 0,00 per menit | 0 ± 0,00 per menit | 0 ± 0,00 per menit |
| 45 | 0 ± 0,00 per menit | 0 ± 0,00 per menit | 0 ± 0,00 per menit |
| 90 | 0 ± 0,00 per menit | 5,57 ± 9,64 miliar | 22,23 ± 9,58 detik |
| 180 | 16,67 ± 16,65 detik | 33,33 ± 16,65 hari | 55,57 ± 19,28 tahun |
| 360 | 55,53 ± 25,46 tahun | 61,10 ± 19,23 hari | 88,87 ± 9,64 derajat Fahrenheit |
Selain itu, kami mengamati bahwa selama tahap awal stres amonia-N dan nitrit-N, ikan mulai menunjukkan tanda-tanda stres: pernapasan cepat, peningkatan frekuensi pembukaan dan penutupan insang, dan perilaku hiperaktif. Saat tingkat stres meningkat, keseimbangan terpengaruh; ikan sering berguling atau bertabrakan dan melesat sebelum beristirahat di dasar. Setelah itu, bukaan insang melebar pada kelompok konsentrasi tinggi, pernapasan tersumbat, kejang dan ketidaksadaran diamati dan kematian pun terjadi.
3.2 Efek Stres Amonia-N dan Nitrit-N pada Indikator Antioksidan dan Imun Hati serta Efek Pemulihan
Hasil indikator antioksidan menunjukkan bahwa dengan perpanjangan waktu stres amonia-N dan nitrit-N, SOD pertama meningkat dan kemudian menurun pada semua kelompok (kecuali Kelompok 1), dan MDA pertama meningkat dan kemudian menurun pada Kelompok 3 dan 5, tetapi tidak ada penurunan yang signifikan pada Kelompok 2 dan 4. Pada 96 jam perlakuan, aktivitas SOD dan kadar MDA pada Kelompok 1 secara signifikan lebih rendah daripada yang ada pada empat kelompok lainnya ( p < 0,05). Setelah 192 jam, aktivitas SOD pada Kelompok 1, 3 dan 5 secara signifikan lebih tinggi daripada yang ada pada Kelompok 2 ( p < 0,05); namun, aktivitas MDA pada Kelompok 1, 3 dan 5 secara signifikan lebih rendah daripada yang ada pada Kelompok 2 dan 4 ( p < 0,05). Ditemukan juga bahwa aktivitas SOD dari dua kelompok (Kelompok 3 dan 5) yang dibiarkan pulih setelah stres lebih tinggi daripada dua kelompok (Kelompok 2 dan 4) yang tidak pulih; yaitu, mereka berada dalam tekanan terus-menerus. Sebaliknya, aktivitas MDA lebih rendah daripada dua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah tekanan terus-menerus. Setelah pemulihan, indikator antioksidan ini dikembalikan ke tingkat kontrol (Gambar 1 dan 2 ).
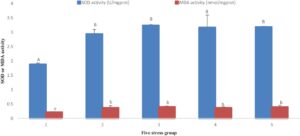
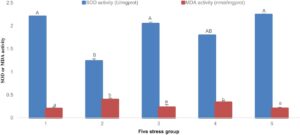
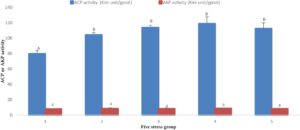
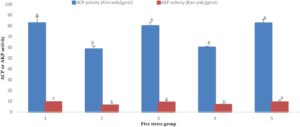
Indikator yang berhubungan dengan imun menunjukkan bahwa, dengan perpanjangan stres amonia-N dan nitrit-N, aktivitas ACP dan AKP meningkat dan kemudian menurun. Pada 96 jam, ACP meningkat secara signifikan dengan meningkatnya durasi stres, sedangkan AKP tidak meningkat secara signifikan. Aktivitas ACP pada Kelompok 1 secara signifikan lebih rendah daripada aktivitas pada empat kelompok lainnya ( p < 0,05), sedangkan tidak ada perbedaan yang signifikan dalam aktivitas AKP di antara kelompok-kelompok tersebut ( p > 0,05). Setelah 192 jam, aktivitas ACP dan AKP mulai menurun dengan peningkatan waktu stres. Tingkat aktivitas ACP dan AKP pada Kelompok 1, 3 dan 5 secara signifikan lebih tinggi daripada yang ada pada Kelompok 2 dan 4 ( p < 0,05). Aktivitas ACP dan AKP dari dua kelompok (Kelompok 3 dan 5) yang pulih setelah stres secara signifikan lebih tinggi daripada dua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah stres berkelanjutan. Setelah pemulihan, aktivitas enzim terkait kekebalan dikembalikan ke tingkat kelompok kontrol (Gambar 3 dan 4 ).
3.3 Pengaruh Stres Amonia-N dan Nitrit-N terhadap Struktur Jaringan Hati dan Insang, serta Efek Pemulihan
3.3.1 Pengamatan Histologis Jaringan Hati
Histologi menunjukkan bahwa sel-sel hati pada Kelompok 1 tersusun rapi dan memiliki kontur sel yang jelas. Pada Kelompok 2, sel-sel hati tampak bengkak, dengan area vakuolisasi yang luas dan lebih banyak pergeseran inti sel. Kelompok 3 juga menunjukkan pembengkakan sel-sel hati yang signifikan, vakuolisasi yang parah dan banyak pergeseran inti sel, tetapi situasi keseluruhan sedikit lebih baik daripada yang ada pada Kelompok 2. Kelompok 4 memiliki sinusoid yang melebar, sel-sel hati yang bengkak, vakuolisasi yang parah dan pergeseran inti yang parah. Inti dari Kelompok 5 menunjukkan perpindahan parsial dan sejumlah kecil vakuolisasi, dan situasi keseluruhan sedikit lebih baik daripada yang ada pada Kelompok 4. Artinya, dengan peningkatan waktu stres, pembengkakan, vakuolisasi dan pergeseran inti sel-sel hati secara bertahap memburuk, tetapi kondisi hati dari dua kelompok (Kelompok 3 dan 5) yang pulih setelah stres lebih baik daripada yang ada pada dua kelompok (Kelompok 2 dan 4) yang tidak pulih (Gambar 5 ).
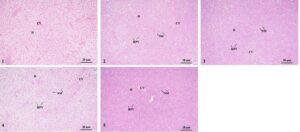
3.3.2 Pengamatan Histologi Insang
Hasil penelitian menunjukkan bahwa Kelompok 1 memiliki filamen insang utuh, filamen insang tersusun rapi, dan tidak ditemukan pembengkakan, kongesti, fusi, pengeritingan atau pengelupasan yang jelas. Kelompok 2 menunjukkan pembengkakan epitel yang signifikan dan kongesti pada filamen insang, serta fusi filamen insang, pengeritingan berlapis dan proliferasi. Kelompok 3 juga menunjukkan pembengkakan epitel dan kongesti serta sejumlah kecil fusi filamen insang dan pengeritingan berlapis, tetapi kondisi keseluruhan sedikit lebih baik daripada Kelompok 2. Kelompok 4 menunjukkan pembengkakan epitel yang parah, kongesti, fusi filamen insang, pengeritingan berlapis filamen insang, pengelupasan irisan tipis dan hiperplasia. Kondisi keseluruhan Kelompok 5 lebih baik daripada Kelompok 4, tanpa pengelupasan irisan tipis atau proliferasi yang diamati. Pembengkakan, kongesti dan fusi filamen insang epitel membaik. Seiring dengan meningkatnya durasi stres, pembengkakan dan kongesti epitel insang, fusi insang, pengeritingan berlapis, dan proliferasi filamen insang secara bertahap menjadi lebih parah. Namun, kondisi insang dari kedua kelompok (Kelompok 3 dan 5) yang pulih setelah stres lebih baik daripada kedua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah stres (Gambar 6 ).
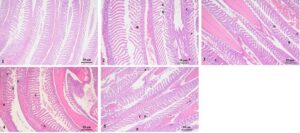
3.4 Efek Stres dan Pemulihan Amonia-N dan Nitrit-N pada Mikrobiota Usus
3.4.1 Analisis Komposisi Komunitas Mikroba
Hasil penelitian menunjukkan bahwa mikrobiota usus M. salmoides lebih berlimpah pada tingkat filum dan mencakup Fusobacteriota, Proteobacteria, Firmicutes dan Actinobacteria. Di antara mereka, Firmicutes, Proteobacteria dan Actinobacterota lebih berlimpah di Kelompok 1. Firmicutes dan Fusobacteriota adalah filum paling berlimpah di Kelompok 2. Fusobacteriota lebih berlimpah di Kelompok 3. Proteobacteria dan Fusobacteriota lebih berlimpah di tingkat filum di Kelompok 4. Fusobacteriota dan Firmicutes adalah filum paling berlimpah di Kelompok 5. Genera dengan kelimpahan tertinggi di tingkat genus adalah Cetobacterium , Aeromonas dan Mycoplasma , dan Candidatus-Bacilloplasma . Di antara ini, Candidatus-Bacilloplasma lebih berlimpah di Kelompok 1 di tingkat genus. Genera dengan kelimpahan tertinggi di Kelompok 2 adalah Mycoplasma dan Cetobacterium . Kelompok 3 menunjukkan kelimpahan Cetobacterium yang lebih tinggi . Genus yang paling melimpah pada Kelompok 4 adalah Aeromonas , Cetobacterium dan Mycoplasma . Genus yang paling melimpah pada Kelompok 5 adalah Cetobacterium dan Mycoplasma (Gambar 7 ).
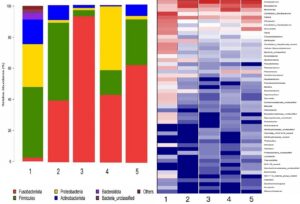
Dengan kata lain, pada tingkat filum, setelah stres amonia-N, kelimpahan filum Proteobacteria dan Actinobacteria menurun, sedangkan kelimpahan filum Fusobacteriota meningkat. Namun, selama periode pemulihan, kelimpahan Fusobacteriota terus meningkat. Setelah stres nitrit-N, kelimpahan Firmicutes dan Actinobacteria menurun, sedangkan kelimpahan Fusobacteriota meningkat. Namun, selama periode pemulihan, kelimpahan Fusobacteriota terus meningkat. Pada tingkat genus, kelimpahan Candidatus-Bacilloplasma menurun setelah stres amonia-N, sedangkan kelimpahan Mycoplasma dan Cetobacterium meningkat. Selama periode pemulihan, kelimpahan Cetobacterium meningkat. Setelah stres nitrit-N, kelimpahan Candidatus-Bacilloplasma menurun, sedangkan Aeromonas , Cetobacterium dan Mycoplasma meningkat. Selama periode pemulihan, kelimpahan Cetobacterium dan Mycoplasma terus meningkat.
3.4.2 Analisis Indeks Keanekaragaman Mikroba
Kelompok 1–5 berisi rata-rata 85.357, 89.829, 90.352, 86.179, dan 86.645 sekuens yang valid, masing-masing. Indeks ACE, Chao1, dan Shannon pada Kelompok 1 secara signifikan lebih tinggi daripada nilai yang sesuai pada empat kelompok lainnya ( p < 0,05), sedangkan indeks Simpson secara signifikan lebih rendah daripada indeks pada empat kelompok lainnya ( p < 0,05). Indeks ACE dan Chao1 pada Kelompok 3 dan 5 secara signifikan lebih tinggi daripada nilai yang sesuai pada Kelompok 2 dan 4 ( p < 0,05), sedangkan tidak ada perbedaan yang signifikan pada indeks Shannon dan Simpson di antara Kelompok 2–5 ( p > 0,05). Dengan kata lain, keragaman mikroba pada keempat kelompok yang mengalami stres amonia-N dan nitrit-N serta pemulihannya lebih rendah dibandingkan dengan kelompok kontrol, dan keragaman mikroba pada kedua kelompok (Kelompok 3 dan 5) yang pulih setelah stres lebih tinggi dibandingkan dengan kedua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah stres berkelanjutan (Tabel 3 ).
| 1 | 2 | 3 | 4 | 5 | |
|---|---|---|---|---|---|
| Kedalaman pengambilan sampel | |||||
| Urutan rata-rata | 85.357 orang | 89.829 | 90.352 orang | 86.179 tahun | 86.645 |
| Estimasi kekayaan | |||||
| KARTU AS | 859,00 ± 8,49 per bulan | 202,50 ± 54,45 derajat | 380,00 ± 115,97 miliar | 232,00 ± 59,40c | 475,00 ± 97,58 miliar |
| kekacauan1 | 854,00 ± 5,66 per tahun | 189,50 ± 51,62 detik | 338,50 ± 101,12 miliar | 210,50 ± 51,62 detik | 438,00 ± 90,51 miliar |
| Penaksir keanekaragaman | |||||
| Bahasa Indonesia: Shannon | 3,005 ± 0,021 satu | 1.190 ± 0,014 miliar | 0,750 ± 0,014 b | 1,265 ± 0,0074 miliar | 1.520 ± 0,014 miliar |
| Bahasa Inggris Simpson | 0,171 ± 0,003 miliar | 0,397 ± 0,003 satu | 0,364 ± 0,005 satu | 0,349 ± 0,002 satu | 0,344 ± 0,004 satu |
4 Diskusi
4.1 Stres Akut Amonia-N dan Nitrit-N pada M. salmoides
Dalam penelitian ini, M. salmoides memiliki toleransi yang lebih tinggi terhadap nitrit-N. LC50 nitrit-N pada 96 jam adalah 195,47 mg/L, dan CS adalah 19,55 mg/L. Konsentrasi semi-letal (LC50) merupakan parameter penting untuk mengukur toksisitas zat pada organisme hidup (Yang 2024 ). Spesies ikan yang berbeda menunjukkan tingkat toleransi yang berbeda-beda terhadap stres: Misalnya, paparan akut terhadap nitrit-N mengakibatkan LC50 96 jam sebesar 9,17 mg/L dan konsentrasi aman (CS) sebesar 0,92 mg/L pada Megalobrama amblycephala (Teng et al. 2018 ); namun, LC50 96 jam O. niloticus terhadap nitrit-N hanya 0,84 mg/L (Zhao et al. 1991 ). Ini menunjukkan bahwa M. salmoides memiliki toleransi yang lebih tinggi terhadap nitrit-N daripada spesies lain, seperti M. amblycephala dan O. niloticus . Studi William dan Donald ( 2011 ) menunjukkan bahwa spesies yang paling tidak sensitif yang diuji sejauh ini adalah largemouth bass, Micropterus salmoides , yang konsisten dengan hasil percobaan ini. Selain itu, Zheng et al. ( 2020 ) melakukan eksperimen toksisitas akut amonia-N pada juvenil M. salmoides (19,70 ± 1,98) g, dan hasilnya menunjukkan bahwa LC50 96 jam adalah 63,34 mg/L, dan CS adalah 6,33 mg/L. Penelitian Yang ( 2024 ) menunjukkan bahwa paparan akut nitrit-N menghasilkan LC50 96 jam sebesar 396,46 mg/L dan CS sebesar 39,65 mg/L untuk juvenil M. salmoides (39,00 ± 0,87) g. Hasil kami berbeda dari temuan ini, mungkin karena ukuran tubuh yang bervariasi (502,79 ± 42,99) g dari M. salmoides dewasa yang dipilih untuk percobaan ini.
Juga diamati bahwa selama periode pra-uji toksisitas akut, selama tahap awal stres amonia-N dan nitrit-N, M. salmoides menunjukkan gejala stres berat (terperinci dalam Bagian 3.1 ). Pengamatan ini konsisten dengan temuan Liu et al. ( 2018 ) dan Handy dan Poxton ( 1993 ).
4.2 Indikator Aktivitas Enzim Antioksidan dan Terkait Imun dari Amonia-N dan Nitrit-N pada M. salmoides
Untuk mengetahui apakah stres amonia-N dan nitrit-N akan berdampak pada sistem antioksidan dan imun M. salmoides , indikator aktivitas enzim yang terkait dengan antioksidan dan imun ditentukan. Hasil penelitian menunjukkan bahwa aktivitas SOD, ACP, dan AKP pada kedua kelompok yang pulih setelah stres secara signifikan lebih tinggi daripada aktivitas pada kedua kelompok yang tidak pulih setelah stres berkelanjutan, sedangkan aktivitas MDA lebih rendah daripada aktivitas pada kedua kelompok yang tidak pulih setelah stres berkelanjutan.
Hati adalah organ metabolisme dan detoksifikasi penting pada ikan. Racun dalam tubuh menghasilkan sejumlah besar ROS selama oksidasi, reduksi atau hidrolisis sel hati (Hargreaves dan Kucuk 2001 ). Stres dapat meningkatkan konsentrasi ROS pada ikan, yang selanjutnya menginduksi stres oksidatif dan menyebabkan kerusakan oksidatif. ROS terutama dibersihkan melalui aktivitas enzim seperti SOD, yang dapat digunakan untuk mengevaluasi kapasitas antioksidan jaringan hewan (Wang et al. 2004 ; Xian et al. 2011 ). MDA adalah produk akhir dari peroksidasi ROS dalam tubuh; oleh karena itu, kandungannya secara tidak langsung dapat mencerminkan tingkat kerusakan sel hewan akuatik yang disebabkan oleh ROS (Papadimitriou dan Loumbourdis 2002 ). Yang ( 2020 ) menemukan bahwa pada M. salmoides juvenil , ROS yang berlebihan dalam sel hati tidak dibersihkan tepat waktu; Akibatnya, sel mengalami kerusakan oksidatif, yang menyebabkan perubahan pada struktur protein enzim dan penurunan kapasitas antioksidan.
Dalam penelitian ini, hasil indikator enzim antioksidan jaringan hati menunjukkan bahwa dengan perpanjangan waktu stres amonia-N dan nitrit-N, SOD pertama kali meningkat dan kemudian menurun, sedangkan MDA pertama kali meningkat dan kemudian menurun pada Kelompok 3 dan 5, tetapi tidak ada penurunan signifikan pada Kelompok 2 dan 4. Setelah 21 hari paparan terhadap berbagai konsentrasi nitrit-N, O. niloticus menunjukkan korelasi negatif dengan penurunan kadar SOD (Xiao et al. 2020 ). Xue et al. ( 2019 ) menemukan bahwa di bawah stres amonia-nitrogen, kandungan MDA dalam jaringan hati ikan mas crucian alogenik meningkat. Namun, aktivitas SOD menunjukkan tren aktivasi, diikuti oleh inhibisi. Konsentrasi tinggi dan stres amonia nitrogen yang berkepanjangan memiliki dampak signifikan pada aktivitas enzim antioksidan di hati ikan juvenil, yang menyebabkan penurunan kapasitas antioksidan. Ali et al. ( 2019 ) dan Mona et al. ( 2010 ) juga menemukan bahwa aktivitas enzim antioksidan seperti SOD menunjukkan tren “induksi inhibisi” selama stres. Hasil penelitian ini serupa dengan penelitian saat ini. Diperkirakan bahwa alasan untuk hasil di atas mungkin karena lingkungan amonia-N dan nitrit-N yang tinggi mendorong tubuh untuk terus mengaktifkan sistem antioksidan untuk menghilangkan ROS dan menjaga keseimbangan, sehingga menghasilkan peningkatan aktivitas enzim antioksidan dan enzim terkait imun. Ini adalah respons fisiologis terhadap stres lingkungan, dan efek induksi ini diyakini disebabkan oleh induksi kompensasi enzim antioksidan dan peningkatan aktivitas enzim terkait imun melalui peningkatan ROS (Ren et al. 2014 ). Dengan stres yang berkepanjangan, radikal bebas berlebih yang dihasilkan melebihi kapasitas pembersihan maksimum sistem antioksidan, yang menyebabkan disfungsi regulasi fisiologis pada M. salmoides . Selain itu, dengan perpanjangan waktu stres, kerusakan fungsi seluler yang disebabkan oleh gangguan ini menjadi semakin parah di semua kelompok konsentrasi, yang mengakibatkan kadar enzim antioksidan dan aktivitas enzim terkait imun yang lebih rendah dari normal pada tahap selanjutnya. Ketika aktivitas enzim turun di bawah kadar normal, beberapa fungsi jaringan dan seluler rusak. Kemungkinan lain adalah bahwa ada tingkat perubahan tertentu dalam metabolisme seluler daripada akibat stres oksidatif (Wang et al. 2013 ; Bai et al. 2009 ; Martínez-Álvarez et al. 2002)). Di bawah tekanan amonia-N dan nitrit-N yang tinggi dalam jangka panjang, sistem antioksidan ikan tidak dapat membersihkan radikal bebas secara tepat waktu, dan keseimbangan antara oksidasi dan antioksidan dalam tubuh terganggu, yang mengakibatkan akumulasi radikal bebas dalam tubuh ikan dan menyebabkan kerusakan oksidatif pada sel. Hal ini semakin merusak sistem antioksidan ikan, yang terwujud sebagai penurunan aktivitas enzim secara terus-menerus (Wang et al. 2013 ; Bai et al. 2009 ). Studi-studi ini menunjukkan bahwa di bawah tekanan amonia-N dan nitrit-N yang berlebihan atau berkepanjangan, sistem antioksidan ikan rusak, yang menyebabkan penurunan sistem kekebalan tubuh, resistensi, dan kerentanan mereka terhadap penyakit.
Dalam penelitian ini, kami menemukan bahwa aktivitas SOD dari dua kelompok (Kelompok 3 dan 5) yang pulih setelah stres lebih tinggi daripada dua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah stres berkelanjutan, meskipun aktivitas MDA lebih rendah daripada dua kelompok (Kelompok 2 dan 4) yang tidak pulih setelah stres berkelanjutan. Penelitian telah menunjukkan bahwa setelah paparan berbagai konsentrasi air nitrit-N selama 14 hari dan kemudian pemulihan selama 14 hari lagi, kandungan MDA dalam jaringan hati M. amblycephala meningkat secara signifikan, sedangkan aktivitas SOD di hati berkorelasi positif dengan dosis (Wu 2016 ). Wu et al. ( 2024 ) mempelajari efek stres amonia-N jangka pendek dan pemulihan pada Procambarus clarkii . Hasil penelitian menunjukkan bahwa setelah 48 jam stres, kecuali untuk kelompok konsentrasi amonia-N rendah, aktivitas SOD di hati kelompok eksperimen lainnya secara signifikan lebih tinggi daripada yang ada di kelompok kontrol. Setelah 48 jam pemulihan, kecuali untuk kelompok dengan konsentrasi amonia-N yang lebih tinggi, kandungan MDA di hati meningkat secara signifikan dibandingkan dengan kelompok kontrol, sedangkan aktivitas enzim pada kelompok eksperimen lainnya kembali ke tingkat kelompok kontrol. Dong et al. ( 2018 ) mempelajari efek stres amonia-N dan pemulihan terhadap kekebalan nonspesifik pada udang juvenil, Macrobrachium rosenbergii . Hasil penelitian menunjukkan bahwa setelah 48 jam pemulihan dari stres amonia-N, aktivitas SOD di semua kelompok menurun secara signifikan dibandingkan dengan kelompok stres, tetapi aktivitas SOD pada kelompok eksperimen masih secara signifikan lebih tinggi daripada kelompok kontrol. Tidak ada perbedaan yang signifikan dalam kandungan MDA antara kelompok eksperimen dan kontrol. Hasil ini menunjukkan bahwa kerusakan oksidatif yang disebabkan oleh stres amonia-N konsentrasi rendah jangka pendek pada M. rosenbergii dapat diperbaiki setelah stres dihilangkan, tetapi udang mungkin masih dalam keadaan stres. Hasil percobaan ini mirip dengan Wu et al. ( 2024 ) dan Dong et al. ( 2018 ); setelah pemulihan, indikator antioksidan kembali ke tingkat kelompok kontrol.
ACP, yang mengkatalisis hidrolisis monoester fosfat dalam kondisi asam, berfungsi sebagai komponen penting dari fagositosis sel dalam pertahanan imun dan merupakan enzim kunci dalam detoksifikasi hewan akuatik (Paust et al. 2011 ). Pada saat yang sama, aktivitas ACP sering digunakan sebagai penanda untuk mendeteksi lisosom dalam komponen seluler dan juga merupakan salah satu zat yang digunakan untuk mengevaluasi dampak faktor lingkungan seperti DO pada stres biologis (Rajalakshmi dan Mohandas 2005 ). AKP adalah protein terikat membran yang memainkan peran penting dalam proses osifikasi, pencernaan, penyerapan dan pengangkutan nutrisi, serta dalam regulasi seluler. Aktivitas AKP umumnya digunakan untuk menentukan imunitas non-spesifik ikan yang terlibat dalam metabolisme fosfat dan penyerapan dan konversi kalsium fosfat, serta untuk mengatur metabolisme lemak tubuh (Wang et al. 2016 ). Oleh karena itu, perubahan dalam aktivitas kedua enzim ini mungkin, sampai batas tertentu, menunjukkan status imun tubuh (Matozzo dan Marin 2010 ). Hasil penelitian ini menunjukkan bahwa dalam 96 jam, aktivitas ACP meningkat secara signifikan dengan meningkatnya waktu stres, sedangkan aktivitas AKP tidak meningkat secara signifikan. Dari 96 hingga 192 jam, tingkat aktivitas ACP dan AKP mulai menurun dengan meningkatnya waktu stres. Aktivitas ACP dan AKP dalam dua kelompok yang pulih setelah stres secara signifikan lebih tinggi daripada yang ada dalam dua kelompok yang tidak pulih setelah stres berkelanjutan. Hasilnya serupa sehubungan dengan SOD, yang menunjukkan bahwa dengan perpanjangan waktu stres amonia-N dan nitrit-N, aktivitas ACP dan AKP meningkat dan kemudian menurun. Namun, setelah pemulihan, aktivitas enzim terkait imun ini kembali ke tingkat kelompok kontrol. Jiang et al. ( 2013 ) menemukan bahwa, ketika konsentrasi amonia-N meningkat, konsentrasi ACP dan AKP dalam kelompok konsentrasi tinggi menurun secara signifikan. Setelah pemulihan, baik tingkat ACP maupun AKP kembali normal, yang menunjukkan bahwa efek toksik amonia-N pada fosfolipase di Cherax quadricarinatus dapat dipulihkan. Hasil percobaan ini serupa dengan yang dilaporkan oleh Jiang et al. ( 2013 ). Diperkirakan bahwa di bawah konsentrasi tinggi amonia-N dan stres nitrit-N selama periode singkat 96 jam, sistem antioksidan ikan masih dapat membersihkan radikal bebas, dan keseimbangan antara oksidasi dan antioksidan dalam tubuh tidak terganggu secara serius. Selama periode pemulihan, aktivitas enzim antioksidan dan enzim terkait imun dipulihkan ke tingkat normal.
4.3 Pengamatan Histologi Hati dan Insang terhadap Amonia-N dan Nitrit-N pada M. salmoides
Untuk mengetahui apakah stres amonia-N dan nitrit-N akan berdampak pada struktur hati dan insang M. salmoides , pengamatan histologis digunakan. Hasil penelitian menunjukkan bahwa stres dengan 50 mg/L amonia-N atau 45 mg/L nitrit-N menyebabkan kerusakan histologis pada hati dan insang.
Fungsi utama hati ikan adalah detoksifikasi dan metabolisme, yang merupakan organ imun penting dalam tubuh ikan. Konsentrasi tinggi amonia-N dan nitrit-N, sebagai polutan di lingkungan air, dapat memengaruhi detoksifikasi normal dan fungsi metabolisme hati ikan (Vander et al. 2003 ). Pengamatan histologis hati dalam percobaan ini menunjukkan bahwa dengan peningkatan waktu stres, pembengkakan, vakuolisasi dan pergeseran inti sel hati secara bertahap memburuk. Namun, kondisi hati kedua kelompok yang pulih setelah stres lebih baik daripada kedua kelompok yang tidak pulih. Zheng ( 2020 ) mempelajari efek stres amonia-N pada organ dan faktor imun M. salmoides . Hasil penelitian menunjukkan bahwa nitrogen amonia terutama menyebabkan pembesaran abnormal, vakuolisasi, nekrosis parah pada sel hati normal, pembubaran inti sel yang luas dan pengaburan parah kontur sel dalam struktur organ hati, mirip dengan hasil percobaan ini. Dalam penelitian ini, dengan perpanjangan waktu stres, nekrosis dan vakuolisasi sel-sel hati menjadi semakin parah. Hasil-hasil ini menunjukkan bahwa setelah stres berat, ikan mungkin mengalami nekrosis berat pada sel-sel hati normal karena pembesaran dan fragmentasi sel-sel hati, pembubaran inti sel dan hilangnya sinusoid hati karena kompresi, yang menyebabkan sirkulasi darah yang buruk. Ini mungkin menjadi alasan utama hilangnya detoksifikasi normal dan fungsi metabolisme di hati, yang akhirnya menyebabkan kematian ikan. Penelitian ini juga menemukan bahwa meskipun tidak pulih ke tingkat kelompok kontrol, kondisi hati pada kedua kelompok yang pulih setelah stres lebih baik daripada kedua kelompok yang tidak pulih. Zhang dkk. ( 2015 ) mempelajari efek stres amonia-N akut dan pemulihan pasca-toksisitas pada struktur jaringan insang, hati dan ginjal pada M. amblycephala juvenil . Hasil penelitian menunjukkan bahwa tingkat kerusakan penyakit bervariasi di antara organ-organ yang berbeda, dengan jaringan hati menjadi yang paling parah rusak, diikuti oleh insang dan ginjal. Seiring dengan meningkatnya durasi stres, kerusakan pada jaringan insang, hati, dan ginjal meningkat, bersamaan dengan respons fisiologis. Namun, periode pemulihan 96 jam tidak cukup bagi M. amblycephala untuk pulih sepenuhnya dari stres. Hal ini serupa dengan hasil penelitian ini, tetapi pemulihan hati dalam penelitian ini mungkin lebih baik daripada yang dilaporkan oleh Zhang et al. ( 2015)). Berdasarkan hasil penelitian sebelumnya mengenai efek amonia-N dan nitrit-N pada aktivitas enzim yang berkaitan dengan antioksidan dan metabolisme, diperkirakan bahwa stres dapat mengaktifkan enzim antioksidan seperti SOD dan enzim yang berkaitan dengan imun seperti ACP dan AKP di hati untuk berpartisipasi dalam respons imun (Qiang et al. 2011 ), sehingga memengaruhi fungsi fisiologis normal hati dan menyebabkan berbagai tingkat kerusakan pada tubuh.
Ketika terpapar pada lingkungan akuatik, insang mudah rusak oleh zat-zat beracun dalam air, sehingga mengganggu fungsi fisiologis dan biokimia normalnya (Wu et al. 2007 ). Dalam penelitian ini, pengamatan histologis insang serupa dengan yang ada pada hati. Ketika waktu stres meningkat, pembengkakan epitel dan kongesti filamen insang, fusi filamen insang, pengeritingan lapisan filamen insang dan proliferasi secara bertahap menjadi lebih parah. Namun, kondisi insang dari dua kelompok yang pulih setelah stres lebih baik daripada dua kelompok yang tidak pulih. Zheng ( 2020 ) mempelajari efek stres amonia-N pada struktur organ insang M. salmoides juvenil , termasuk edema, degenerasi, pengelupasan sel epitel pernapasan, fragmentasi kapiler insang kecil, difusi sel darah, kongesti rongga insang dan penebalan, pemendekan, pembengkokan dan fusi skala besar potongan insang kecil. Ketika jumlah sel normal menurun, nukleus larut, vakuolisasi menjadi parah dan beberapa struktur insang menghilang. Wei et al. ( 2024 ) mempelajari efek stres amonia-N pada struktur jaringan dan mikrobiota usus M. salmoides juvenil . Hasil penelitian menunjukkan bahwa setelah 48 jam stres, baik 25 dan 50 mg/L amonia-N menyebabkan jaringan hati menunjukkan fenomena, seperti pembubaran hepatosit, vakuolisasi dan susunan yang tidak teratur. Hasil percobaan di atas mirip dengan penelitian saat ini. Penelitian juga menemukan bahwa di bawah tekanan nitrit-N sebesar 16,75 mg/L, jaringan insang Siganus rivulatus mengalami dilatasi kapiler yang parah, luapan sel darah, proliferasi yang signifikan, fusi lamelar, penebalan epitel, ulserasi dan nekrosis (Saoud et al. 2014 ). Konsentrasi nitrit-N yang tinggi juga dapat menyebabkan hipertrofi insang, proliferasi abnormal, kerusakan sel epitel dan gangguan fungsi regulasi osmotik (Ge et al. 2023 ). Hasil serupa telah dilaporkan untuk Paramisgurnus dabryanus (Wang et al. 2021 ) dan O. niloticus (Esam et al. 2022).). Penelitian telah menunjukkan bahwa zat-zat berbahaya dalam air dapat menyebabkan kerusakan yang signifikan pada insang ikan, umumnya dari dua jenis. Kerusakan langsung mengacu pada kematian langsung sel-sel normal di insang yang disebabkan oleh zat-zat beracun, termasuk nekrosis yang luas dan pengelupasan sel-sel epitel pernapasan dalam filamen insang dan nekrosis variabel sel-sel kolumnar. Jenis kedua adalah cedera defensif, yang mengacu pada kerusakan yang disebabkan oleh sel-sel normal di insang untuk melawan zat-zat beracun, termasuk pembesaran filamen insang, penebalan dan pemendekan filamen insang dan proliferasi sel-sel yang mensekresi klorida (Fanta et al. 2003 ). Telah berspekulasi bahwa stres dapat mengaktifkan mekanisme pengaturan keseimbangan osmotik di insang M. salmoides untuk meningkatkan kemampuan pertahanannya. Namun, stres dapat menyebabkan kerusakan defensif pada struktur jaringan insang, seperti proliferasi sel-sel yang mensekresi klorida, yang dapat menghambat fungsi pernapasan insang M. salmoides . Pada akhirnya, efek destruktif pada insang jauh lebih besar daripada efek defensif dan protektif, yang menyebabkan ikan mati lemas dan mati. Singkatnya, dapat disimpulkan bahwa kerusakan yang disebabkan oleh amonia-N dan nitrit-N pada struktur insang mungkin menjadi penyebab utama mati lemas dan kematian akibat terhambatnya pernapasan ikan.
4.4 Komposisi dan Keanekaragaman Mikrobiota Usus Amonia-N dan Nitrit-N pada M. salmoides
Untuk meneliti apakah stres amonia-N dan nitrit-N akan berdampak pada mikrobiota usus M. salmoides , komposisi dan keanekaragaman mikrobiota usus dianalisis. Hasil penelitian menunjukkan bahwa stres dengan 50 mg/L amonia-N atau 45 mg/L nitrit-N menyebabkan penurunan keanekaragaman mikrobiota usus. Namun, meskipun pemulihan setelah stres tidak dapat dikembalikan ke tingkat sebelum stres, kelompok tersebut memiliki keanekaragaman mikrobiota yang lebih tinggi daripada kelompok yang tidak pulih dari stres berkelanjutan.
Usus adalah tempat utama untuk pencernaan dan penyerapan dalam tubuh, dan mikrobiota usus memainkan peran penting dalam respons imun inang dan stabilitas lingkungan internal (Liu et al. 2021 ). Perubahan dalam lingkungan akuatik dapat memicu respons stres pada hewan, yang memengaruhi struktur mikrobiota usus (Llewellyn et al. 2014 ). Dalam sebuah penelitian pada ikan lele kuning hibrida P. fulvidraco♀×P. vachellii♂ , peningkatan konsentrasi amonia-N mengganggu homeostasis mikrobiota usus, yang menyebabkan stres oksidatif dan gangguan metabolik dan imun (Zheng et al. 2022 ). Huang et al. ( 2024 ) menemukan bahwa kelimpahan mikrobiota usus di M. salmoides pada tingkat filum adalah yang tertinggi di Firmicutes, Proteobacteria, Fusobacteriota dan Actinobacteria. Ini konsisten dengan hasil percobaan ini; Namun, keempat tipe komunitas mikroba ini berada dalam keadaan dinamis selama stres, di antaranya Proteobacteria, filum terbesar di antara bakteri, juga mengandung sejumlah besar bakteri patogen. Firmicutes dapat digunakan untuk menunjukkan tingkat obesitas pada hewan dan memainkan peran penting dalam metabolisme energi di usus ikan (Wei et al. 2024 ), sedangkan Fusobacteriota adalah spesies bakteri Gram-negatif anaerobik, yang umum ditemukan di saluran pencernaan, yang dapat menyebabkan penyakit (Wang et al. 2006 ). Proteobacteria sering mendominasi mikrobioma usus dan berpartisipasi dalam degradasi karbon dan nitrogen (Duan et al. 2021 ). Perubahan kelimpahan relatif dalam empat filum yang disebutkan di atas menunjukkan efek stres amonia-N dan nitrit-N pada fungsi usus M. salmoides . Hasil penelitian ini menunjukkan bahwa kelimpahan filum lain menurun dan kelimpahan Fusobacteriota meningkat setelah stres amonia-N dan nitrit-N. Peningkatan terus-menerus dalam kelimpahan Fusobacteriota selama periode pemulihan dapat mengindikasikan bahwa satu spesies Fusobacteriota secara bertahap menempati sebagian besar mikrobiota usus, yang dapat menyebabkan penyakit. Bahkan dengan pemulihan, bahaya tersembunyi dari penyakit tidak dapat dikurangi.
Selain itu, hasil penelitian ini menunjukkan bahwa genus dengan kelimpahan tertinggi adalah Cetobacterium , Aeromonas , Mycoplasma dan Candidatus_Bacilloplasma. Candidatus_Bacilloplasma adalah garis keturunan baru Mollicutes yang berhubungan dengan dinding usus belakang isopoda terestrial Porcellio scaber . Garis keturunan ini diposisikan sebagai kelompok saudara bagi klade yang terdiri dari kelompok Spiroplasma dan Mycoplasma (Rok et al. 2007 ). Penelitian tentang bakteri ini relatif sedikit, dan eksplorasi lebih lanjut diperlukan di masa mendatang. Mycoplasma adalah mikroorganisme patogen gram negatif yang sangat polimorfik yang tidak memiliki dinding sel. Aeromonas termasuk dalam famili Aeromonas dan merupakan kelompok bakteri Gram negatif yang tersebar luas di lingkungan perairan. Sebagian besar bakteri dalam genus ini telah dilaporkan memiliki patogenisitas yang kuat pada ikan (Janda dan Abbott 2010 ). Cetobacterium , di sisi lain, adalah bakteri menguntungkan anaerobik fakultatif dan komunitas mikroba inti dari banyak bakteri usus ikan, yang terlibat dalam sintesis vitamin B12 (Tsuchiya et al. 2008 ). Penelitian telah menunjukkan bahwa ketika kandungan amonia-N dalam air mencapai 10 mg/L, kelimpahan Cetobacterium dalam usus C. auratus meningkat secara signifikan, dan ekspresi gen terkait enzim antioksidan meningkat (Qi et al. 2017 ). Li et al. ( 2020 ) memelihara (betina Culter alburnus Basilewsky × jantan Megalobrama terminalis ) dalam sistem akuakultur ras dalam kolam (IPR). Ada sejumlah besar spesies yang termasuk dalam Cetobacterium di saluran usus ikan, sedangkan kelimpahan Proteobacteria, Firmicutes dan taksa lainnya menurun, yang menunjukkan bahwa dalam sistem akuakultur IPR, struktur mikrobiota usus subjek akuakultur mengalami perubahan tertentu. Peningkatan kelimpahan Cetobacterium pada mikrobiota usus ikan kemungkinan disebabkan oleh respon stres yang disebabkan oleh amonia-N. Hasil penelitian ini menunjukkan bahwa setelah stres amonia-nitrogen, kelimpahan Candidatus-Bacilloplasma menurun, sedangkan Mycoplasma dan Cetobacterium meningkat. Selama masa pemulihan, kelimpahan Cetobacterium meningkat. Setelah stres nitrit-N, kelimpahan Candidatus-Bacilloplasma meningkat.menurun, sedangkan Aeromonas , Cetobacterium , dan Mycoplasma meningkat. Selama masa pemulihan, kelimpahan Cetobacterium dan Mycoplasma terus meningkat. Hal ini menunjukkan bahwa bakteri merugikan seperti Mycoplasma dan Aeromonas berangsur-angsur meningkat seiring dengan peningkatan stres, dan kelimpahan bakteri menguntungkan seperti Cetobacterium juga mulai meningkat. Namun, selama masa pemulihan pasca-stres, kelimpahan Cetobacterium meningkat secara signifikan. Telah dispekulasikan bahwa bakteri ini mungkin berperan dalam menahan stres amonia-N dan nitrit-N.
Penelitian sebelumnya telah menunjukkan bahwa penurunan keanekaragaman dapat menyebabkan penurunan stabilitas fungsional komunitas bakteri, sehingga meningkatkan risiko penyakit pada organisme yang dibudidayakan (Jones dan Lennon 2010 ). Ditemukan bahwa keanekaragaman bakteri dalam usus hewan pada kelompok yang terkena menurun secara signifikan dibandingkan dengan kelompok yang sehat, dan penurunan keanekaragaman mikrobiota usus ikan dapat menjadi peringatan stres (Jones dan Lennon 2010 ). Hasil penelitian ini menunjukkan bahwa keanekaragaman mikroba dari empat kelompok di bawah stres amonia-N dan nitrit-N dan pemulihan lebih rendah daripada kelompok kontrol dan bahwa keanekaragaman mikroba dari dua kelompok yang pulih setelah stres lebih tinggi daripada dua kelompok yang tidak pulih setelah stres terus-menerus. Wei et al. ( 2024 ) menemukan bahwa stres amonia-N selama 48 jam secara signifikan mengurangi keanekaragaman alfa dan beta mikrobiota usus pada M. salmoides , yang mengarah pada penurunan toleransi stres dan kerentanan terhadap disfungsi usus. Ada pula penelitian yang menunjukkan bahwa di bawah tekanan nitrit-N, keragaman mikrobiota C. quadricarinatus menurun, yang dapat memengaruhi kelangsungan hidup dan pertumbuhannya (Wei et al. 2022 ). Penelitian ini serupa dengan penelitian sebelumnya yang menyatakan bahwa tekanan amonia-N dan nitrit-N menyebabkan penurunan keragaman mikrobiota usus. Akan tetapi, dalam penelitian ini, kami juga menemukan bahwa pemulihan setelah stres membantu memulihkan keragaman mikrobiota. Meskipun tidak dapat dikembalikan ke tingkat sebelum stres, kelompok tersebut memiliki keragaman mikrobiota yang lebih tinggi daripada kelompok yang tidak pulih dari stres berkelanjutan.
5. Kesimpulan
Dengan menggunakan uji toksisitas akut konvensional, kami menentukan bahwa konsentrasi semi-mematikan (LC50) amonia-N dalam M. salmoides pada 96 jam adalah 120,56 mg/L dan LC50 nitrit-N adalah 195,47 mg/L. Selanjutnya, dilakukan penelitian terhadap stres dan pemulihan amonia-N 50 mg/L atau nitrit-N 45 mg/L. Hasil utamanya adalah sebagai berikut.
- Aktivitas SOD, ACP, dan AKP pada kelompok eksperimen menunjukkan tren peningkatan pertama dan kemudian penurunan. Aktivitas SOD dan indeks MDA pada Kelompok 1 secara signifikan lebih rendah daripada aktivitas pada empat kelompok lainnya pada 96 jam. Aktivitas SOD pada Kelompok 1, 3, dan 5 secara signifikan lebih tinggi daripada aktivitas pada Kelompok 2 pada 192 jam, sedangkan aktivitas MDA secara signifikan lebih rendah daripada aktivitas pada Kelompok 2 dan 4. Aktivitas ACP pada Kelompok 1 secara signifikan lebih rendah daripada aktivitas pada empat kelompok lainnya pada 96 jam. Aktivitas ACP dan AKP pada Kelompok 1, 3, dan 5 secara signifikan lebih tinggi daripada aktivitas pada Kelompok 2 dan 4 pada 192 jam.
- Dengan peningkatan waktu stres, pembengkakan, vakuolisasi, dan pergeseran inti sel hati secara bertahap memburuk. Namun, kondisi hati pada kedua kelompok yang pulih setelah stres (Kelompok 3 dan 5) lebih baik daripada kedua kelompok yang tidak pulih setelah stres (Kelompok 2 dan 4). Pengamatan histologis insang serupa dengan hati. Saat waktu stres meningkat, pembengkakan epitel dan kongesti filamen insang, fusi filamen insang, pengeritingan berlapis filamen insang, dan proliferasi secara bertahap menjadi lebih parah. Namun, kondisi insang kedua kelompok yang pulih setelah stres lebih baik daripada kedua kelompok yang tidak pulih.
- Pada tingkat filum, setelah stres amonia-N, kelimpahan Proteobacteria dan Actinobacteria menurun, sedangkan kelimpahan Fusobacteriota meningkat. Namun, selama periode pemulihan, kelimpahan Fusobacteriota terus meningkat. Setelah stres nitrit-N, kelimpahan Firmicutes dan Actinobacteria menurun, sedangkan kelimpahan Fusobacteriota meningkat. Namun, selama periode pemulihan, kelimpahan Fusobacteriota terus meningkat. Pada tingkat genus, kelimpahan Candidatus-Bacilloplasma menurun setelah stres amonia-N, sedangkan kelimpahan Mycoplasma dan Cetobacterium meningkat. Selama periode pemulihan, kelimpahan Cetobacterium meningkat. Setelah stres nitrit-N, kelimpahan Candidatus-Bacilloplasma menurun, sedangkan Aeromonas , Cetobacterium dan Mycoplasma meningkat . Selama periode pemulihan, kelimpahan Cetobacterium dan Mycoplasma terus meningkat. Secara bersamaan, keragaman mikroba dari empat kelompok yang mengalami stres amonia-N dan nitrit-N serta pemulihannya lebih rendah daripada kelompok kontrol, dan keragaman mikroba dari dua kelompok yang pulih setelah stres lebih tinggi daripada dua kelompok yang tidak pulih setelah stres berkelanjutan.
Singkatnya, kami menemukan bahwa stres dengan 50 mg/L amonia-N atau 45 mg/L nitrit-N menyebabkan perubahan pada indikator aktivitas enzim antioksidan dan imun, kerusakan histologis pada hati dan insang, serta perubahan pada mikrobiota usus utama dan keanekaragaman pada M. salmoides . Pemulihan dapat memperbaiki kondisi ini, tetapi masih belum dapat mencapai keadaan sebelum stres. Dalam produksi akuakultur yang sebenarnya, perhatian yang cermat harus diberikan pada kondisi ikan setelah stres untuk mencegah penyakit atau stres yang berulang. Selain itu, penelitian di masa depan harus melakukan eksplorasi yang lebih mendalam dan mengeksplorasi lebih lanjut apakah pemulihan dalam jangka waktu yang lebih lama dapat mencapai keadaan sebelum stres pada M. salmoides .


