Abstrak
LATAR BELAKANG
Kulit kenari, yang dibuang sebagai limbah baik di tingkat rumah tangga maupun industri, merupakan sumber senyawa fenolik yang baik. Tujuan dari penelitian ini adalah untuk menerapkan metode ekstraksi berbantuan ultrasonik menggunakan sepuluh pelarut eutektik alami (NADES) berbasis kolin klorida (ChCl) yang berbeda untuk memperoleh senyawa fenolik dari limbah kulit kenari (WSW) dan untuk mengevaluasi bioaksesibilitas in vitro dari ekstrak hijau yang dihasilkan. Senyawa fenolik diidentifikasi dan diukur menggunakan kromatografi cair kinerja ultra yang digabungkan dengan spektrometri massa tandem ionisasi elektrospray.
HASIL
Hasil penelitian menunjukkan bahwa quercitrin dan taxifolin merupakan flavonoid dominan dalam WSW, sedangkan asam ellagic merupakan asam fenolik dominan. Kandungan total fenolik (TPC) yang dapat diakses secara biologis, total kapasitas antioksidan (TAC), flavonoid dan asam fenolik serta aldehida lebih tinggi dalam sebagian besar ekstrak NADES dibandingkan dengan ekstrak etanol. Ekstrak yang dibuat dengan ChCl:asam laktat menunjukkan bioaksesibilitas tertinggi untuk TPC (79%), TAC (72%) dan flavonoid (81%), sedangkan ChCl:gliserol memiliki kadar asam fenolik dan aldehida yang dapat diakses secara biologis tertinggi (99%).
KESIMPULAN
Studi ini menekankan efektivitas penanganan WSW dengan NADES yang dikombinasikan dengan ultrasonikasi untuk meningkatkan pemulihan dan bioaksesibilitas senyawa fenolik. © 2025 Penulis. Jurnal Ilmu Pangan dan Pertanian yang diterbitkan oleh John Wiley & Sons Ltd atas nama Society of Chemical Industry.
PERKENALAN
Menurut data terbaru dari FAO, produksi kenari global telah mencapai sekitar 4 juta ton per tahun. Turki merupakan salah satu produsen kenari terbesar di dunia, setelah Tiongkok, AS, dan Iran. 1 Sebagian besar kenari yang ditanam di Turki dikonsumsi di dalam negeri sebagai produk segar, sehingga menghasilkan cangkang di tingkat rumah tangga dan industri. Cangkang tersebut merupakan lebih dari 50% dari berat total kenari, sehingga sekitar 2,3 juta ton cangkang kenari dihasilkan sebagai limbah pertanian setiap tahun. 2 Meskipun sebagian besar cangkang limbah dari produksi industri saat ini digunakan dalam produksi biofuel, kandungan fenoliknya yang tinggi memberi potensi untuk diubah menjadi produk bernilai tinggi.
Senyawa fenolik dapat diekstraksi dari bahan tanaman menggunakan metode ekstraksi tradisional atau ramah lingkungan. Ekstraksi berbantuan ultrasonik merupakan salah satu teknologi ramah lingkungan yang menawarkan beberapa keunggulan dibandingkan metode ekstraksi konvensional. Manfaat ini meliputi retensi senyawa yang peka terhadap panas yang lebih baik, konsumsi energi yang berkurang, dan waktu pemrosesan yang lebih singkat. 3 Ultrasonografi meningkatkan interaksi antara bahan tanaman dan pelarut dengan meningkatkan permeabilitas dinding sel melalui osilasi. Proses ini mengganggu dinding sel tanaman, sehingga mendorong perpindahan massa senyawa fenolik ke dalam pelarut. 4
Pelarut organik seperti etanol, metanol, aseton, dan isopropanol, yang dicampur dengan berbagai proporsi air, telah banyak digunakan untuk mengekstrak senyawa fenolik dari sumber tanaman menggunakan ekstraksi berbantuan ultrasonik. 5 Namun, penggunaan pelarut organik ini dapat membahayakan lingkungan dan dapat meninggalkan residu beracun dalam ekstrak. Sebagaimana dinyatakan dalam Arahan 2009/32/EC yang mengatur penggunaan pelarut ekstraksi dalam produksi makanan dan bahan makanan, produk makanan tidak boleh mengandung residu pelarut pada tingkat yang dapat membahayakan kesehatan manusia. 6 Pelarut eutektik alami dalam (NADES) adalah generasi baru pelarut hijau yang dikembangkan untuk mengatasi masalah ini.
NADES disintesis dengan menggabungkan senyawa non-ionik, biasanya garam dan senyawa molekuler, di mana satu komponen berfungsi sebagai donor ikatan hidrogen (HBD) dan yang lainnya sebagai akseptor ikatan hidrogen (HBA), pada rasio molar tertentu. 7 HBA biasanya berupa garam amonium kuarterner, seperti kolin klorida (ChCl), sedangkan HBD dapat berasal dari berbagai golongan kimia, termasuk gula, asam organik, amina, atau polialkohol. Molekul-molekul ini menciptakan campuran eutektik dengan suhu transisi yang lebih rendah daripada suhu masing-masing komponen. 8 Penelitian terkini telah menunjukkan bahwa penggunaan NADES sebagai pelarut ekstraksi merupakan strategi yang efektif untuk memulihkan senyawa fenolik dari limbah makanan, yang seringkali mengungguli pelarut organik tradisional. 9 – 11
Pemilihan NADES untuk ekstraksi fenolik sering dipandu oleh faktor-faktor seperti polaritas, viskositas dan kapasitas ikatan hidrogen dari komponen pelarut, yang secara langsung memengaruhi kemampuan mereka untuk melarutkan dan mengekstrak senyawa fenolik target. 7 , 12 Pilihan NADES berbasis ChCl dalam penelitian ini didasarkan pada literatur sebelumnya yang menunjukkan keefektifannya dalam memulihkan senyawa fenolik target dari produk sampingan agri-food. 9 , 11 , 13 – 16 Selain itu, ekstraksi berbantuan ultrasonik sering dipilih sebagai metode ekstraksi hijau karena kemampuannya untuk meningkatkan perpindahan massa melalui efek kavitasi, yang mengarah pada hasil senyawa bioaktif yang lebih tinggi dengan waktu ekstraksi yang lebih pendek. 3 , 5 , 7 Beberapa penelitian terbaru juga menekankan penggunaan sinergis NADES dan ekstraksi berbantuan ultrasonik untuk meningkatkan efisiensi dan selektivitas ekstraksi, terutama untuk fenolik yang labil dan beragam secara struktural. 7 , 8
Manfaat kesehatan potensial dari senyawa fenolik bergantung pada pelepasannya di saluran pencernaan, yang juga dikenal sebagai bioaksesibilitasnya. Metode pencernaan in vitro , yang cepat dan andal serta tidak memiliki masalah etika yang terkait dengan metode in vivo , umumnya digunakan untuk mensimulasikan kondisi gastrointestinal. 17 Penelitian tentang bioaksesibilitas in vitro senyawa fenolik yang diekstraksi dengan NADES masih langka, 18 , 19 dan sejauh pengetahuan kami, belum ada penelitian yang menilai bioaksesibilitas senyawa fenolik dalam ekstrak NADES yang berasal dari limbah kulit kenari (WSW). Untuk mengatasi kesenjangan ini, kami bertujuan untuk menerapkan metode ekstraksi berbantuan ultrasonik menggunakan NADES berbasis ChCl untuk memulihkan senyawa fenolik dari WSW dan untuk mengevaluasi bioaksesibilitas in vitro dari ekstrak hijau yang dihasilkan.
BAHAN DAN METODE
Bahan
Dalam penelitian ini, digunakan kacang kenari Chandler ( Juglans regia L.), yang dikenal sebagai varietas yang paling banyak dikonsumsi di Turki dan di seluruh dunia. Kulitnya dibersihkan dan dipisahkan dari buahnya menggunakan pemecah kacang. Kacang kenari yang diperoleh digiling menjadi bubuk halus menggunakan penggiling sentrifugal berkecepatan tinggi (Retsch ZM 200, Haan, Jerman). Selanjutnya, bubuk tersebut diayak (1 mm) dan disimpan pada suhu -20 °C hingga analisis dilakukan.
Persiapan NADES
Dalam preparasi NADES, ChCl (≥98%) dari Sigma-Aldrich (Steinheim, Jerman) digunakan sebagai HBA. Asam laktat (>90,0%), asam sitrat (>98,0%) dan asam malat (>99,0%) dari TCI (Tokyo, Jepang), serta glukosa (>98,0%) dan gliserol (>99,0%) dari Merck (Darmstadt, Jerman), digunakan sebagai HBD. NADES disiapkan menurut rasio molar yang ditentukan berdasarkan penelitian sebelumnya dalam literatur, 8 , 13 , 20 , 21 dan dicampur dalam penangas air goyang (Nuve ST 30, Ankara, Türkiye) pada suhu 80 °C hingga diperoleh cairan homogen dan tidak berwarna. Untuk mengurangi viskositas, 30% (v/v) air ditambahkan ke dalam campuran, yang kemudian dipusarkan dan disimpan dalam bak ultrasonik (Elma LC30H, Darmstadt, Jerman) selama 10 menit untuk memastikan kelarutan. Penambahan air (30% v/v) ke NADES berbasis ChCl dimaksudkan untuk mengurangi viskositas inheren pelarut, sehingga meningkatkan perpindahan massa dan memfasilitasi interaksi yang lebih baik dengan matriks tanaman selama ekstraksi. Tingkat pengenceran ini dipilih berdasarkan penelitian sebelumnya yang menunjukkan bahwa kadar air 30% dapat secara signifikan meningkatkan kinerja ekstraksi NADES tanpa mengganggu struktur eutektik atau kapasitas ikatan hidrogennya. 7 , 20 , 22 , 23 Mempertahankan keseimbangan ini sangat penting, karena penambahan air yang berlebihan dapat melemahkan sifat pelarut unik NADES, sementara air yang tidak mencukupi dapat membatasi penerapannya karena viskositas yang tinggi. Larutan etanol 70% digunakan untuk perbandingan (Tabel 1 ).
| NADES | HBA | HBD | Rasio molar | Kepadatan (g cm −3 ) | Tingkat keasaman (pH) |
|---|---|---|---|---|---|
| 1 | Kolin klorida | Asam laktat | 1:2 | 1.1385 | 1.31 |
| 2 | Kolin klorida | Asam laktat | 1:1 | 1.1425 | 1.78 |
| 3 | Kolin klorida | Gliserin | 1:2 | 1.1645 | 3.97 |
| 4 | Kolin klorida | Gliserin | 1:3 | 1.1655 | 3.62 |
| 5 | Kolin klorida | Glukosa | 2:1 | 1.1650 | 3.55 |
| 6 | Kolin klorida | Glukosa | 1:1 | 1.1145 | 3.41 |
| 7 | Kolin klorida | Asam sitrat | 1:2 | 1.2780 | 0.41 |
| 8 | Kolin klorida | Asam sitrat | 1:1 | 1.2190 | 0,80 |
| 9 | Kolin klorida | asam malat | 1:2 | 1.2485 | 0.67 |
| 10 | Kolin klorida | asam malat | 1:1 | 1.2065 | 0.92 |
Semua pelarut diencerkan dengan 30% (v/v) air. Hasilnya dinyatakan sebagai rata-rata dari tiga pengukuran.
Karakterisasi NADES
Kepadatan dan pH
Untuk menentukan kepadatan NADES, 1 mL larutan ditimbang pada suhu ruangan menggunakan neraca analitik (Mettler Toledo MS3002S, Greifensee, Swiss). Kepadatan kemudian dihitung menggunakan rumus berikut: ρ = m NADES / V NADES . pH NADES diukur menggunakan pH meter (Mettler Toledo S220).
Spektroskopi inframerah transformasi Fourier (FTIR)
Spektrum FTIR NADES diperoleh pada suhu kamar pada rentang bilangan gelombang 4500 hingga 500 cm −1 , dengan resolusi 4 cm −1 dan 32 pemindaian per spektrum (Shimadzu IRTracer-100, Tokyo, Jepang).
Ekstraksi senyawa fenolik dengan bantuan ultrasonik
Ekstraksi senyawa fenolik dilakukan seperti yang dijelaskan sebelumnya dalam literatur. 24 Larutan NADES 10 mL, disiapkan seperti yang ditentukan dalam Tabel 1 , ditambahkan ke 0,5 g bubuk WSW, dan campuran tersebut ditempatkan dalam bak ultrasonik (Elma LC30H) pada suhu 60 °C dan frekuensi 50 Hz selama 30 menit. Campuran tersebut kemudian disentrifugasi pada 10.000 × g selama 10 menit (Hitachi CF15RN, Tokyo, Jepang), dan supernatan dipindahkan ke tabung bersih. Prosedur yang sama dilakukan dengan larutan etanol 70% yang digunakan sebagai kontrol. Semua ekstrak yang disiapkan (Gbr. 1 ) disimpan pada suhu 4 °C hingga analisis dilakukan.

Simulasi pencernaan in vitro
Model pencernaan in vitro diterapkan menggunakan bak air goyang (Nüve ST 30) seperti yang dijelaskan sebelumnya. 25 Aliquot yang masing-masing berisi 5 mL sampel diambil setelah pencernaan lambung dan usus. Sampel-sampel ini disentrifugasi (Hitachi CF15RN) pada 20.000 × g selama 5 menit, dan supernatan disimpan pada suhu -20 °C.
Kandungan fenolik total (TPC)
TPC sampel ditentukan seperti yang dijelaskan sebelumnya. 26 Hasil diperoleh menggunakan kurva standar asam galat (kisaran konsentrasi: 10–400 mg L −1 , R 2 = 0,9994) dan dilaporkan sebagai gram ekuivalen asam galat (GAE) per kilogram. Untuk meminimalkan potensi gangguan dari matriks NADES, terutama karena sifat reduksinya, semua campuran disentrifugasi pada 10.000 × g selama 5 menit sebelum pengukuran absorbansi. Langkah ini membantu menghilangkan partikel dan meningkatkan akurasi pembacaan spektrofotometri.
Kapasitas antioksidan total (TAC)
TAC sampel ditentukan menggunakan uji kapasitas antioksidan pengurang ion kupri (CUPRAC), 27 dan 2,2-difenil-1-pikrilhidrazil (DPPH) 28. Hasilnya diperoleh menggunakan kurva standar Trolox® (rentang konsentrasi: 1–600 mg L −1 , R 2 > 0,997) dan dilaporkan dalam gram ekuivalen Trolox® (TE) per kilogram.
Identifikasi dan kuantifikasi senyawa fenolik menggunakan UPLC–ESI-MS/MS
Senyawa fenolik diidentifikasi dan diukur menggunakan kromatografi cair kinerja tinggi yang digabungkan dengan sistem spektrometri massa tandem ionisasi elektrospray (UPLC–ESI-MS/MS) (Shimadzu LC-MS/MS 8060, Kyoto, Jepang) yang dilengkapi dengan kolom C18 (100 × 3 mm, 3 μm; GL Sciences, Tokyo, Jepang) seperti yang dijelaskan sebelumnya. 4 MS beroperasi dalam mode ESI negatif dan positif. Spektrum sampel direkam dalam mode pemantauan reaksi ganda, dan akuisisi data dilakukan menggunakan perangkat lunak LabSolution (Shimadzu Co.). Senyawa-senyawa tersebut diukur menggunakan standar eksternal berikut: katekin (≥99,0%), isoquercitrin (≥98,0%), taksifolin (≥95,0%), quercitrin (≥95,0%), quercetin (≥95,0%), isorhamnetin (≥95,0%), asam protokatekuat (≥97,0%), asam p -salisilat (≥99,0%), asam ellagik (≥95,0%), vanilin (≥97%) dan sinapaldehida (≥99,0%). Hasilnya dilaporkan dalam μg kg −1 .
Analisis statistik
Analisis dilakukan dalam rangkap tiga, dan hasilnya dinyatakan sebagai rata-rata ± simpangan baku. Data dianalisis secara statistik menggunakan perangkat lunak SPSS (versi 24; Chicago, IL, AS). Perbedaan antarperlakuan dievaluasi dengan analisis varians satu arah diikuti oleh uji post hoc Tukey , dengan mempertimbangkan P < 0,05 sebagai signifikan secara statistik.
HASIL DAN PEMBAHASAN
Karakterisasi NADES
Kepadatan NADES berkisar dari minimum 1,1145 g cm −3 untuk ChCl:glukosa (1:1) hingga maksimum 1,2780 g cm −3 untuk ChCl:asam sitrat (1:2), sedangkan pH NADES berkisar dari minimum 0,41 untuk ChCl:asam sitrat (1:2) hingga maksimum 3,97 untuk ChCl:gliserol (1:2). (Tabel 1 ). Hasil kepadatan sesuai dengan literatur yang melaporkan bahwa sebagian besar NADES memiliki kepadatan lebih tinggi daripada air, biasanya berkisar dari 1,0 hingga 1,35 g cm −3 pada suhu kamar. 22 pH NADES merupakan parameter penting selama proses ekstraksi karena mempengaruhi interaksi molekuler antara zat terlarut target dan pelarut eutektik. Beberapa penelitian dalam literatur menunjukkan bahwa senyawa fenolik lebih mudah diekstraksi dalam bentuk netral, yang terjadi ketika pH pelarut lebih rendah dari pKa fenolik . 29 Penting untuk dicatat bahwa pemilihan kombinasi NADES dan rasio molarnya dalam studi ini didasarkan pada bukti dari studi sebelumnya yang menunjukkan bahwa HBD berbasis asam, gula, dan poliol menunjukkan kapasitas yang bervariasi untuk mengekstraksi fenolik tergantung pada kompatibilitas kimianya dengan senyawa target. 7 , 13 , 20 , 21 Efektivitas NADES berbasis ChCl yang dipilih dikaitkan dengan polaritas dan kemampuan ikatan hidrogen yang menguntungkan, yang memungkinkan pelarutan senyawa fenolik dari matriks kulit kenari secara efisien. Selain itu, menggabungkan NADES dengan ekstraksi berbantuan ultrasonik sangat menguntungkan, karena ultrasonikasi dapat mengurangi keterbatasan NADES yang terkait dengan viskositas dengan meningkatkan penetrasi pelarut dan meningkatkan gangguan dinding sel, yang mengarah pada peningkatan efisiensi ekstraksi. 7 , 8 , 12 Karakterisasi gugus fungsi dalam NADES yang disintesis dilakukan menggunakan analisis FTIR, seperti yang ditunjukkan pada informasi pendukung, Gambar S1 . NADES yang disintesis menunjukkan bahwa campuran yang dilelehkan membentuk pelarut homogen dan menunjukkan ikatan hidrogen, seperti yang ditunjukkan oleh puncak lebar pada 3000–3500 cm −1 yang sesuai dengan peregangan gugus –OH bebas. Kehadiran gugus hidroksil menunjukkan bahwa NADES yang disintesis dapat membentuk ikatan hidrogen dengan senyawa lain, yang memungkinkan mereka untuk mengekstrak senyawa bioaktif dari produk alami.
TPC dan TAC
TPC dan TAC ekstrak WSW yang disiapkan menggunakan ekstraksi berbantuan ultrasonik dengan sepuluh NADES berbeda dievaluasi dan dibandingkan dengan ekstrak etanol (Tabel 2 ). Sebelum pencernaan, TPC tertinggi diperoleh untuk ekstrak ChCl:glukosa (2:1) dan ChCl:gliserol (1:2), yang secara statistik tidak berbeda secara signifikan dari ekstrak ChCl:asam malat (1:2) ( P > 0,05). Ekstrak ChCl:gliserol (1:2) juga menunjukkan TAC tertinggi dalam uji CUPRAC dan DPPH, sedangkan ekstrak ChCl:glukosa (1:1) memiliki TAC terendah. Telah dilaporkan bahwa ChCl:gliserol, NADES berbasis polialkohol, lebih efektif daripada NADES berbasis asam karboksilat dan gula untuk ekstraksi senyawa fenolik. Efektivitas ini dapat disebabkan oleh fakta bahwa HBD dari NADES berbasis alkohol sebagian besar cair, mudah disintesis dan memiliki viskositas rendah, sedangkan HBD dari jenis NADES lainnya biasanya padat dan memiliki viskositas yang relatif tinggi. 12 Beberapa ekstrak NADES, khususnya ChCl:gliserol (1:2 dan 1:3) dan ChCl:asam malat (1:2), memiliki TPC dan TAC yang secara signifikan lebih tinggi dibandingkan dengan ekstrak etanol (16–80%) ( P < 0,05). Penelitian sebelumnya pada ampas apel 31 dan daun brokoli 11 juga menunjukkan bahwa NADES tertentu lebih efektif daripada pelarut organik konvensional dalam ekstraksi senyawa fenolik. Lebih jauh, penurunan rasio molar ChCl terhadap HBD dalam NADES tidak memiliki efek signifikan ( P > 0,05) pada TPC atau menghasilkan pengurangan signifikan ( P < 0,05), seperti yang diamati dalam kasus gliserol dan glukosa. Hasil serupa, yang menunjukkan bahwa penurunan rasio molar ChCl:gliserol mengakibatkan penurunan senyawa fenolik, telah dilaporkan dalam literatur. 32 Pengamatan ini terkait dengan fakta bahwa, karena gugus hidroksilnya, sebagian besar senyawa fenolik dapat berfungsi sebagai HBD, dan oleh karena itu kelebihan gliserol dapat meningkatkan gangguan sistem, sehingga melemahkan interaksi antara senyawa target dan anion klorida. 12 Secara paralel, hasil TAC tidak berubah atau berkurang secara signifikan ketika rasio molar ChCl terhadap HBD dalam NADES menurun.
| Pelarut | Tidak tercerna | Pencernaan lambung | Pencernaan usus |
|---|---|---|---|
| TPC (g GAE kg −1 ) | |||
| NADES 1 | 26,8 ± 1,3 deviasi,A | 23,7 ± 0,9 SM,B | 21,2 ± 0,8 bcd, B |
| NADES 2 | 25,2 ± 0,8 ef,A | 23,9 ± 1,9 SM,A | 19,0 ± 0,3 hari, B |
| NADES 3 | 41,0 ± 1,2 a,A | 34,7 ± 2,6 a,B | 23,5 ± 1,6 abc,C |
| NADES 4 | 35,0 ± 2,9 SM,A | 34,9 ± 1,6 μA | 20,3 ± 1,5 cd,B |
| NADES 5 | 41,1 ± 5,2 a,A | 23,3 ± 1,4 c,B | 27,1 ± 1,5 a,B |
| NADES 6 | 35,3 ± 1,0 SM,A | 23,8 ± 1,3 SM,B | 25,6 ± 2,6 a, B |
| NADES 7 | 27,3 ± 1,5 derajat,A | 26,7 ± 1,4 SM,A | 18,1 ± 0,6 hari, B |
| NADES 8 | 29,8 ± 1,3 cde,A | 25,2 ± 1,2 SM,B | 18,7 ± 1,2 hari,C |
| NADES 9 | 38,2 ± 0,9 ab,A | 33,3 ± 1,5 a,B | 24,1 ± 0,3 derajat Celcius |
| NADES 10 | 32,4 ± 0,2 bcd,A | 27,8 ± 1,0 b,A | 21,1 ± 1,0 bcd,C |
| Etanol | 23,4 ± 0,9 f,B | 25,4 ± 0,9 SM,A | 13,1 ± 0,7 e,C |
| TAC (g TE kg −1 ) | |||
| Pengujian CUPRAC | |||
| NADES 1 | 37,5 ± 1,3 e,A | 34,9 ± 3,3 b,A | 27,1 ± 1,7 ab,B |
| NADES 2 | 38,3 ± 0,6 dB | 36,5 ± 7,2 b,AB | 26,6 ± 0,4 ab,B |
| NADES 3 | 55,2 ± 1,7 μA | 50,5 ± 2,9 μA | 25,2 ± 0,7 abc,B |
| NADES 4 | 52,7 ± 2,0 ab,A | 55,6 ± 1,8 μA | 24,4 ± 1,5 SM,B |
| NADES 5 | 36,9 ± 1,9 e,A | 32,3 ± 4,0 b,A | 16,3 ± 1,4 hari, B |
| NADES 6 | 26,7 ± 0,8 f,A | 30,5 ± 3,7 b,A | 16,0 ± 0,4 hari, B |
| NADES 7 | 41,6 ± 0,5 cd,A | 39,2 ± 1,9 b,A | 22,7 ± 1,5 c,B |
| NADES 8 | 44,5 ± 0,6 c,A | 38,5 ± 2,1 b,B | 24,9 ± 1,4 abc,C |
| NADES 9 | 49,3 ± 1,2 b,A | 39,8 ± 2,8 b,B | 28,4 ± 1,7 derajat Celcius |
| NADES 10 | 38,9 ± 0,9 dB | 32,0 ± 3,2 b,B | 21,8 ± 0,8 derajat Celcius |
| Etanol | 42,7 ± 0,9 c,A | 39,0 ± 2,3 b,A | 22,3 ± 1,4 c,B |
| Pengujian DPPH | |||
| NADES 1 | 25,5 ± 0,4 cd,A | 18,4 ± 0,9 def,B | 16,4 ± 1,3 b,B |
| NADES 2 | 21,8 ± 0,7 hari,A | 16,5 ± 1,3 ef,B | 15,5 ± 1,0 b,B |
| NADES 3 | 36,6 ± 0,9 μA | 23,0 ± 3,0 bcd, B | 10,4 ± 1,7 derajat Celcius |
| NADES 4 | 29,1 ± 0,6 SM,A | 24,0 ± 2,4 bcd, B | 10,2 ± 1,0c ,C |
| NADES 5 | 21,7 ± 1,5 hari,A | 12,5 ± 1,3 f,B | 6,9 ± 0,1 hari C |
| NADES 6 | 14,5 ± 1,3 e,A | 15,2 ± 1,6 ef,A | 7,1 ± 1,4 hari, B |
| NADES 7 | 28,2 ± 3,2 SM,A | 27,7 ± 4,5 b,A | 15,6 ± 0,3 b,B |
| NADES 8 | 30,8 ± 2,1 abc,A | 23,0 ± 0,8 bcd, B | 15,6 ± 0,5 b,C |
| NADES 9 | 32,5 ± 1,1 ab,A | 34,7 ± 1,4 μA | 20,7 ± 0,5 a,B |
| NADES 10 | 28,9 ± 2,7 SM,A | 25,5 ± 2,3 SM,A | 15,6 ± 0,6 b,B |
| Etanol | 20,3 ± 4,3 detik,A | 20,3 ± 0,7 cde,A | 8,8 ± 1,0 cd, B |
Hasilnya dinyatakan sebagai rata-rata ± simpangan baku. Huruf kecil yang berbeda dalam kolom dan huruf besar dalam baris menunjukkan perbedaan yang signifikan secara statistik ( P < 0,05).
Meskipun TPC dan TAC ekstrak bervariasi setelah pencernaan lambung, secara umum terdapat penurunan atau tidak ada perubahan signifikan dibandingkan dengan sampel yang tidak dicerna. Pencernaan intestinal lebih lanjut mengurangi TPC dan TAC ekstrak atau tidak menyebabkan perubahan signifikan. Nilai TPC dan TAC yang berkurang setelah pencernaan intestinal dapat dijelaskan oleh degradasi fenolik karena peningkatan pH dan aktivitas enzim. 33 TPC yang dapat diakses secara biologis berkisar antara 57% dan 79% untuk ekstrak NADES, yang lebih tinggi daripada nilai untuk ekstrak etanol (56%) (Gbr. 2 ). Sebuah studi sebelumnya dengan blueberry juga menunjukkan bahwa bioaksesibilitas intestinal senyawa fenolik secara signifikan lebih tinggi dalam ekstrak yang diperoleh menggunakan NADES dibandingkan dengan yang diperoleh menggunakan pelarut organik konvensional. 34 Demikian pula, untuk TAC, nilai bioaksesibilitas ekstrak NADES, kecuali untuk ChCl:gliserol (1:2 dan 1:3) dan ChCl:glukosa (2:1), lebih tinggi daripada ekstrak etanol (masing-masing 49–72% dan 43–52%) (Gbr. 2 ). Secara keseluruhan, ekstrak yang disiapkan dengan ChCl:asam laktat mengandung TPC dan TAC bioaksesibilitas tertinggi.
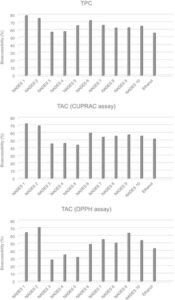
Dalam penelitian ini, dua metode pengukuran kapasitas antioksidan, pengujian CUPRAC dan DPPH, diterapkan. Nilai yang diperoleh dengan metode CUPRAC ditemukan lebih tinggi daripada yang diperoleh dengan metode DPPH. Perbedaan ini mungkin disebabkan oleh fakta bahwa pengujian CUPRAC dapat mengukur antioksidan hidrofilik dan lipofilik, sedangkan pengujian DPPH hanya cocok untuk antioksidan lipofilik. Menggunakan pengujian tunggal untuk menentukan TAC produk makanan tidak sepenuhnya dapat diandalkan. Oleh karena itu, melakukan beberapa pengujian TAC dengan mekanisme yang berbeda sangat penting untuk hasil yang lebih akurat dan dapat diandalkan, seperti yang ditunjukkan dalam penelitian ini menggunakan pengujian CUPRAC berbasis ET dan pengujian DPPH mode campuran. Selain itu, pengujian TPC menggunakan reagen Folin–Ciocalteu tidak spesifik untuk senyawa fenolik. Zat pereduksi seperti asam sitrat dan gula sederhana dapat mengganggu analisis, yang berpotensi menyebabkan perkiraan TPC yang terlalu tinggi. 35 Mengingat keterbatasan ini, kami melengkapi temuan ini dengan mengukur senyawa fenolik individual menggunakan UPLC–ESI-MS/MS.
Flavonoid
Analisis UPLC–ESI-MS/MS dari ekstrak WSW menghasilkan identifikasi enam flavonoid primer (Tabel 3 ). Identifikasi mereka melibatkan analisis MS dan pola fragmentasi dan membandingkannya dengan literatur yang ada. 2 , 36 – 39 Lima flavonoid yang terdeteksi adalah turunan quercetin: isoquercitrin, taxifolin, quercitrin, quercetin dan isorhamnetin. Flavonoid yang tersisa adalah flavanol, yaitu katekin, yang terdeteksi hanya dalam ekstrak etanol dan dalam ekstrak NADES yang dibuat dengan gliserol dan glukosa (Tabel 4 ), menunjukkan bahwa NADES selektif dalam mengekstraksi flavonoid tertentu. Dalam ekstrak NADES yang dibuat dengan asam laktat, gliserol dan glukosa, quercitrin diidentifikasi sebagai senyawa yang paling melimpah, yang membentuk 43–61% dari total flavonoid. Di sisi lain, taksifolin adalah flavonoid dominan dalam ekstrak NADES yang dibuat dengan asam sitrat dan asam malat, meliputi 41–53% dari total flavonoid, dan ekstrak ini juga mengandung kadar taksifolin, quercetin, dan isorhamnetin yang jauh lebih tinggi dibandingkan dengan ekstrak etanol ( P < 0,05). NADES berbasis asam karboksilat dilaporkan lebih polar daripada NADES berbasis gula dan polialkohol, 7 yang dapat menjelaskan tingkat pemulihan flavonoid yang lebih tinggi. Namun, secara keseluruhan, kandungan flavonoid total tertinggi diamati dalam ekstrak etanol dan ChCl:gliserol (1:3), sedangkan ekstrak ChCl:asam malat (1:1 dan 1:2) dan ChCl:asam sitrat (1:2) memiliki kandungan flavonoid terendah. Rasio molar ChCl terhadap HBD yang berkurang dalam NADES tidak memiliki efek signifikan pada pemulihan flavonoid ( P > 0,05), kecuali saat menggunakan gliserol.
| Waktu retensi (menit) | Massa ( m / z ) | Ion fragmental lainnya ( m / z ) | Identifikasi sementara | Ref. |
|---|---|---|---|---|
| Flavonoid | ||||
| 2.16 | (−) 289,1 | 205.1 , 145.1 | Katekin | 36 – 38 |
| 3.45 | (−) 463.1 | 300,0 , 271,0 | Isoquercitrin (quercetin 3- O -glukosida) | 38 |
| 3.87 | (−) 303.1 | 285.1 , 125.0 | Taksifolin (dihidroquercetin) | 37 , 38 tahun |
| 4.05 | (−) 447.1 | 300,0 , 271,0 | Quercitrin (quercetin 3- O -rhamnoside) | 2 , 38 tahun |
| 5.95 | (−) 301,0 | 179.0, 151.2 | Kuersetin | 37 |
| 7.35 | (−) 314,9 | 299,9 , 151,2 | Isorhamnetin (3- O- metilquercetin) | 39 |
| Asam fenolik dan aldehida | ||||
| 1,99 | (−) 152,9 | 109,0 , 90,9 | Asam protocatechuic | 2 |
| 2.60 | (−) 137,0 | 93,0 , 75,1, 65,1 | p -asam salisilat | 37 , 38 tahun |
| 3.40 | (−) 301,0 | 300,0, 284,0 | Asam ellagic | 2 , 37 , 38 |
| 3.55 | (−) 151,0 | 136.1 , 92.1 | Panili | 36 – 38 |
| jam 4.45 | (−) 206,9 | 192.1 , 177.1 tahun | Sinapaldehida | – |
Fragmen utama ditunjukkan dengan huruf tebal.
| Pelarut | Tidak tercerna | Pencernaan lambung | Pencernaan usus |
|---|---|---|---|
| Katekin (μg kg −1 ) | |||
| NADES 1 | <KECERDASAN | 472,4 ± 1,7 hari, B | 581,9 ± 25,0 c,A |
| NADES 2 | <KECERDASAN | 921,6 ± 18,1 hari, B | 1093,0 ± 22,9 b,A |
| NADES 3 | 4667,3 ± 432,2 c,A | 4120,0 ± 23,8 b,A | 552,0 ± 23,5 derajat Fahrenheit |
| NADES 4 | 5710,2 ± 155,5 b,A | 4524,0 ± 244,0 b,B | 532,5 ± 31,9 derajat Celcius |
| NADES 5 | 2698,9 ± 34,6 hari,A | 2098,2 ± 113,3 c,B | 1051,6 ± 22,9 b,C |
| NADES 6 | 2445,5 ± 37,2 hari,A | 2371,6 ± 2,7 c,A | 1124,6 ± 18,0 b,B |
| NADES 7 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 8 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 9 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 10 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| Etanol | 12 338,7 ± 113,5 a,A | 5529,3 ± 342,2 a,B | 2143,4 ± 108,2 °C |
| Isoquercitrin (μg kg −1 ) | |||
| NADES 1 | 427,9 ± 28,6 cd,A | 364,3 ± 9,9 c,A | 234,2 ± 29,2 ef,B |
| NADES 2 | 460,6 ± 15,1 c,A | 348,9 ± 2,9 c,B | 284,3 ± 15,1 hari,C |
| NADES 3 | 575,8 ± 31,3 b,B | 475,4 ± 3,7 °C | 676,8 ± 1,7 μA |
| NADES 4 | 675,1 ± 3,8 μA | 400,4 ± 6,2 SM,C | 558,9 ± 3,0 b,B |
| NADES 5 | 481,1 ± 3,2 c,A | 242,6 ± 20,3 hari,C | 337,3 ± 5,6 c,B |
| NADES 6 | 468,4 ± 14,8 c,A | 377,0 ± 23,4 c,B | 308,2 ± 2,7 cd,C |
| NADES 7 | 219,8 ± 8,2 e,A | 193,1 ± 18,1 detik,A | 175,1 ± 15,3 gram, Satuan |
| NADES 8 | 244,1 ± 25,1 e,A | 194,0 ± 4,7 detik,A | 182,5 ± 6,1 gram, Satuan |
| NADES 9 | 132,1 ± 29,2 f,A | 157,6 ± 26,3 e,A | 112,1 ± 6,3 jam,A |
| NADES 10 | 233,5 ± 24,3 e,A | 204,7 ± 11,3 detik,A | 200,2 ± 12,5 fg, Satuan |
| Etanol | 351,2 ± 11,9 hari, B | 436,1 ± 10,1 ab,A | 268,8 ± 5,2 derajat Celcius |
| Taksifolin (μg kg −1 ) | |||
| NADES 1 | 1937,6 ± 84,2 cd,A | 1699,6 ± 27,5 b,A | 1402,8 ± 206,0 b,A |
| NADES 2 | 1926,2 ± 1,1 cd,A | 1652,0 ± 70,5 b,AB | 1402,4 ± 144,2 b,B |
| NADES 3 | 1929,8 ± 4,8 cd,A | 1572,4 ± 123,0 b,B | 899,7 ± 10,3 derajat Celcius |
| NADES 4 | 2716,9 ± 284,0 SM,A | 1523,1 ± 145,5 SM,B | 892,7 ± 12,5 c,B |
| NADES 5 | 1549,1 ± 22,3 hari,A | 866,7 ± 22,8 cd,B | 622,7 ± 5,5 derajat Celcius |
| NADES 6 | 1519,2 ± 34,9 hari,A | 1314,1 ± 148,6 bcd,A | 652,7 ± 24,4 c,B |
| NADES 7 | 3377,4 ± 239,1 ab,A | 2877,4 ± 204,3 sEBUAH | 1981,6 ± 184,5 a,B |
| NADES 8 | 3471,4 ± 29,0 ab,A | 2731,2 ± 359,8 a,AB | 1892,5 ± 142,8 a,B |
| NADES 9 | 3835,0 ± 225,7 a,A | 2970,7 ± 257,4 a,B | 1966,8 ± 47,8 derajat Celcius |
| NADES 10 | 2512,1 ± 520,6 c,A | 1942,5 ± 99,5 b,A | 1824,7 ± 159,6 ab,A |
| Etanol | 1350,3 ± 40,4 hari,A | 776,5 ± 15,4 hari, B | 492,3 ± 16,8 derajat Celcius |
| Kuersitrin (μg kg −1 ) | |||
| NADES 1 | 4444,9 ± 329,0 cd,A | 4342,4 ± 333,8 SM,A | 2510,6 ± 256,3 SM,B |
| NADES 2 | 4508,4 ± 307,9 cd,A | 4282,8 ± 131,6 SM,A | 3177,9 ± 200,6 b,B |
| NADES 3 | 5425,2 ± 79,0 b,A | 4844,7 ± 141,8 ab,A | 4475,0 ± 432,1 a,A |
| NADES 4 | 8221,3 ± 84,9 a,A | 5297,4 ± 296,4 a,B | 4398,3 ± 521,9 a,B |
| NADES 5 | 4650,8 ± 430,9 SM,A | 2685,8 ± 177,1 hari, B | 2088,6 ± 230,8 c,B |
| NADES 6 | 3744,2 ± 54,0 hari, Satuan | 3646,4 ± 145,2 c,A | 1977,8 ± 68,8 derajat Fahrenheit |
| NADES 7 | 1529,6 ± 67,5 ef,A | 1756,8 ± 47,3 ef,A | 1528,4 ± 173,3 cd,A |
| NADES 8 | 2134,8 ± 4,6 e,A | 1917,2 ± 27,2 deviasi,AB | 1646,7 ± 163,8 cd,B |
| NADES 9 | 1082,3 ± 139,0 f,A | 1120,5 ± 58,1 f,A | 742,2 ± 48,4 hari,A |
| NADES 10 | 1891,4 ± 46,5 e,A | 1645,7 ± 297,8 f,A | 1657,5 ± 34,4 cd,A |
| Etanol | 4286,0 ± 144,0 cd,A | 2587,2 ± 388,3 de,B | 2014.9 ± 191.0c ,B |
| Kuersetin (μg kg −1 ) | |||
| NADES 1 | 564,6 ± 4,1 c,B | 655,5 ± 1,3 hari,A | 95,5 ± 0,1 hari C |
| NADES 2 | 546,4 ± 41,8 c,A | 635,8 ± 28,0 hari, Satuan | 93,7 ± 0,8 hari, B |
| NADES 3 | 69,0 ± 0,2 hari,A | 64,0 ± 3,9 e,A | <KECERDASAN |
| NADES 4 | 85,4 ± 2,2 hari,A | 73,2 ± 0,6 e,B | <KECERDASAN |
| NADES 5 | 45,9 ± 0,03 hari,A | 32,4 ± 2,3 e,B | <KECERDASAN |
| NADES 6 | 57,2 ± 3,4 hari,A | 53,5 ± 4,1 e,A | <KECERDASAN |
| NADES 7 | 1598,7 ± 192,3 b,A | 1745,4 ± 187,3 ab,A | 279,3 ± 27,0 ab,B |
| NADES 8 | 1533,0 ± 149,3 b,A | 1488,5 ± 46,3 b,A | 193,1 ± 9,6 c,B |
| NADES 9 | 2135,8 ± 86,4 sEBUAH | 1866,4 ± 6,9 a,B | 338,3 ± 26,4 °C |
| NADES 10 | 1469,9 ± 171,7 b,A | 1117,1 ± 152,8 c,A | 268,6 ± 31,5 b,B |
| Etanol | 52,5 ± 8,9 hari,A | 29,9 ± 3,0 e,A | <KECERDASAN |
| Isorhamnetin (μg kg −1 ) | |||
| NADES 1 | 4,3 ± 0,1 c,A | 3,4 ± 0,4 c,A | 0,5 ± 0,02 SM, B |
| NADES 2 | 4,6 ± 0,3 c,A | 2,5 ± 0,1 cd, B | 0,2 ± 0,01c ,C |
| NADES 3 | 3,5 ± 0,1 c,A | 1,2 ± 0,2 cd, B | 0,2 ± 0,03 c,C |
| NADES 4 | 4,6 ± 0,1 c,A | 2,1 ± 0,2 cd, B | 0,2 ± 0,02 c,C |
| NADES 5 | 1,7 ± 0,01 c,A | 0,5 ± 0,2 hari, B | <KECERDASAN |
| NADES 6 | 1,7 ± 0,2 c,A | 0,5 ± 0,2 hari, B | <KECERDASAN |
| NADES 7 | 14,4 ± 2,2 ab,A | 13,7 ± 0,2 μA | 0,9 ± 0,03 ab,B |
| NADES 8 | 12,6 ± 3,0 b,A | 9,5 ± 0,1 b,A | 1,5 ± 0,1 a, B |
| NADES 9 | 17,9 ± 2,1 a,A | 13,7 ± 1,6 μA | 1,5 ± 0,5 a, B |
| NADES 10 | 9,7 ± 0,1 b,A | 7,4 ± 0,6 b,B | 1,4 ± 0,1 °C |
| Etanol | 3,7 ± 0,4 c,A | 1,3 ± 0,2 cd, B | 0,2 ± 0,01 c, B |
| ΣFlavonoid (μg kg −1 ) | |||
| NADES 1 | 7379,5 ± 388,6 detik,A | 7537,6 ± 319,6 cde,A | 4825,6 ± 104,7 b,B |
| NADES 2 | 7446.2 ± 364.1 detik,A | 7843,6 ± 12,1 c,A | 6051,6 ± 337,9 a,B |
| NADES 3 | 12.670,7 ± 546,9 b,A | 11.077,7 ± 296,1 a,A | 6603,7 ± 467,6 a,B |
| NADES 4 | 17 413,5 ± 207,3 a,A | 11 820,2 ± 678,9 a,B | 6382,5 ± 544,3 derajat Celcius |
| NADES 5 | 9427,5 ± 377,3 c,A | 5926,1 ± 59,2 fg, B | 4100,2 ± 219,0 SM,C |
| NADES 6 | 8236,1 ± 67,9 cd,A | 7763,0 ± 13,3 cd,B | 4063,3 ± 29,1 SM,C |
| NADES 7 | 6740,0 ± 374,3 ef,A | 6586,3 ± 46,2 cdef,A | 3965,3 ± 31,1 SM,B |
| NADES 8 | 7396.0 ± 93.6 detik,A | 6340,3 ± 374,1 defg, B | 3916,3 ± 17,4 SM,C |
| NADES 9 | 7203.1 ± 145.8 derajat,A | 6129,0 ± 220,3 gram, B | 3160,9 ± 128,4c ,C |
| NADES 10 | 6116,5 ± 326,5 f,A | 4917,4 ± 362,9 gram, AB | 3952,3 ± 106,1 SM,B |
| Etanol | 18 382,3 ± 7,4 a,A | 9360,2 ± 701,8 b,B | 4919,6 ± 287,7 b,C |
Hasilnya dinyatakan sebagai rata-rata ± simpangan baku. Huruf kecil yang berbeda dalam kolom dan huruf besar dalam baris menunjukkan perbedaan yang signifikan secara statistik ( P < 0,05). LOQ: batas kuantifikasi.
Konsisten dengan hasil uji spektrofotometri, pencernaan lambung tidak menyebabkan perubahan signifikan atau mengurangi total kandungan flavonoid dibandingkan dengan sampel yang tidak tercerna. Setelah pencernaan intestinal, semua ekstrak mengandung kadar flavonoid yang jauh lebih rendah dibandingkan dengan sampel yang tidak tercerna (19–73%) ( P < 0,05). Demikian pula, penelitian sebelumnya pada kulit jeruk 40 dan produk sampingan bayam 41 juga melaporkan penurunan signifikan pada kadar flavonoid setelah pencernaan intestinal. Pengamatan ini dapat dikaitkan dengan degradasi flavonoid menjadi senyawa fenolik yang lebih kecil karena aktivitas enzim dan peningkatan pH. Flavonoid yang dapat diakses secara biologis berkisar antara 37% dan 81% untuk ekstrak NADES, yang lebih tinggi daripada nilai untuk ekstrak etanol (27%) (Gbr. 3 ). Sesuai dengan hasil uji spektrofotometri, ekstrak yang disiapkan dengan ChCl:asam laktat mengandung kadar flavonoid yang dapat diakses secara biologis tertinggi.
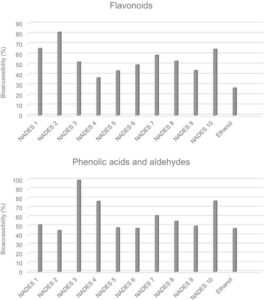
Asam fenolik dan aldehida
Lima asam fenolik dan aldehida primer, yaitu asam protokatekukat, asam p- salisilat, asam ellagik, vanilin dan sinapaldehida, diidentifikasi dalam ekstrak WSW menggunakan UPLC–ESI-MS/MS (Tabel 3 ). Asam ellagik diidentifikasi sebagai senyawa dominan dalam semua ekstrak, yang merupakan 60–96% dari total asam fenolik dan aldehida, sedangkan asam protokatekukat dan p- salisilat hanya terdeteksi dalam ekstrak ChCl:gliserol dan etanol (Tabel 5 ). Ekstrak ChCl:gliserol (1:3) mengandung kadar total asam fenolik dan aldehida tertinggi, yang juga secara signifikan lebih tinggi daripada yang ada dalam ekstrak etanol ( P < 0,05). Sebuah studi sebelumnya pada limbah kulit kastanye juga melaporkan bahwa NADES berbasis poliol mengekstraksi kadar asam ellagik yang lebih tinggi dibandingkan dengan pelarut organik. 13 Mirip dengan hasil yang diperoleh untuk flavonoid, rasio molar ChCl terhadap HBD yang dikurangi dalam NADES tidak memberikan efek signifikan terhadap pemulihan asam fenolik dan aldehida untuk sebagian besar ekstrak.
| Pelarut | Tidak tercerna | Pencernaan lambung | Pencernaan usus |
|---|---|---|---|
| Asam protocatechuic (μg kg −1 ) | |||
| NADES 1 | <KECERDASAN | 41,0 ± 0,3 c,B | 85,5 ± 3,7 c,A |
| NADES 2 | <KECERDASAN | 52,8 ± 1,7 SM,B | 93,6 ± 3,5 c,A |
| NADES 3 | 177,4 ± 22,8 b,A | 175,7 ± 17,9 tahun ,A | 223,4 ± 40,5 b,A |
| NADES 4 | 174,7 ± 3,4 b,B | 168,5 ± 11,8 a,B | 281,8 ± 14,5 sA |
| NADES 5 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 6 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 7 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 8 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 9 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 10 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| Etanol | 223,5 ± 14,9 sA | 76,7 ± 0,8 b,B | 57,0 ± 0,6 c,B |
| p -Asam salisilat (μg kg −1 ) | |||
| NADES 1 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 2 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 3 | 952,5 ± 31,8 b,A | 628,4 ± 25,1 b,C | 749,8 ± 13,3 b,B |
| NADES 4 | 781,0 ± 21,8 c,A | 519,1 ± 26,7 c,B | 852,1 ± 5,3 a,A |
| NADES 5 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 6 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 7 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 8 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 9 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 10 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| Etanol | 1498,7 ± 10,2 sA | 842,3 ± 31,4 a,B | 658,6 ± 72,6 c,B |
| Asam ellagic (μg kg −1 ) | |||
| NADES 1 | 9652,6 ± 137,3 bcde,A | 8290.1 ± 132.4 SM,B | 4685,2 ± 327,6 derajat Celsius |
| NADES 2 | 11.006,5 ± 992,3 abc,A | 8274,7 ± 127,3 SM,B | 4669,1 ± 214,4 derajat Celsius |
| NADES 3 | 8681,6 ± 318,1 bcde, AB | 7420,4 ± 453,4 bcd, B | 9417,1 ± 331,5 a,A |
| NADES 4 | 13 536,5 ± 1508,2 a,A | 9342,5 ± 336,5 ab,B | 10 102,1 ± 130,6 a,AB |
| NADES 5 | 8375,8 ± 413,4 cde,A | 4496,8 ± 345,1 e,B | 4315,9 ± 379,5 ef,B |
| NADES 6 | 7281.1 ± 329.6 detik,A | 7366,2 ± 137,0 bcd,A | 3437,6 ± 543,8 f,B |
| NADES 7 | 11 202,2 ± 1456,1 abc,A | 9293,6 ± 163,1 ab,AB | 7162,3 ± 51,8 b,B |
| NADES 8 | 10 820,0 ± 614,0 abcd,A | 8408,7 ± 463,6 SM,B | 6094,3 ± 266,5 SM,C |
| NADES 9 | 12.084,5 ± 1.737,1 ab,A | 11 523,1 ± 1978,6 tahun,AB | 5651,0 ± 61,9 cd,B |
| NADES 10 | 8400,3 ± 91,9 cde,A | 6600.2 ± 32.1 cde,B | 6397,0 ± 35,4 SM,B |
| Etanol | 7175,0 ± 43,4 e,A | 5667,0 ± 86,3 de,B | 3960,3 ± 145,3 derajat Celcius |
| Vanili (μg kg −1 ) | |||
| NADES 1 | 1405,3 ± 151,1 SM,A | 805,4 ± 2,9 SM,B | 820,8 ± 13,2 b,B |
| NADES 2 | 1224,2 ± 161,5 c,A | 624,4 ± 10,6 cd,B | 718,6 ± 25,1 cd,B |
| NADES 3 | 1732,6 ± 124,3 b,A | 1366,4 ± 13,0 a,B | 1310,0 ± 12,8 a,B |
| NADES 4 | 1681,2 ± 29,8 b,A | 1177,9 ± 217,7 ab,A | 1305,7 ± 9,2 sA |
| NADES 5 | 668,2 ± 34,6 hari | <KECERDASAN | <KECERDASAN |
| NADES 6 | <KECERDASAN | <KECERDASAN | <KECERDASAN |
| NADES 7 | 1654,9 ± 145,2 b,A | 1114,2 ± 124,8 ab,B | 726,0 ± 3,9 cd,B |
| NADES 8 | 1559,5 ± 108,5 SM,A | 852,3 ± 42,4 SM,B | 735,8 ± 1,8 c,B |
| NADES 9 | 479,3 ± 107,4 hari,A | 459,2 ± 21,9 cd,A | 511,8 ± 12,3 e,A |
| NADES 10 | 288,5 ± 72,0 hari,A | 319,8 ± 24,3 hari,A | 333,9 ± 26,9 f,A |
| Etanol | 2217,0 ± 86,6 a,A | 1509,3 ± 299,2 a,A | 678,3 ± 10,1 hari, B |
| Sinapaldehida (μg kg −1 ) | |||
| NADES 1 | 426,8 ± 3,6 c,A | 352,5 ± 33,0 detik,A | 266,5 ± 1,2 c,B |
| NADES 2 | 355,0 ± 51,7 cd,A | 238,1 ± 15,6 fg, panjang gelombang | 160,2 ± 19,6 e,B |
| NADES 3 | 736,9 ± 6,5 μA | 544,6 ± 0,5 b,B | 493,7 ± 2,5 °C |
| NADES 4 | 737,3 ± 12,4 a,A | 440,4 ± 0,1 c,B | 392,4 ± 19,5 b,B |
| NADES 5 | 295,7 ± 19,0 detik,A | 158,9 ± 12,4 gh, B | 136,6 ± 1,9 e,B |
| NADES 6 | 319,5 ± 14,3 detik,A | 256,0 ± 20,0 f,B | 142,0 ± 8,0 derajat Celcius |
| NADES 7 | 576,4 ± 6,1 b,A | 418,7 ± 24,2 cd,B | 275,4 ± 4,5 derajat Celcius |
| NADES 8 | 410,4 ± 12,8 c,A | 288,2 ± 2,8 ef,B | 175,2 ± 26,6 derajat Celcius |
| NADES 9 | 356,5 ± 8,4 cd,A | 232,6 ± 31,5 fgh, B | 246,3 ± 26,4 cd,B |
| NADES 10 | 253,9 ± 43,2 e,A | 152,9 ± 7,6 jam, AB | 132,4 ± 4,4 e,B |
| Etanol | 789,2 ± 12,8 a,B | 1504,6 ± 30,7 sA | 236,6 ± 36,2 cd,C |
| ΣAsam fenolik dan aldehida (μg kg −1 ) | |||
| NADES 1 | 11.484,8 ± 17,4 bcd,A | 9489,1 ± 96,8 bcd, B | 5858,2 ± 316,9 derajat Celsius |
| NADES 2 | 12.585,7 ± 1205,5 bcd,A | 9189,9 ± 130,7 bcd, B | 5641,5 ± 262,7 derajat Celcius |
| NADES 3 | 12 281,0 ± 255,0 bcd,A | 10 135,5 ± 396,8 abc,B | 12 193,9 ± 343,4 a,A |
| NADES 4 | 16 910,8 ± 1465,6 a,A | 11.648,5 ± 539,4 ab,B | 12 934,1 ± 131,7 a,B |
| NADES 5 | 9339,7 ± 429,0 cde,A | 4655,7 ± 357,5 e,B | 4452,5 ± 377,6 f,B |
| NADES 6 | 7600,6 ± 343,9 e,A | 7622,1 ± 157,0 cd,A | 3579,6 ± 551,9 f,B. |
| NADES 7 | 13.433,6 ± 1595,2 ab,A | 10 826,5 ± 312,1 ab,AB | 8163,7 ± 51,3 b,B |
| NADES 8 | 12 789,8 ± 735,3 SM,A | 9549,2 ± 424,0 abcd,B | 7005,3 ± 295,0c ,C |
| NADES 9 | 12 920,2 ± 1638,0 SM,A | 12 214,9 ± 1969,0 a,AB | 6409.1 ± 47.8 cde,C |
| NADES 10 | 8942,7 ± 120,7 detik,A | 7072,9 ± 0,2 de,B | 6863,3 ± 4,2 cd,B |
| Etanol | 11 903,4 ± 5,2 bcd,A | 9599,8 ± 446,8 abcd,B | 5590,9 ± 244,5 derajat Celcius |
Hasilnya dinyatakan sebagai rata-rata ± simpangan baku. Huruf kecil yang berbeda dalam kolom dan huruf besar dalam baris menunjukkan perbedaan yang signifikan secara statistik ( P < 0,05). LOQ: batas kuantifikasi.
Kromatogram representatif dari NADES dan ekstrak etanol disediakan dalam informasi pendukung (Gbr. S2 ), yang mengilustrasikan perbedaan dalam profil senyawa fenolik di antara berbagai sistem pelarut. Kromatogram mengonfirmasi kemampuan ekstraksi selektif NADES berbasis ChCl, khususnya dalam meningkatkan pemulihan flavonoid dan asam fenolik. Dibandingkan dengan ekstrak etanol, NADES dengan donor polialkohol dan asam organik menunjukkan sinyal yang lebih kuat untuk quercitrin, taksifolin, dan asam ellagik, yang menyoroti efisiensi superior mereka dalam mengekstraksi senyawa ini.
Sejalan dengan temuan untuk flavonoid dan uji spektrofotometri, pencernaan lambung tidak memiliki efek signifikan atau mengurangi total kadar asam fenolik dan aldehida dibandingkan dengan sampel yang tidak tercerna. Setelah pencernaan usus, semua ekstrak, kecuali ChCl:gliserol (1:2), menunjukkan kadar asam fenolik dan aldehida yang secara signifikan lebih rendah dibandingkan dengan sampel yang tidak tercerna (23–55%) ( P < 0,05). Tercatat bahwa bioaksesibilitas asam fenolik dan aldehida lebih tinggi di semua ekstrak NADES (47–99%), kecuali yang mengandung asam laktat (45%), dibandingkan dengan ekstrak etanol (47%) (Gbr. 3 ). Berbeda dengan hasil untuk flavonoid dan uji spektrofotometri, ekstrak dengan kadar asam fenolik dan aldehida bioaksesibilitas tertinggi ditetapkan sebagai ChCl:gliserol (1:2).
KESIMPULAN
Studi ini menunjukkan efektivitas ekstraksi berbantuan ultrasonik yang dikombinasikan dengan NADES berbasis ChCl untuk memulihkan senyawa fenolik dari WSW. Di antara sepuluh NADES yang diuji, ChCl:asam laktat (1:2) menghasilkan TPC bioaksesibel tertinggi (79%), TAC (72%) dan flavonoid (81%), sementara ChCl:gliserol (1:2) memberikan pemulihan asam fenolik dan aldehida yang unggul (99%). Temuan ini mengonfirmasi potensi komposisi NADES tertentu untuk meningkatkan ekstraksi dan bioaksesibilitas senyawa fenolik yang beragam secara struktural. Lebih jauh, hasil bioaksesibilitas menyoroti relevansi penggunaan NADES tidak hanya untuk ekstraksi yang efisien tetapi juga untuk meningkatkan fungsionalitas nutrisi ekstrak dalam aplikasi makanan atau nutraseutika yang potensial. Studi ini juga menyoroti pentingnya pemilihan komponen NADES yang cermat, rasio molar dan peran kadar air dalam mengoptimalkan sifat pelarut. Penelitian di masa mendatang harus difokuskan pada optimalisasi parameter ekstraksi untuk masing-masing sistem NADES, penilaian sitotoksisitas dan keamanannya untuk penggunaan pangan, serta evaluasi stabilitas dan fungsionalitasnya saat dimasukkan ke dalam matriks pangan nyata. Secara keseluruhan, pendekatan ini menawarkan strategi berkelanjutan untuk peningkatan nilai produk sampingan agroindustri menggunakan prinsip kimia hijau.



