ABSTRAK
Deteksi patogen yang akurat sangat penting dalam manajemen kesehatan ikan dan pencegahan penyakit. Patogen sering menargetkan jaringan inang yang berbeda, dan pemantauan organ target alternatif dapat memberikan wawasan penting ke dalam perkembangan penyakit. Kami mengevaluasi limpa sebagai alternatif ginjal untuk memperkirakan beban dan prevalensi parasit myxozoa Tetracapsuloides bryosalmonae ( Tb ) dan hubungannya dengan penyakit ginjal proliferatif (PKD) pada ikan trout coklat muda. Kami mengambil sampel 238 ikan trout coklat di sembilan sungai dan mengukur beban parasit di kedua jaringan menggunakan qPCR. Beban parasit menunjukkan korelasi positif yang kuat antara kedua jaringan untuk data mentah dan data yang ditransformasikan log10 (Pearson’s r = 0,60–0,71, Spearman’s ρ = 0,78), dengan limpa menunjukkan, rata-rata, beban parasit 4,1 kali lipat lebih rendah dibandingkan dengan ginjal. Tb ditemukan pada 191 spesimen, yang terdiri dari 167 deteksi limpa dan 190 deteksi ginjal. Hubungan antara jumlah parasit dan gejala PKD (hiperplasia ginjal dan anemia) sebanding untuk kedua jaringan, dan analisis garis regresi tersegmentasi menunjukkan bahwa parameter kesehatan memburuk lebih cepat setelah melampaui ambang batas jumlah parasit tertentu. Sebagai kesimpulan, hasil ini menunjukkan bahwa limpa dapat berfungsi sebagai alternatif yang layak untuk ginjal untuk pemantauan Tb , memberikan wawasan yang berguna tentang keberadaan Tb , jumlah parasit, dan perkembangan PKD pada salmonid.
1 Pendahuluan
Myxozoa adalah endoparasit mikroskopis yang terdistribusi secara global dengan siklus hidup kompleks yang berganti-ganti antara inang invertebrata (seperti annelida dan bryozoa) dan vertebrata, terutama ikan, di lingkungan laut dan air tawar (Alexander et al. 2015 ; Alama-Bermejo dan Holzer 2021 ). Spesies myxozoa tertentu, termasuk Myxobolus cerebralis , Ceratonova shasta dan Tetracapsuloides bryosalmonae , terkenal menyebabkan penyakit parah pada ikan, seperti penyakit berputar, ceratomyxosis dan penyakit ginjal proliferatif (Fontes et al. 2015 ). Penyakit-penyakit ini dapat mengakibatkan tingkat morbiditas dan mortalitas yang tinggi, yang secara parah mempengaruhi operasi akuakultur dan populasi ikan liar (Hedrick et al. 1993 ; Turner et al. 2014 ; Bartholomew et al. 2022 ).
Malacosporean Tetracapsuloides bryosalmonae ( Tb ), agen penyebab penyakit ginjal proliferatif (PKD) pada salmonid, tersebar luas di seluruh belahan bumi utara (Peribáñez et al. 1997 ; Mo and Jørgensen 2017 ; Gorgoglione et al. 2020 ; Svavarsdóttir et al. 2021 ). PKD menimbulkan tantangan yang signifikan bagi populasi salmonid liar dan budidaya (Ros et al. 2022 ). Parasit ini berpindah-pindah antara bryozoa air tawar, inang invertebrata utamanya, dan ikan salmonid, inang vertebrata-nya (Canning et al. 2000 ). Kelimpahan stadium Tb yang infektif bagi ikan terkait erat dengan meningkatnya suhu air, karena peningkatan suhu mendorong biomassa bryozoa dan meningkatkan konsentrasi spora parasit infektif di lingkungan (Tops et al. 2009 ; Hartikainen et al. 2009 ). Suhu yang lebih tinggi juga mendorong manifestasi klinis PKD, terutama yang mempengaruhi salmonid muda-tahunan (YOY) selama musim pertumbuhan pertama mereka (Okamura et al. 2011 ). Ikan menjadi terinfeksi ketika spora Tb menembus kulit atau insang (Longshaw et al. 2002 ). Begitu berada di dalam sistem vaskular, stadium ekstrasporogoni parasit berkembang biak dan menyebar ke jaringan limfoid dan hematopoietik, menyebabkan proliferasi dan modulasi imun (Chilmonczyk et al. 2002 ; Bettge et al. 2009 ). Tahapan ekstrasporogoni terus berkembang terutama di ginjal dan limpa, meskipun mereka juga dapat ditemukan di berbagai jaringan dan organ lain di seluruh inang (Feist dan Longshaw 2006 ). Gejala klinis, termasuk insang pucat dan anemia, pembengkakan perut, proliferasi ginjal dan anemia, biasanya muncul dalam 4-8 minggu setelah infeksi, terutama jika suhu air melebihi 15 ° C (Clifton-Hadley et al. 1986 ). Setelah proliferasi di interstitium ginjal, beberapa tahapan parasit ekstrasporogoni bermigrasi ke tubulus ginjal, di mana mereka bertahan bahkan setelah PKD klinis sembuh (Morris et al. 2000 ). Selama PKD klinis, tahapan parasit menginduksi peradangan dan proliferasi jaringan limpa yang mirip dengan ginjal, yang berfungsi sebagai tempat utama proliferasi parasit dan pelepasan spora (Hedrick et al. 1993 ; Canning et al. 2002 ). Setelah sporogenesis selesai, spora matang dikeluarkan melalui urin (Hedrick et al. 2004 ). Spora ini kemudian menginfeksi bryozoa, melengkapi siklus hidup parasit (Morris dan Adams 2007 ).
Limpa memainkan peran kunci dalam fungsi sistem imun ikan, khususnya dalam memproses dan merespons patogen (Zapata 2024 ). Limpa bertindak sebagai organ limfoid sekunder tempat limfosit diaktifkan dan merespons infeksi. Selain perannya dalam menyaring antigen, limpa terlibat dalam produksi sel imun dan antibodi (Sayed et al. 2022 ). Selama PKD klinis, baik ginjal maupun limpa dipengaruhi oleh parasit, dengan perubahan patofisiologis seperti pembesaran ginjal dan splenomegali yang semakin menyoroti peran aktif sistem imun dalam memerangi infeksi (Kotob et al. 2017 ).
Deteksi dan kuantifikasi akurat Tb pada salmonid yang terinfeksi sangat penting untuk memahami dinamika dan perkembangan penyakit. Sampai saat ini, kuantifikasi Tb telah dilakukan menggunakan PCR kuantitatif real-time (qPCR) dari ekstrak DNA dari ginjal salmonid (misalnya, Bettge et al. 2009 ; Grabner dan El-Matbouli 2009 ). Meskipun Tb juga diketahui berkembang biak di limpa (Canning et al. 2002 ), sampai saat ini, belum ada penelitian yang membandingkan beban parasit dalam jaringan limpa dalam kaitannya dengan ginjal. Namun, dibandingkan dengan jaringan ginjal, membedah limpa dapat memberikan beberapa keuntungan potensial. Misalnya, karena lokasinya jauh di dalam rongga tubuh ikan, pengambilan sampel jaringan ginjal dapat memakan waktu dan sulit. Ini terutama relevan untuk kasus PKD asimtomatik pada spesimen salmonid kecil (< 50 mm). Sebaliknya, limpa lebih mudah ditemukan, karena terletak di dalam lapisan serosa usus, dan warnanya yang khas serta struktur jaringan padatnya, berbeda dengan ginjal, membuatnya lebih mudah dibedah. Selain itu, distribusi Tb di dalam ginjal dapat berbeda di berbagai bagian organ yang memanjang ini selama infeksi subklinis (Lauringson et al. 2023 ), yang menambah kerumitan lebih lanjut dalam pengambilan sampel ginjal.
Dalam penelitian ini, kami mengkaji potensi limpa sebagai jaringan inang alternatif untuk mengevaluasi beban dan prevalensi parasit myxozoa Tb dan hubungannya dengan penyakit ginjal proliferatif pada ikan trout coklat ( Salmo trutta ) juvenil. Tujuan khusus kami adalah: (i) mengevaluasi prevalensi Tb dalam dua jaringan di beberapa populasi ikan trout coklat dan memeriksa korelasi antara estimasi beban parasit dalam jaringan limpa dan ginjal; (ii) mengkarakterisasi hubungan antara beban Tb dalam dua jaringan dan gejala utama PKD, yaitu hiperplasia ginjal dan anemia; (iii) menyelidiki kesesuaian limpa sebagai jaringan diagnostik alternatif untuk memperkirakan beban dan prevalensi Tb , dan mengevaluasi relevansinya dalam membandingkan beban parasit dan gejala PKD.
2 Bahan dan Metode
2.1 Pengumpulan Sampel dan Pengukuran Ciri Penyakit
Ikan trout coklat liar muda (YOY) ( n = 238) dikumpulkan dari 24 Agustus hingga 2 September 2022 dari sembilan sungai di Estonia (Gambar 1 , Tabel 1 ) menggunakan peralatan elektrofishing standar (izin penangkapan ikan eksperimental no. 10–1/22/42–2 yang dikeluarkan oleh Kementerian Urusan Regional dan Pertanian Estonia). YOY dibedakan dari kelas tahun yang lebih tua berdasarkan distribusi ukuran (panjang total hingga ~110 mm, Järvekülg 2003 ). Ikan tersebut di-eutanasia dengan overdosis benzocaine, > 250 mg L −1 (Caesar & Loretz GmbH, Hilden, Jerman) dan panjang total serta massa dicatat. Tingkat hematokrit ditentukan sebagai rasio sel darah merah terhadap volume total dan diambil sampelnya dari arteri kaudal menggunakan tabung kapiler mikro heparin (diameter 0,5–0,6 mm, Marienfeld, Jerman), diikuti oleh sentrifugasi dengan QBC Capillary Centrifuge (Drucker Diagnostics, AS) selama 5 menit pada 12.250 g. Plasma darah dan sel darah merah yang dikemas diukur hingga 0,5 mm terdekat menggunakan penggaris standar (Debes et al. 2017 ). Rongga tubuh ikan dibuka dengan sayatan memanjang dari lubang anus hingga operkulum. Limpa dikeluarkan menggunakan forsep steril dan ditempatkan dalam etanol 96% (tabung mikrocentrifuge 1,5 mL) untuk ekstraksi DNA lebih lanjut dan kuantifikasi Tb . Untuk menyelidiki gejala utama PKD, hiperplasia ginjal, penampang tengah setiap ikan dipotong dengan pisau bedah steril seperti pada Bruneaux et al. ( 2017 ). Potongan tersebut difoto dari atas pada kertas milimeter menggunakan kamera digital untuk menghitung rasio ketebalan ginjal terhadap tubuh (rasio K/B) sebagai ukuran kuantitatif hiperplasia ginjal (Bruneaux et al. 2017 ; Debes et al. 2017 ) menggunakan perangkat lunak analisis dan pemrosesan gambar sumber terbuka ImageJ (Schneider et al. 2012 ). Potongan melintang tersebut disimpan dalam etanol 96% (tabung sentrifus tutup ulir 5 mL) untuk ekstraksi DNA lebih lanjut dari jaringan ginjal guna mengukur Tb .
| Sungai | Koordinat (Utara, Timur) | Jumlah ikan trout coklat per tahun * | Prevalensi TBC (95% CI) | Beban parasit Tb salinan/reaksi rata-rata; SD (kisaran) | ||
|---|---|---|---|---|---|---|
| Ginjal | Limpa | Ginjal | Limpa | |||
| Vainupea | 59°34′02.4″, 26°15′28.7″ | 9 | 0,22 (0,06–0,55) | 0,11 (0,02–0,43) | 3,5; 8,4 (0–25) | 1,5; 4,4 (0–13,2) |
| Selja | 59°23′27.4″, 26°23′30.4″ | 20 | 0,75 (0,53–0,89) | 0,45 (0,26–0,66) | 525; 1120 (0–3462) | 54; 146 (0–525) |
| Vosu (Bahasa Indonesia) | 59°33′39.1″, 25°59′13.9″ | 20 | 0,15 (0,05–0,36) | 0 (0,03–0,30) | 17; 58 (0–256) | 0,7; 2,7 (0–12) |
| Ahja | 58°08′38.9″, 26°58′28.9″ | 15 | 1 (0,80–1) | 0,93 (0,70–0,99) | 10.938; 7.891 (15–22.367) | 886; 1.043 (0–3.298) |
| Mustoja | 59°33′09.9″, 26°10′59.3″ | 19 | 1 (0,84–1) | 1 (0,84–1) | 39.401; 66.636 (4.436-304.759) | 3.261; 7.462 (68,1–33.407) |
| Mustoja | 59°31′48.0″, 26°10′44.4″ | 20 | 0,05 (0–0,24) | 0,05 (0–0,24) | 0,3; 1,2 (0–5,4) | 0,1; 0,2 (0–1,1) |
| Bahasa Indonesia: Vohandu | 57°53′00.1″, 26°44′32.5″ | 18 | 1 (0,82–1) | 1 (0,82–1) | 34.778; 29.842 (2.156-112.742) | 8.178; 10.682 (659–43.858) |
| Bahasa Indonesia: Vohandu | 57°55′32.7″, 26°45′05.5″ | 20 | 1 (0,84–1) | 1 (0,84–1) | 44.828; 33.177 (7.777-121.899) | 9.943; 12.161 (785–57.500) |
| Parlijogi | 57°45′23.6″, 26°45′55.6″ | 19 | 1 (0,83–1) | 1 (0,83–1) | 35.259; 16.239 (3.003-72.713) | 6.433; 4.332 (333–18.353) |
| Parlijogi | 59°02′42.1″, 26°14′20.1″ | 10 | 1 (0,72–1) | 1 (0,72–1) | 10.468; 10.458 (393–35.362) | 1.665; 3.125 (30–10.434) |
| Elva | 58°08′33.8″, 26°23′51.7″ | 21 | 1 (0,84–1) | 0,57 (0,36–0,75) | 19.150; 15.131 (2.347-57.310) | 127; 431 (0–1.919) |
| Elva | 58°06′54.8″, 26°23′17.7″ | 17 | 0,76 (0,53–0,90) | 0,71 (0,47–0,87) | 898; 1.946 (3,9–8.128) | 139; 293 (0–1.216) |
| Pedja | 57°45′23.6″, 26°45′55.6″ | 11 | 1 (0,78–1) | 1 (0,74–1) | 83.739; 55.718 (854–195.132) | 51.475; 45.864 (266–152.844) |
| Pedja | 58°56′52.8″, 26°30′25.4″ | 19 | 1 (0,83–1) | 1 (0,83–1) | 19.166; 7.438 (11.852-37.081) | 2981; 1.858 (23–6726) |
* Muda di tahun ini.
2.2 Kuantifikasi Parasit Menggunakan qPCR
Ekstraksi DNA dilakukan di Laboratorium Genetika Ikan, Universitas Ilmu Hayati Estonia. Total DNA genomik dari jaringan ginjal dan limpa dari masing-masing 238 ikan trout coklat diekstraksi secara terpisah menggunakan kit QIAamp 96 DNA QIAcube HT dan Instrumen QIAcube HT untuk pemurnian asam nukleat otomatis (QIAGEN, Jerman). Seluruh bagian ginjal dan seluruh limpa atau bagian jaringan di dalam organ yang sangat berkembang biak digunakan untuk ekstraksi DNA. Setiap pelat DNA 96-well mencakup satu kontrol negatif ekstraksi DNA. Konsentrasi DNA dinilai menggunakan Spektrofotometer NanoDrop 2000 (Thermo Scientific, AS), dan setiap ekstraksi diencerkan menjadi 20 ng/μl menggunakan buffer AE (QIAGEN, Jerman). Kuantifikasi Tb dari DNA ginjal dan limpa yang diekstraksi dilakukan dalam satu set tiga replikasi teknis menggunakan PCR kuantitatif waktu nyata (qPCR) pada LightCycler 480 (Roche, Swiss, pelat 384-well). Analisis qPCR dilakukan di Institut Teknologi, Universitas Tartu. Pengujian tersebut menggunakan probe TaqMan bersama primer maju dan mundur spesifik Tb untuk mengamplifikasi urutan 18S rDNA parasit sepanjang 90 bp (PKX18s 1337f: 5′-CGAACGAGACTTCTTCCTT-3′, PKX18s 1426r: 5′-CTTCCTACGCTTTTAAATAGCG-3′; Hutchins et al. 2018a ). Probe TaqMan/hidrolisis PKX18s 1399p (5′-FAM-CCCTTCAATTAGTTGATCTAAACCCCAATT-iQ500-BHQ-1-3′) seperti yang dijelaskan oleh Hutchins et al. ( 2018a ) digunakan.
Setiap reaksi amplifikasi 10 μL mengandung 4,4 μL air bebas nuklease, 2 μL 5x HOT FIREPol Multiplex qPCR Mix (ROX; Solis Biodyne, Estonia), 0,2 μL primer forward dan reverse Tb 200 nM , 0,2 μL probe PKX18s 200 nM dan 3 μL DNA genom yang diisolasi dari jaringan ginjal atau limpa (20 ng/μl, total 60 ng dari total DNA jaringan per reaksi). Pengenceran serial sepuluh kali lipat dari DNA ginjal Tb -positif yang dikumpulkan disiapkan dengan konsentrasi berkisar antara 40 hingga 0,004 ng/μl (5 konsentrasi berbeda) dan ditambahkan ke setiap pelat dalam enam replikasi teknis per konsentrasi, yang berfungsi sebagai seri pengenceran standar/kontrol positif. Kontrol PCR negatif disertakan dalam enam replikasi pada setiap plat dengan menambahkan air bebas DNase-RNase (Solis Biodyne) ke reaksi amplifikasi (menghasilkan total 48 replikasi PCR negatif). Tidak ada kontrol PCR negatif yang menunjukkan amplifikasi. Selain itu, satu sampel kontrol ekstraksi DNA negatif disertakan pada setiap plat qPCR (total delapan plat), dengan tiga replikasi teknis per plat (menghasilkan total 24 replikasi). Di antara delapan sampel kontrol ekstraksi DNA negatif, amplifikasi lemah diamati dalam dua sampel. Dalam satu kontrol ekstraksi DNA negatif, satu replikasi teknis dari tiga menunjukkan nilai Cq (ambang batas siklus) sebesar 37,9, sedangkan pada kontrol ekstraksi lainnya, dua replikasi dari tiga menghasilkan amplifikasi akhir (Cq 37,97 dan 38,61). Dalam sampel positif, Tb diamplifikasi dalam tiga replikasi dari tiga pada 99,2% kasus (354 dari 357 sampel positif).
Untuk estimasi batas deteksi (LOD) dan batas kuantifikasi (LOQ), seri pengenceran sintetis disiapkan dengan menambahkan fragmen urutan gen Tb 18S yang disintesis secara artifisial (90 bp; Hutchins et al. 2018a ) ke satu pelat 384-sumur dalam pengenceran serial sepuluh kali lipat, berkisar dari 1.806.642,6 hingga 180,6 salinan/reaksi (5 konsentrasi berbeda, dengan 32 replikasi teknis per konsentrasi). Ini diikuti oleh pengenceran delapan kali lipat, mengurangi konsentrasi dari 180,6 menjadi 22,5 salinan/reaksi (32 replikasi teknis). Akhirnya, dua pengenceran 5 kali lipat dibuat, mengurangi konsentrasi dari 22,5 menjadi 4,5 menjadi 0,9 salinan/reaksi (64 replikasi teknis per konsentrasi). qPCR dilakukan menggunakan profil siklus termal berikut: 95°C selama 10 menit, diikuti oleh 45 siklus 95°C selama 15 detik dan 60°C selama 60 detik. Semua pelat qPCR disiapkan dan dijalankan oleh orang yang sama. Replikasi teknis diperiksa untuk mengetahui outlier dengan menghitung deviasi standar (SD). Mengingat bahwa jumlah parasit di antara sampel yang terinfeksi dapat sangat bervariasi (misalnya, Hutchins et al. 2018b ), kami memilih ambang deviasi standar < 1 saat mengidentifikasi outlier di antara replikasi teknis qPCR.
Analisis regresi seri pengenceran standar dilakukan pada setiap plat untuk menentukan efisiensi plat qPCR (Tabel S1 ). Selain itu, analisis regresi linier seri pengenceran sintetis dilakukan untuk mengubah estimasi Cq menjadi target salinan/reaksi Tb ( beban Tb ). Batas deteksi (LOD, 3,6 salinan/reaksi) dan batas kuantifikasi (LOQ, 9 salinan/reaksi) ditentukan berdasarkan seri pengenceran gen rRNA Tb 18S sintetis yang terdiri dari sembilan pengenceran, mengikuti metode dan skrip R yang diuraikan oleh Merkes et al. ( 2019 ) dan Klymus et al. ( 2019 ). LOD efektif untuk tiga replikasi teknis adalah 1,1 salinan/reaksi. Dari sampel positif, 96,6% (345 dari 357 sampel positif) diperkuat di atas ambang batas LOD. Untuk tujuan perbandingan, kami juga melaporkan nilai Cq dalam Tabel S1 .
2.3 Analisis Statistik
Analisis statistik dan gambar dibuat dalam R versi 4.2.2 (R Foundation for Statistical Computing). Untuk mengevaluasi kongruensi estimasi beban parasit antara dua jaringan, kami menghitung momen produk Pearson dan koefisien korelasi Spearman peringkat-urutan. Kami menggunakan data mentah ( salinan target Tb /reaksi, n = 191) dan data beban parasit yang ditransformasikan log10 ( salinan target Tb log10/reaksi, n = 166). Transformasi log10 diterapkan untuk mengatasi kemiringan kanan yang signifikan dalam data, yang bertujuan untuk membuat distribusinya lebih mendekati normalitas (data tidak ditampilkan). Karena tidak mungkin untuk mengubah nilai nol log10, data yang ditransformasikan hanya terdiri dari individu-individu yang parasitnya terdeteksi di kedua jaringan ( n = 166). Uji peringkat bertanda Wilcoxon non-parametrik digunakan untuk membandingkan prevalensi parasit antara jaringan yang berbeda dalam sembilan populasi ikan trout coklat. Studi sebelumnya telah menunjukkan hubungan non-linier antara beban Tb dan ciri-ciri penyakit (misalnya, Debes et al. 2017 ; Lauringson et al. 2021 ). Oleh karena itu, kami bertujuan untuk lebih jauh mengeksplorasi dinamika antara beban parasit dan gejala penyakit dengan melakukan analisis regresi tersegmentasi (juga dikenal sebagai model garis putus-putus) menggunakan paket R ‘Segmented’ (Muggeo 2008 ). Lebih khusus lagi, kami menggunakan analisis garis regresi tersegmentasi untuk menentukan pada tingkat beban parasit (log10 yang ditransformasikan) untuk setiap jaringan, parameter kesehatan yang diukur (hiperplasia ginjal dan hematokrit) mulai memburuk lebih cepat. Ini dikenal sebagai titik henti dalam model regresi tersegmentasi dan mengacu pada nilai prediktor (beban parasit dalam kasus ini) di mana hubungan antara variabel independen dan dependen (hiperplasia ginjal dan hematokrit) berubah secara linier sepotong-sepotong. Uji Davies digunakan untuk menilai signifikansi perubahan kemiringan.
3 Hasil
3.1 Beban dan Prevalensi Parasit di Seluruh Jaringan
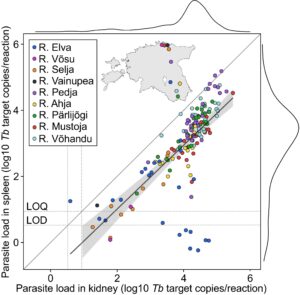
Dari 238 spesimen yang diambil dari sembilan sungai, Tb terdeteksi pada 191 individu (Tabel 1 ). Tingkat deteksi lebih tinggi pada sampel ginjal (190/191; 99,5%) dibandingkan pada sampel limpa (167/192; 87,5%, Tabel S1 ).
Dalam kebanyakan kasus, amplifikasi diamati di kedua jaringan. Namun, dalam satu spesimen, konsentrasi parasit rendah terdeteksi secara eksklusif di limpa (1,1 Tb target salinan/reaksi), sementara 23 individu menunjukkan amplifikasi hanya di ginjal (kisaran: 4,5–50.370 Tb target salinan/reaksi). Semua amplifikasi ginjal positif berada di atas LOD (3,6 Tb target salinan/reaksi), sementara 15 sampel limpa berada di bawah LOD. Selain itu, sembilan amplifikasi Tb ginjal dan 38 limpa berada di bawah LOQ (9 Tb target salinan/reaksi). Rata-rata, ginjal menunjukkan kelimpahan parasit 4,1 kali lipat lebih tinggi daripada limpa (25.777 vs. 6259 Tb target salinan/reaksi).
Rata-rata prevalensi parasit di sungai yang diteliti adalah 73,7% (ginjal) dan 63,7% (limpa), meskipun perbedaan prevalensi parasit antara jaringan tidak signifikan ( p = 0,062, uji peringkat bertanda Wilcoxon).
Beban parasit antar jaringan menunjukkan korelasi positif yang signifikan. Untuk data yang tidak ditransformasi, Pearson’s r = 0,60 ( p = 1,15 × 10 −19 ) dan Spearman’s ρ = 0,78 ( p = 3,01 × 10 −40 ). Untuk data yang ditransformasi log10, Pearson’s r = 0,71 ( p = 2,49 × 10 −26 ) (Gambar 1 ).
3.2 Hubungan Antara Jumlah Parasit dan Gejala Penyakit
Analisis regresi tersegmentasi menunjukkan titik putus yang signifikan dalam hubungan antara beban parasit dan keduanya, hiperplasia ginjal dan hematokrit dalam tiga dari empat analisis spesifik jaringan, yang mencerminkan percepatan penurunan kesehatan di luar ambang batas beban parasit tertentu. Interval kepercayaan titik putus yang diperkirakan lebih lebar untuk hiperplasia ginjal daripada untuk hematokrit untuk kedua jaringan (Gambar 2 ).
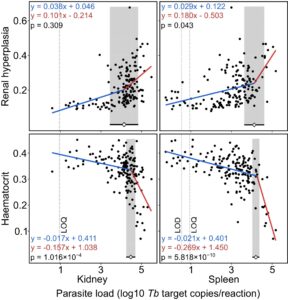
Untuk hematokrit, titik henti diestimasi pada 4,263 log10 Tb target kopi/reaksi (95% CI: 4,037–4,374) untuk limpa dan 4,471 log10 Tb target kopi/reaksi (95% CI: 4,255–4,687) untuk ginjal. Kemiringan berbeda secara signifikan di atas dan di bawah ambang batas ini untuk kedua jaringan ( p = 5,818 × 10 −10 dan 1,016 × 10 −4 , masing-masing; uji Davies). Untuk hiperplasia ginjal, titik henti diestimasi pada 4,126 log10 Tb target kopi/reaksi (95% CI: 4,037–4,374) untuk limpa dan 4,14 log10 Tb target kopi/reaksi (95% CI: 3,456–4,824) untuk ginjal. Namun, kemiringan berbeda secara signifikan di atas dan di bawah ambang batas yang diperkirakan hanya untuk limpa ( p = 0,043, uji Davies).
4 Diskusi
Studi ini mengevaluasi kesesuaian jaringan limpa sebagai alternatif jaringan ginjal untuk mendeteksi dan mengukur Tetracapsuloides bryosalmonae ( Tb ) pada ikan trout coklat muda. Dengan menilai prevalensi parasit di kedua jaringan pada sejumlah besar individu, kami bertujuan untuk mengklarifikasi hubungan antara beban parasit dan indikator klinis utama penyakit ginjal proliferatif (PKD) – hiperplasia ginjal dan anemia. Temuan kami mengungkapkan korelasi positif yang kuat antara kedua jaringan, meskipun Tb lebih dari empat kali lebih sedikit di limpa. Di bawah ini, kami membahas kegunaan dan keterbatasan limpa sebagai alternatif jaringan ginjal untuk memperkirakan beban Tb , prevalensi, dan hubungannya dengan gejala PKD pada ikan trout coklat muda.
Studi histologis PKD telah menunjukkan bahwa organ ekstra-renal yang tervaskularisasi dengan baik, seperti limpa, sering menunjukkan perubahan patologis yang mirip dengan yang diamati di ginjal (Kent 2002 ). Konsisten dengan ini, analisis kami menunjukkan korelasi sedang hingga kuat dalam beban parasit antara limpa dan ginjal. Namun demikian, mencerminkan peran ginjal sebagai tempat utama perkembangan parasit (Okamura et al. 2011 ), beban parasit di ginjal, rata-rata, 4,1 kali lebih tinggi daripada di limpa. Meskipun ada perbedaan ini, prevalensi parasit yang diperkirakan tidak berbeda antara jaringan di sembilan populasi sungai, seperti yang ditentukan oleh uji peringkat bertanda Wilcoxon berpasangan. Hal ini kemungkinan disebabkan oleh kurangnya daya statistik yang terkait dengan uji non-parametrik. Namun demikian, estimasi prevalensi parasit di limpa selaras dengan penelitian kami sebelumnya di sungai yang sama, dengan beberapa populasi menunjukkan prevalensi 100% di kedua jaringan (misalnya, Dash dan Vasemägi 2014 ; Debes et al. 2017 ).
Penilaian molekuler standar dari agen PKD biasanya melibatkan pengambilan sampel bagian ginjal posterior, anterior atau seluruh bagian (misalnya, Bailey et al. 2017 ; Vasemägi et al. 2017 ; Strepparava et al. 2018 ; Gorgoglione et al. 2019 ; Philpott et al. 2025 ). Proses ini biasanya mencakup pembedahan in situ jaringan ginjal segar atau fiksasi seluruh atau sebagian ikan dalam fiksatif, diikuti oleh segregasi mekanis dan melisiskan jaringan ginjal untuk ekstraksi DNA. Namun, karena posisi ginjal yang dalam di dalam rongga tubuh dan vaskularisasi yang tinggi, pembedahan ginjal dapat memakan waktu lama, terutama saat memproses ukuran sampel yang besar. Sebaliknya, limpa lebih mudah diakses dan menawarkan jaringan limfoid dan pulpa merah yang padat, sehingga memudahkan dan mempercepat pengumpulan sampel.
Temuan kami menunjukkan bahwa, sementara beban parasit di limpa biasanya lebih rendah daripada di ginjal, limpa masih merupakan jaringan yang layak untuk deteksi dan kuantifikasi Tb . Khususnya, kami mendeteksi parasit di kedua jaringan ikan YOY yang tidak menunjukkan tanda-tanda PKD klinis, yang menunjukkan keberadaan parasit awal di ginjal dan limpa. Ini sejalan dengan pekerjaan sebelumnya oleh Longshaw et al. ( 2002 ), yang melaporkan keberadaan Tb di ginjal dan limpa ikan trout pelangi pada 4 minggu pasca pajanan, terutama ketika gejala klinis PKD tidak ada. Oleh karena itu, dalam kasus beban parasit rendah atau PKD asimtomatik, limpa dapat berfungsi sebagai jaringan diagnostik tambahan yang berguna. Lebih jauh, Soliman et al. ( 2017 ) mendeteksi Tb di limpa dan organ limfoid lainnya dari ikan trout coklat dengan PKD subklinis 5 tahun pasca infeksi. Dengan demikian, analisis beban parasit limpa diharapkan dapat memberikan wawasan berharga tentang infeksi Tb selama fase subklinis dan potensi (re)infeksi pada ikan yang lebih tua. Tidak seperti juvenil, yang biasanya menunjukkan infeksi Tb yang konsisten di seluruh ginjal, DNA parasit sebagian besar terdeteksi di bagian tengah dan posterior ginjal dalam ikan trout dewasa (Dash dan Vasemägi 2014 ). Hal ini menunjukkan bahwa hanya tahap sporogoni di bagian ekskresi yang bertahan dalam jangka panjang, sedangkan tahap ekstrasporogoni di ginjal anterior kemungkinan besar dihilangkan (Dash dan Vasemägi 2014 ). Khususnya, deteksi parasit di ginjal anterior ikan trout laut dewasa menunjukkan kemungkinan infeksi atau infeksi ulang pada tahap kehidupan selanjutnya (Lauringson et al. 2023 ). Penelitian di masa depan dapat menyelidiki apakah ikan anadromous, yang tidak terpapar parasit selama fase laut, dapat menghilangkan Tb dari limpa setelah paparan awal.
Meskipun aksesibilitasnya dan kemudahan pengambilan sampelnya, jaringan limpa menghadirkan beberapa keterbatasan. Beban parasit di limpa secara konsisten lebih rendah daripada di ginjal, yang dapat mengurangi sensitivitas dalam kasus infeksi awal atau intensitas rendah. Selain itu, deteksi berbasis limpa mungkin tidak sepenuhnya menangkap tahap perkembangan parasit atau status infeksi, karena limpa bukanlah tempat utama proliferasi parasit. Lebih jauh lagi, kami mengidentifikasi sekelompok sampel dari sungai Elva, di mana beban parasit limpa jauh lebih rendah dalam kaitannya dengan ginjal. Ini mungkin mencerminkan perbedaan lokal dalam dinamika infeksi, termasuk kemungkinan bahwa tahap parasit ekstrasporogoni telah dibersihkan dari limpa, mirip dengan ginjal (Feist dan Longshaw 2006 ). Namun, tanpa data beban parasit longitudinal dan analisis histopatologi, penyebab yang mendasari mengapa spesimen ini menyimpang dari hubungan beban parasit yang khas antara kedua jaringan masih belum jelas. Lebih jauh lagi, karena penelitian ini difokuskan secara eksklusif pada ikan YOY, tidak diketahui apakah korelasi positif yang kuat dalam jumlah parasit antara limpa dan ginjal berlanjut pada kelas tahun yang lebih tua.
Untuk menyelidiki lebih lanjut hubungan antara beban parasit dan perkembangan penyakit, kami menggunakan analisis regresi tersegmentasi untuk mengidentifikasi ambang batas beban parasit yang melampaui parameter kesehatan (hiperplasia ginjal dan hematokrit) memburuk lebih cepat. Regresi tersegmentasi adalah alat yang kuat untuk mendeteksi pergeseran dalam hubungan variabel (Muggeo 2008 ) dan telah diterapkan secara luas dalam studi berbagai penyakit menular (misalnya, Gebski et al. 2012 ; Funk et al. 2013 ). Dalam studi kami, analisis breakpoint mengungkapkan transisi yang berbeda dalam hubungan antara beban parasit dan hematokrit untuk jaringan limpa dan ginjal. Kemiringan pasca-breakpoint yang lebih curam menunjukkan dampak yang dipercepat dari proliferasi parasit pada anemia pada beban parasit yang tinggi (masing-masing 4,263 dan 4,471 log10 Tb salinan target/reaksi untuk limpa dan ginjal). Namun, estimasi titik putus yang lebih rendah dan kemiringan pasca putus yang lebih curam untuk jaringan limpa menunjukkan perbedaan spesifik jaringan dalam bagaimana beban parasit berkorelasi dengan penurunan hematokrit.
Untuk hiperplasia ginjal, titik henti untuk jaringan limpa sedikit signifikan ( p = 0,043) dan tidak signifikan ( p = 0,308) untuk jaringan ginjal. Estimasi titik henti yang lebih rendah menunjukkan bahwa hiperplasia ginjal bermanifestasi lebih awal dalam perkembangan PKD daripada anemia, yang menguatkan penelitian sebelumnya (Bruneaux et al. 2017 ; Debes et al. 2017 ; Lauringson et al. 2021 ). Bersama-sama, hasil ini menyoroti nilai regresi tersegmentasi dalam mengidentifikasi penurunan yang bergantung pada ambang batas dalam metrik kesehatan terkait PKD dengan meningkatnya beban parasit, yang menawarkan wawasan yang berguna ke dalam perkembangan penyakit dan dinamika host-patogen. Selain itu, analisis titik henti dapat membantu mengidentifikasi perbedaan antar populasi dalam toleransi host terhadap Tb . Namun, untuk menerapkan metode ini secara efektif, penelitian masa depan harus menstandardisasi dan mengkarakterisasi perkembangan penyakit temporal di seluruh sistem, karena dinamika PKD dapat bervariasi secara signifikan karena faktor lingkungan dan genetik. Penting juga untuk mengakui bahwa estimasi titik henti dapat dipengaruhi oleh metode transformasi data; Oleh karena itu, interpretasi harus didekati dengan hati-hati.
Singkatnya, penelitian ini menunjukkan bahwa jaringan limpa memberikan nilai diagnostik yang sebanding dengan jaringan ginjal untuk mendeteksi dan mengukur Tetracapsuloides bryosalmonae pada salmonid muda. Temuan kami juga menyoroti potensi nilai tambah dari pelacakan beban parasit di berbagai jaringan, yang dapat menghasilkan wawasan berharga tentang perkembangan penyakit, respons imun, dan perilaku patogen. Pada akhirnya, penelitian ini menggarisbawahi pentingnya strategi diagnostik multijaringan yang dioptimalkan untuk meningkatkan pemahaman dan pengelolaan infeksi parasit di berbagai spesies inang dan lingkungan ekologi.



