Abstrak
Mempertahankan usus yang sehat sangat penting untuk pertumbuhan dan mekanisme pertahanan inang ikan budidaya, terutama yang ditebar dengan padat. Dalam konteks ini, menjaga mikrobiota usus yang sehat untuk pencernaan, penyerapan, dan integritas mukosa yang tepat adalah yang paling penting. Pediastrum boryanum (Turpin) yang diperkaya bentuk nano (SeNPs) menunjukkan sifat antimikroba, antioksidan, dan antitumor. Oleh karena itu, SeNPs adalah suplemen nutrisi yang berharga untuk hewan air budidaya. Nanopartikel Se algogenik (SeNPs, 79,26 nm) disintesis dari mikroalga hijau Pediastrum boryanum . Diet basal ikan nila ( Oreochromis niloticus ) dicampur dengan 0,75 atau 1,5 mg/kg pakan kering SeNPs dan diberikan selama 8 minggu. Rangkaian lengkap parameter terkait biomarker usus diselidiki. Suplementasi dengan SeNP, khususnya pada diet 1,5 mg/kg, meningkatkan kinerja pertumbuhan, aktivitas amilase dan lipase, kadar metabolit serotonin, dan morfometri usus. Selain itu, suplementasi SeNP menekan kadar serotonin. SeNP pada diet 1,5 mg/kg diamati sebagai dosis optimal, karena menunjukkan hasil yang lebih baik terkait peningkatan mikroba bermanfaat dan penurunan mikroba patogen, yang menunjukkan peran potensial SeNP dalam peningkatan pertumbuhan dan fungsi usus. Jumlah data kami menggarisbawahi manfaat suplementasi pakan nila Nil dengan SeNP untuk meningkatkan pertumbuhan dan profitabilitas akuakultur.
1. PENDAHULUAN
Suplemen pakan banyak digunakan dalam akuakultur untuk meningkatkan pertumbuhan, memperbaiki fungsi usus, dan menambah ketahanan terhadap penyakit (Cryan & Dinan, 2012 ; Zhou et al., 2021 ). Di antara semua itu, selenium (Se) merupakan logam esensial yang terlibat dalam berbagai proses fisiologis, biokimia, dan imunologi, termasuk pertahanan antioksidan dan pemeliharaan mikrobiota usus yang sehat (Farzad et al., 2021 ).
Bio-nanoteknologi memungkinkan sintesis nanopartikel metalik (NPs), termasuk SeNPs, dari sumber bakteriogenik, mikogenik, algogenik, fitogenik, dan protein alami (Kalishwaralal et al., 2016 ; Mirzaei et al., 2021 ; Saad et al., 2022 ; Satgurunathan et al., 2017 ). Melalui teknologi baru ini, Pediastrum boryanum (Turpin) yang diperkaya bentuk nano (SeNPs) menunjukkan sifat antimikroba, antioksidan, dan antitumor (Hariharan & Dharmaraj, 2020 ). Oleh karena itu, SeNPs dianggap sebagai suplemen nutrisi yang berharga untuk hewan akuatik yang dibudidayakan (Khalil et al., 2023 ).
Manfaat kesehatan dari SeNP telah dikaitkan dengan efek modulasinya pada fungsi usus dan komponen mikroba. Selain itu, SeNP diyakini dapat meningkatkan aktivitas enzim pencernaan seperti α-amilase dan lipase (García-Meilán et al., 2023 ). NP, termasuk SeNP, dan mikrobioma usus berinteraksi satu sama lain, sehingga memengaruhi pencernaan gastrointestinal dan kinerja mukosa usus. Penyerapan NP juga memengaruhi komunikasi usus-otak (Carabotti et al., 2015 ) dan memodulasi kadar neurotransmiter seperti serotonin (Dicks, 2022 ).
SeNPs makanan efektif melawan penghasil spesies oksigen reaktif (ROS), karena sangat penting untuk apoptosis yang dimediasi mitokondria melalui aktivasi caspase-3 dan pembelahan poli(ADP-ribosa) polimerase-1 (PARP), yang pada gilirannya menetralkan efek ROS (Sonkusre, 2020 ). Lebih jauh lagi, SeNPs makanan berkontribusi pada peningkatan barier mukosa usus dan memperkuat fungsi tight junction usus dengan mengaktifkan atau menghambat sinyal intraseluler (Ou et al., 2019 ), yang sebagian terkait dengan perkembangan sel goblet dan peningkatan pembentukan lapisan mukus, sehingga melindungi jaringan usus (Chen et al., 2022 ; Hamidian et al., 2018 ).
Ikan nila mengenai Ikan nila ( Oreochromis niloticus ) adalah ikan dengan nilai komersial yang sangat besar yang dibudidayakan secara intensif di seluruh dunia. Studi terbaru kami menunjukkan efek menguntungkan dari SNP pada indeks pertumbuhan, status biokimia, imunologi, oksidan/antioksidan, dan histopatologi limpa dan hati (Al-Wakeel, Elbahnaswy, Eldessouki, et al., 2024 ). Dalam studi saat ini, kami berfokus terutama pada kesehatan usus ikan untuk mengeksplorasi apakah SeNP makanan dapat memengaruhi komposisi mikrobiota usus. Secara khusus, kami bertujuan untuk menentukan apakah SeNP dapat meningkatkan pertumbuhan bakteri yang menguntungkan sambil menghambat proliferasi bakteri patogen, dengan peningkatan fungsi fisiologis normal berikutnya, seperti pertumbuhan, kesehatan usus, dan penyerapan nutrisi, selain integritas histomorfometri usus. Temuan ini diharapkan dapat berkontribusi pada pemahaman yang lebih akurat tentang mekanisme yang mendasari peran biologis SeNP makanan dalam pakan ikan.
2 BAHAN DAN METODE
2.1 Pengelompokan ikan dan uji coba pemberian pakan
Nanopartikel selenium (SeNPs) disintesis secara hijau dari mikroalga hijau Pediastrum boryanum ( P. boryanum ) yang dibeli dalam bentuk bubuk dari unit produksi alga, Pusat Penelitian Nasional, Giza, Mesir, dan dikarakterisasi ( Informasi Pendukung ) menurut penelitian terbaru kami (Al-Wakeel, Elbahnaswy, El-Moaty, et al., 2024 ). Seratus delapan puluh Ikan Nila yang sehat (berat 57,60 ± 0,56 g) diperoleh dari peternakan ikan swasta, Danau Manzala, saluran Bahr El-Baqar, Mesir. Ikan dibagi secara acak menjadi tiga kelompok dalam rangkap tiga (20 ikan/hapa) sesuai dengan dosis Se-NP yang diberikan dan dialokasikan ke dalam sembilan hapa (200 × 500 × 100 cm 3 , 10 m 3 ). SeNP dimasukkan ke dalam diet basal yang telah disiapkan (30,04% protein dan 7,06% lipid) pada tiga konsentrasi yang berbeda: 0, 0,75, dan 1,5 mg/kg, sebagai berikut: kontrol, diberi diet basal (Ct, mengandung Se sebagai mineral bersumber premix mineral 0,2 mg/kg); SeNP 0,75 , diberi diet (premix mineral bebas Se) yang disuplemen dengan SeNP pada 0,75 mg/kg berat badan; dan SeNP 1,5 , diberi diet yang disuplemen (premix mineral bebas Se) dengan SeNP pada 1,5 mg/kg berat badan, masing-masing. Semua bahan dicampur dengan gelatin, dan air panas yang disterilkan ditambahkan sampai pasta menjadi kaku. Pasta dipelet menggunakan pencacah daging menjadi pelet berdiameter 3 mm (ME605131 1600-Watt, Moulinex, Groupe SEB, Prancis). Akhirnya, pelet dikeringkan dalam oven selama 24 jam pada suhu 50°C sebelum disimpan dalam kantong plastik pada suhu 4°C hingga digunakan. Menggunakan spektrofotometer serapan atom (PG990, Inggris), kandungan Se dari diet yang disuplemen SeNP ini ditentukan sebesar 0,2, 0,75, dan 1,5 mg/kg (Tabel 1 ), dan komposisi kimia dari diet yang disiapkan dianalisis (AOAC, 2000 ). Selama percobaan, parameter kualitas air dipantau dua minggu sekali menggunakan sistem YSI 556 Multiprobe (YSI, Inc., AS), dan 10% air diganti setiap hari. Ikan diberi diet percobaan dua kali sehari (09:00 dan 15:00) sebanyak 3% dari berat tubuhnya selama 8 minggu. Suhu air, oksigen terlarut, dan kadar pH dipertahankan sepanjang percobaan pada 26°C, 6,7–6,9 mg/L, dan 7,3 ± 0,2.
| Bahan-bahan (%) | Kontrol | SeNP 0,75 | SeNP 1.5 |
|---|---|---|---|
| jagung kuning | 19.5 | 19.5 | 19.5 |
| Bungkil kedelai | 20 | 20 | 20 |
| Tepung ikan | 20 | 20 | 20 |
| Gluten jagung | 3 | 3 | 3 |
| agar-agar | 2 | 2 | 2 |
| Minyak bunga matahari | 3.50 | 3.50 | 3.50 |
| Dedak gandum | 30.16 | 30.16 | 30.16 |
| Mineral dan vitamin premix a | 1 | 1 | 1 |
| Garam | 0.30 | 0.30 | 0.30 |
| Vitamin C | 0.12 | 0.12 | 0.12 |
| Dikalsium fosfat | 0.10 | 0.10 | 0.10 |
| Metionina | 0.32 | 0.32 | 0.32 |
| Kandungan SeNP (mg/kg) | angka 0 | 0,75 | 1.5 |
| Analisis proksimat (berdasarkan % bahan kering) | |||
| Protein kasar b | Tanggal 32.04 | Tanggal 32.04 | Tanggal 32.04 |
| Lipid b | 7.06 | 7.06 | 7.06 |
| Bisa b | 1.17 | 1.17 | 1.17 |
| Pb | 0.53 | 0.53 | 0.53 |
| DE (energi yang dapat dicerna) c (kkal/kg) | tahun 3016 | tahun 3016 | tahun 3016 |
| Kandungan SE (mg/kg) | 0.2 | 0,75 | 1.5 |
a Kadar mikronutrien dan vitamin dalam ikan nila terpenuhi dengan suplementasi mineral dan premix vitamin (NRC, 2011 ). Premix vitamin (IU atau mg/kg pakan); vit. A 5000, Vit. D3 1000, vit. E 20, vit. K3 2, vit. B1 2, vit. B2 5, vit. B6 1.5, vit. B12 0.02, Asam pantotenat 10, Asam folat 1, Biotin 0.15, Niacin 30. Campuran mineral (mg/kg pakan); Fe 40, Mn 80, Cu 4, Zn 50, I 0.5, Co 0.2 & Se 0.2.
b Dianalisis.
c DE dihitung menurut Jobling ( 1983 ). Energi kotor dihitung menurut NRC ( 2011 ) sebagai berikut: CP × 5,64 + EE × 9,44 + NFE × 4,11; sedangkan ekstrak bebas Nitrogen (NFE) = [100 − (CP+ EE+ CF+ Ash)]. DE dihitung menurut Jobling ( 1983 ) sebagai berikut: energi yang dapat dicerna = energi kotor × 0,75. Kontrol = kelompok yang diberi diet basal tanpa penambahan SeNPs (kelompok kontrol); SeNPs0,75 = kelompok yang diberi diet basal (premix bebas Se) dengan penambahan 0,75 mg/kg SeNPs; dan SeNPs1,5 = kelompok yang diberi diet basal (premix bebas Se) dengan penambahan 1,5 mg/kg SeNPs.
2.2 Pengambilan sampel dan jaringan
Pengukuran berat standar dicatat sebelum dan setelah uji coba pemberian makan. Ikan diambil sampelnya dari setiap kelompok (6 ikan/kelompok) setelah selesainya periode pemberian makan dan dieutanasia dengan overdosis tricaine methanesulfonate (MS-222; Finquel®, Argent Laboratories, Redmont-VI, AS) pada 200 mg/L tricaine + 400 mg/L natrium bikarbonat. Ikan dibedah segera setelah eutanasia, dan ususnya dikeluarkan. Digesta dari seluruh usus tiga ikan per kelompok dikumpulkan dalam tabung steril dan dibekukan dengan cepat pada suhu -80°C sebelum analisis mikroba. Usus dari ikan sampel lainnya (dua ikan/hapa) dipotong menjadi tiga bagian; bagian pertama dibilas tiga kali dengan larutan NaCl 0,85% dingin dan kemudian dihomogenisasi dalam PBS dingin (pH 7,4) menggunakan homogenizer listrik. Homogenat dikumpulkan dalam tabung Eppendorf bersih dan disentrifugasi selama 5 menit pada 8000 rpm, dan supernatan digunakan untuk analisis enzim pencernaan. Bagian ke-2 dihomogenisasi dalam 75% metanol tingkat HPLC berair (10% b/v) (Arafa et al., 2010 ) dan disentrifugasi pada 5000 rpm selama 10 menit. Supernatan dikeringkan dalam vakum (70 Millipore) pada suhu kamar dan digunakan untuk menentukan kadar 5HT dan 5HIAA. Bagian ke-3 difiksasi dalam 10% formalin buffer netral untuk pemeriksaan histomorfometri.
2.3 Kinerja pertumbuhan ikan
Indeks pertumbuhan setiap ikan (6 ikan/kelompok), termasuk berat badan akhir (FBW), persentase pertambahan berat (PWG), dan laju pertumbuhan spesifik (SGR), dinilai menggunakan rumus berikut:

2.4 Aktivitas enzim pencernaan usus
Aktivitas karbohidrase (yaitu, α-amilase) pada ikan nila herbivora lebih besar daripada ikan karnivora; oleh karena itu, mikrobiota mereka terlibat dalam metabolisme karbohidrat total yang lebih intensif. Dalam konteks ini, enzim pencernaan, seperti karbohidrase (misalnya, α-amilase) dan lipase, dianalisis untuk menentukan kemanjuran SeNP dalam meningkatkan kemampuan pencernaan. Untuk protokol homogenisasi, jaringan usus setiap ikan (6 ikan/kelompok) dibilas tiga kali dengan larutan NaCl 0,9% dingin dan kemudian dihomogenisasi dalam larutan penyangga fosfat dingin (PBS, pH 7,4) menggunakan homogenizer listrik. Homogenat dikumpulkan dalam tabung Eppendorf yang bersih dan disentrifugasi selama 5 menit pada 8000 rpm, dan supernatan homogenat usus digunakan untuk menentukan aktivitas amilase (Nomor Katalog; AY 1050) menurut metode Bio-Diagnostics Company (Bio-Diagnostics, Dokki, Giza, Mesir), dan aktivitas enzim lipase (Nomor Katalog; HIT0511B) (Biorex Diagnostics, Antrim Co., Antrim, Inggris Raya) sesuai dengan petunjuk produsen.
2.5 Pengukuran kadar serotonin usus (5HT) dan metabolitnya (5HIAA)
Serotonin, neurotransmitter yang terlibat dalam aksis usus-otak, dipilih untuk menilai efek SeNP pada aksis mikrobiota-usus-otak dan kontribusinya dalam meningkatkan kesehatan usus dan penyerapan nutrisi. Supernatan homogenat usus dari setiap ikan (6 ikan/kelompok) dikeringkan dalam vakum (70 Millipore) pada suhu ruangan dan digunakan untuk menentukan kadar 5HT dan 5HIAA. Sistem HPLC (seri Agilent HP 1200, AS) digunakan untuk pengukuran, dan laporan serta kromatogram diperoleh menggunakan program ChemStation (Agilent, AS). Sampel diekstraksi menggunakan kolom ekstraksi fase padat CHROMABOND fase NH 2 (Nomor katalog 730031, MACHEREY-NAGEL, Jerman). Sampel kemudian disuntikkan langsung ke kolom AQUA 150 mm 5 μ C18 (Phenomenex, AS) dalam kondisi berikut: fase gerak 20 mM kalium fosfat, pH 2,5; laju alir 1,5 mL/menit, UV 190 nm (Pagel et al., 2000 ).
2.6 Analisis mikrobiota usus
2.6.1 Ekstraksi DNA dan analisis deteksi kualitas
Dengan mengikuti protokol pabrik secara ketat, ekstraksi DNA mikroba rangkap tiga dari isi usus ikan yang dikumpulkan dari setiap kelompok dilakukan menggunakan PureLink™ Microbiome DNA Purification Kit (Invitrogen™, Carlsbad, California, AS). Kualitas DNA diperiksa dengan elektroforesis gel agarosa 1% dan diukur menggunakan spektrofotometer UV-vis Nanodrop 2000 (Thermo Scientific, Wilmington, AS).
2.6.2 Persiapan perpustakaan dan pengurutan generasi berikutnya
Illumina 16S rRNA, protokol berbasis PCR yang terdiri dari dua langkah amplifikasi PCR, menjalani langkah pembersihan lanjutan. Daerah hipervariabel 16S rRNA V3–V4 dari gen tersebut diamplifikasi menggunakan set primer berkode batang universal 341F (5′-CCTACGGGNGGCWGCAG-3′) dan 806R (5′-GGACTACHVGGGTATCTAAT-3′), di mana kode batang tersebut merupakan urutan 8 basa yang unik untuk masing-masing sampel (Amoah et al., 2019 ). Amplifikasi PCR dilakukan menggunakan sistem PCR thermocycler (GeneAmp 9700, ABI, AS) dengan kondisi siklus berikut: 95°C selama 2 menit, diikuti oleh 27 siklus 98°C selama 10 detik, 62°C selama 30 detik, 68°C selama 30 detik, dan ekstensi akhir pada 68°C selama 10 menit. Reaksi PCR dilakukan dalam rangkap tiga dengan volume total 50 μL campuran yang terdiri dari 5 μL dNTP 2,5 mM, 5 μL Buffer KOD 10 ×, 1 μL Polimerase KOD, 1,5 μL setiap primer (5 μM), dan 100 ng DNA cetakan. Produk PCR diperiksa lagi pada gel agarosa 2%, dan fragmen target dimurnikan lebih lanjut menggunakan manik-manik AMPure XP dan dikuantifikasi menggunakan QuantiFluor™-ST (Promega, AS) mengikuti petunjuk produsen.
2.6.3 Analisis urutan data dan identifikasi taksonomi
Praproses dan identifikasi taksonomi dilakukan menggunakan alur kerja dada2. FilterAndTrim ( https://rdrr.io/bioc/dada2/src/R/filter.R ) digunakan untuk memfilter dan memangkas bacaan berpasangan berkualitas rendah. Tingkat kesalahan dipelajari menggunakan nbases = 90.000. Bacaan yang difilter digabungkan dan disimpulkan menggunakan fungsi dada2, dada, dan mergePairs ( https://rdrr.io/bioc/diffHic/man/mergePairs.html ). Chimera kemudian dihapus dan urutan tabel yang dihasilkan diimpor ke Quantitative Insights into Microbial Ecology 2 (QIIME2). Pengklasifikasi fitur QIIME2 digunakan untuk mengekstrak bacaan dari basis data silva-138-99 menggunakan parameter classifier-naive-Bayes. Klasifikasi dilakukan menggunakan Classification Sklearn. Metrik keanekaragaman dihitung menggunakan metode core-metrics-phylogenetic. QIIME2 digunakan untuk memvisualisasikan hasil, selain paket R phyloseq dan ggplot2. Indeks keanekaragaman alfa, seperti Chao1, Shannon, ACE, Simpson, InvSimpson, spesies yang diamati, dan uji pasti Fisher, digunakan untuk menilai kekayaan dan keanekaragaman komunitas. Gambar 1 menunjukkan diagram alur kerja analisis mikrobiota usus 16S.
2.7 Histomorfologi usus
Pemeriksaan histomorfometri dilakukan untuk menentukan apakah SeNPs mempengaruhi morfometri intestinal dari mukosa intestinal. Bagian tengah sampel jaringan intestinal setiap ikan (6 ikan/kelompok) difiksasi dalam formalin buffer netral 10% selama 24 jam, ditanamkan dalam lilin parafin, dan dipotong pada 5 μm. Slide yang dipilih secara rutin diwarnai dengan Hematoxylin dan Eosin (H&E), menurut Suvarna et al. ( 2018 ) untuk investigasi morfometri dan integritas. Slide yang diwarnai diperiksa di bawah mikroskop cahaya (Olympus CX 31) dan diambil menggunakan kamera yang terhubung (kamera digital Olympus DP 21) (Olympus Corporation, Tokyo, Jepang) untuk pengukuran histomorfometri. Morfometri intestinal, termasuk ketebalan dinding, panjang vili, lebar vili (VW), dan luas (VSA), dianalisis menggunakan perangkat lunak analisis gambar (Sigma Scan Pro5, SPSS INC) seperti yang dijelaskan sebelumnya oleh Islam et al. ( 2021 ). Lima vili tertinggi per bagian dideteksi dan dipilih untuk pengukuran. Tinggi vili (VH) per bagian dan panjang ujung ke bawah setiap vili diukur. Rata-rata pengukuran dinyatakan sebagai tinggi vili rata-rata per bagian (Pirarat et al., 2015 ).
2.8 Statistik data
Data dalam penelitian ini dikenai analisis varians satu arah (ANOVA) setelah dikenai pemeriksaan normalitas dan homogenitas menggunakan uji Kolmogorov–Smirnov dan Levene. Perangkat lunak Statistical Package for Social Sciences (SPSS) untuk Windows (IBM SPSS v22.0, Inc., 2010, Chicago, IL, AS) digunakan untuk melakukan analisis. Perbedaan antara rata-rata diuji menggunakan uji perbedaan signifikan jujur Tukey. Perbedaan dianggap signifikan secara statistik pada p < 0,05. Hasil disajikan sebagai rata-rata ± galat standar (SE).
3 HASIL
3.1 Efek suplementasi SeNPs makanan terhadap indeks kinerja pertumbuhan
Indeks pertumbuhan ikan yang menerima diet basal yang dilengkapi dengan diet SeNPs 0,75 dan SeNPs 1,5 selama 8 minggu ditunjukkan pada Tabel 2. FBW, PWG, dan SGR ikan nila yang diberi SeNPs pada konsentrasi 0,75 dan 1,5 mg/kg pakan kering meningkat secara signifikan dibandingkan dengan kelompok kontrol ( masing-masing p < 0,01, p < 0,001), tanpa perbedaan signifikan antara kedua kelompok ikan yang menerima diet yang dilengkapi dengan nanopartikel selenium. Yang menarik adalah angka pertambahan berat badan di akhir percobaan yang meningkat dari 14,07 ± 1,92 g/ikan pada kelompok ikan kontrol menjadi 55,85 ± 3,42 dan 63,52 ± 12,13 pada kelompok ikan yang menerima SeNP pada konsentrasi 0,75 dan 1,5 mg/kg pakan kering, masing-masing
| Kelompok | Indeks kinerja pertumbuhan | |||
|---|---|---|---|---|
| Bahasa Indonesia: IBW | FBW | PWG | SGR | |
| Kontrol | 57,60 ± 0,56 | 71,67 ± 2,36 miliar | 0,43 ± 0,06 miliar | 0,39 ± 0,05 miliar |
| SeNP 0,75 | 57,90 ± 0,92 | 113,75 ± 3,75 a ** | 1,72 ± 0,10 per tahun ** | 1,20 ± 0,05 a ** |
| SeNP 1.5 | 57,73 ± 0,45 | 121,25 ± 11,97 tahun ** | 1,97 ± 0,38 per tahun ** | 1,30 ± 0,19 per tahun *** |
Catatan : Ikan diberi makan dengan diet kontrol (Kontrol) atau dengan diet yang mengandung selenium nanopartikel biosintesis (SeNPs) pada 0,75 mg/kg SeNPs (SeNPs 0,75 ) atau 1,5 mg/kg SeNPs (SeNPs 1,5 ) selama 8 minggu. Semua data dinyatakan sebagai mean ± SEM ( n = 6/kelompok). Huruf superskrip yang berbeda pada nilai mean dalam kolom menunjukkan data yang berbeda secara statistik atau tidak signifikan. Tingkat signifikansi ditetapkan pada p < 0,05 (*), p < 0,01 (**), dan p < 0,001 (***). (IBW) berat badan awal; (FBW) berat badan akhir; (PWG) persen pertambahan berat badan = (pertambahan berat badan rata-rata * 100)/berat badan awal; (SGR) laju pertumbuhan spesifik = 100 × (LN(FBW) − LN(IBW))/56.
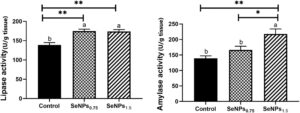
3.2 Efek suplementasi SeNPs makanan terhadap aktivitas lipase dan amilase
Aktivitas lipase dan amilase ditunjukkan pada Gambar 1. Kedua kelompok yang diberi suplemen menunjukkan aktivitas lipase yang lebih tinggi yang meningkat dari 138,7 ± 6,46 pada kelompok kontrol menjadi 174,9 ± 5,03 dan 174 ± 4,95 pada kelompok yang diberi suplemen SeNPs ( p < 0,01) tanpa perbedaan signifikan antara kedua kelompok SeNPs. Pengukuran aktivitas amilase mengambil tren yang sama karena meningkat secara signifikan dari 139,1 ± 8,05 dan 166,3 ± 11,97 pada kelompok kontrol ( p < 0,01) dan SeNPs 0,75 ( p < 0,05) menjadi 217,9 ± 16,1 pada kelompok ikan SeNPs 1,5 , tanpa perbedaan signifikan antara yang terakhir.
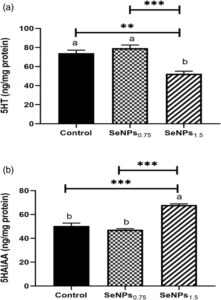
3.3 Tingkat serotonin dan metabolit usus
Tingkat serotonin usus dan metabolitnya ditunjukkan pada Gambar 2a,b . Tren yang berlawanan diamati untuk 5HT dan 5HIAA, di mana kelompok ikan SeNPs 1,5 menunjukkan penurunan signifikan dalam 5HT menjadi 52,5 ± 2,71 dari 79,38 ± 3,25 pada kelompok ikan SeNPs 0,75 ( p < 0,001) dan 74,15 ± 3,06 pada kelompok ikan kontrol ( p < 0,01), tanpa perbedaan statistik antara yang terakhir. Sebaliknya, tingkat 5HIAA menunjukkan peningkatan signifikan menjadi 68,03 ± 0,92 ( p < 0,001) pada kelompok ikan SeNPs 1,5 dari 47,33 ± 0,77 dan 50,4 ± 2,45 pada kelompok ikan SeNPs 0,75 dan kontrol, masing-masing, tanpa perbedaan signifikan di antara yang terakhir.
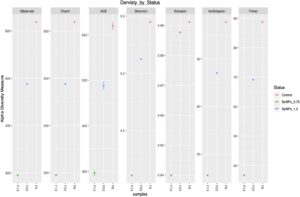
3.4 Analisis kekayaan dan keanekaragaman mikrobiota usus (analisis keanekaragaman alfa)
Indeks keanekaragaman alfa, yang mencakup keanekaragaman komunitas dan metrik kekayaan seperti Chao1, Shannon, ACE, Simpson, InvSimpson, spesies yang diamati, dan uji pasti Fisher terhadap kandungan mikrobiota usus ikan nila setelah suplementasi dengan SeNPs, diilustrasikan dalam Gambar 3. Hasil penelitian menunjukkan indeks Chao1, ACE, Shannon, Simpson, InvSimpson, dan Fisher yang secara signifikan lebih tinggi ( p < 0,05) pada kelompok kontrol dan SeNPs 1,5 dibandingkan pada kelompok SeNPs 0,75 .
3.5 Komposisi mikrobiota, analisis kelimpahan relatif, dan perbandingan
Dalam hal komposisi, kesamaan klasifikasi pembacaan sekuensing adalah ≥97%. Selain itu, tingkat keyakinan taksonomi keseluruhan adalah ≥0,70 (mendekati 1) (Tabel S1 ). Setelah uji coba pemberian pakan (8 minggu), suplementasi diet dengan SeNP mengubah perakitan isi mikroba usus pada ikan nila. Berdasarkan hasil klasifikasi, sekuens tersebut mengungkap 17 filum bakteri, 36 kelas bakteri, 76 ordo bakteri, 108 famili bakteri, 159 genus bakteri, dan 240 spesies bakteri.
3.5.1 Analisis mikrobiota usus pada tingkat taksonomi filum
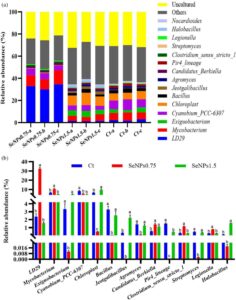
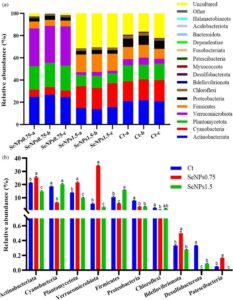
Gambar 4a menunjukkan kelimpahan 16 filum yang paling dominan di antara semua kelompok perlakuan, termasuk Actinobacteria, Cyanobacteria, Planctomycetota, Verrucomicrobiota, Firmicutes, Proteobacteria, Chloroflexi, Bdellovibrionota, Desulfobacterota, Myxococcota, Patescibacteria, Fusobacteriata, Dependentiae, Bacteroidetes, Acidobacteria, dan Halanaerobiaeota. Terlepas dari kelompok perlakuan, Actinobacteria adalah filum yang dominan, diikuti oleh Cyanobacteria, Planctomycetota, dan Verrucomicrobiota. Seperti yang ditunjukkan pada Gambar 6b , 10 filum yang paling dominan diperiksa berdasarkan perbedaan kelimpahan relatifnya. Hasil penelitian menunjukkan kelimpahan relatif yang signifikan lebih tinggi ( p < 0,05) dari filum Actinobacteria, Planctomycetes, Verrucomicrobiota, Bdellovibrionota, dan Patescibacteria dan kelimpahan relatif yang signifikan lebih rendah ( p < 0,05) dari filum Cyanobacteria, Firmicutes, Chloroflexi, dan Desulfobacterota pada kelompok SeNPs 0,75 , berbeda dengan hasil yang diperoleh pada kelompok kontrol dan SeNPs 1,5 (Gambar 4b ).
3.5.2 Analisis mikrobiota usus pada tingkat taksonomi genus
Gambar 5a menunjukkan 15 genera paling melimpah di antara semua kelompok perlakuan, termasuk LD29 , Mycobacterium , Exiguobacterium , Cyanobium_PCC-6307 , Chloroplast , Bacillus , Jeotgalibacillus , Agromyces , Candidatus Berkiella , Pir4 lineage , Clostridium sensu stricto 1 , Streptomyces , Legionella , Halobacillus , dan Nocardioides . Genus Mycobacterium memiliki kelimpahan relatif tertinggi terlepas dari kelompok perlakuan. Gambar 5b menunjukkan perbedaan dalam kelimpahan relatif antara genera yang paling melimpah. Di antara genera ini, kelimpahan relatif LD29 , Mycobacterium , Clostridium sensu stricto 1 , dan Legionella meningkat secara signifikan ( p < 0,05) dalam kelompok SeNPs 0,75 dibandingkan dengan kelompok kontrol dan SeNPs 1,5 . Berbeda dengan pengamatan yang dibuat untuk kelompok SeNPs 0,75 , kelimpahan genus Exiguobacterium , Bacillus , Agromyces , dan Streptomyces meningkat secara signifikan ( p <0,05) pada kelompok ikan kontrol dan SeNPs 1,5 . Tidak ada perbedaan signifikan ( p >0,05) antara kelompok kontrol dan SeNPs 1,5 mengenai kelimpahan relatif Exiguobacterium , Bacillus , Agromyces , dan Streptomyces . Lebih jauh lagi, kelimpahan relatif yang signifikan lebih tinggi ( p <0,05) dari genus Chloroplast , Jeotgalibacillus , dan Halobacillus diamati pada kelompok SeNPs 1,5 dibandingkan pada kelompok SeNPs 0,75 dan kontrol. Menariknya, peningkatan signifikan ( p <0,05) dalam kelimpahan Candidatus Berkiella diamati pada kelompok yang diberi suplemen SeNPs dibandingkan dengan kelompok kontrol.
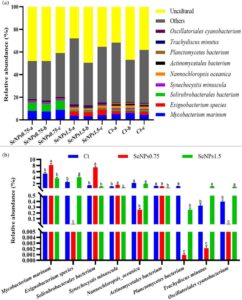
3.5.3 Analisis mikrobiota usus pada tingkat taksonomi spesies
Pada tingkat taksonomi spesies, spesies yang paling melimpah adalah Mycobacterium marinum , diikuti oleh bakteri Solirubrobacterales , spesies Exiguobacterium , Nannochloropsis oceanica , Synechocystis minuscula , bakteri Actinomycetales , bakteri Planctomycetes , Trachydiscus minutus , dan Oscillatoriales cyanobacterium (Gambar 6a ). Di antara spesies bakteri yang diamati, Mycobacterium marinum , bakteri Solirubrobacterales , dan Synechocystis minuscula secara signifikan lebih tinggi ( p < 0,05) dan spesies Exiguobacterium , Nannochloropsis oceanica , bakteri Planctomycetes , Trachydiscus minutus , dan Oscillatoriales cyanobacterium yang secara signifikan lebih rendah ( p < 0,05) diamati dalam kelompok SeNPs 0,75 daripada dalam kelompok kontrol dan SeNPs 1,5 . Selain itu, spesies bakteri Actinomycetales meningkat secara signifikan pada kelompok kontrol dan SeNPs 1,5 , dibandingkan dengan kelompok SeNPs 0,75 (Gambar 6b ).
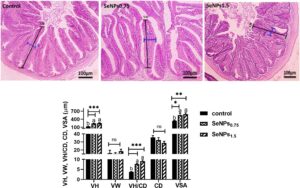
3.6 Histomorfometri usus
Pemeriksaan jaringan tengah-usus yang diwarnai tidak menunjukkan lesi patologis pada ikan nila yang diberi diet yang dilengkapi dengan SeNP pada kedua dosis (Gambar 7a ). Sebaliknya, peningkatan signifikan diamati pada ikan yang menerima SeNP dibandingkan dengan kelompok kontrol, dengan peningkatan hampir 3 kali lipat ( p < 0,001) pada tinggi vili/kedalaman kripta (VH/CD) dan peningkatan lebih dari 1,5 kali lipat ( p < 0,05, 0,01) pada VSA dan VH ( p < 0,001) (Gambar 7b ).
4 DISKUSI
Dalam penelitian saat ini, peningkatan signifikan dalam pertambahan berat badan tercatat pada ikan nila yang diberi suplemen SeNPs selama 8 minggu, yang hampir empat kali lipat dari ikan yang tidak menerima SeNPs. Hal ini sejalan dengan penelitian lain yang melaporkan hasil serupa tidak hanya pada ikan nila, tetapi juga pada spesies ikan lainnya. Misalnya, suplementasi makanan ikan nila Mozambik ( Oreochromis mossambicus ) dengan SeNPs pada 0,5, 1, dan 2 mg/kg untuk ikan nila Mozambik ( Oreochromis mossambicus ) selama 30 hari menghasilkan peningkatan sekitar 1,5 kali lipat dalam indeks pertumbuhan (Yazhiniprabha et al., 2022 ), dan peningkatan ~1,1 dan 1,5 kali lipat pada ikan nila yang diberi 1 g/kg dan 1,5 mg/kg selama 60 hari dan 8 minggu, masing-masing (Al-Deriny et al., 2020 ). Penelitian sebelumnya pada spesies ikan lain, seperti ikan trout pelangi ( Oncorhynchus mykiss ) (Naderi et al., 2017 ) dan ikan mas ( Cyprinus carpio ) (Ashouri et al., 2015 ) menunjukkan hasil yang serupa. Perbedaan dalam peningkatan pertambahan berat badan dapat dikaitkan dengan beberapa faktor, seperti metode sintesis SeNPs, dosis yang digunakan, usia ikan, dan durasi percobaan. Terlepas dari perbedaan ini, ada konsensus bahwa suplementasi SeNPs secara signifikan meningkatkan pertumbuhan ikan.
Mekanisme yang digunakan selenium untuk meningkatkan pertumbuhan ikan telah menjadi subjek banyak penelitian, tanpa ada kesimpulan tentang jalur bergantung-Se mana yang menyebabkan peningkatan berat badan. Salah satu mekanisme yang mungkin adalah bahwa Se, yang merupakan komponen enzim deiodinase, dapat mengkatalisis sekresi hormon pertumbuhan dari kelenjar pituitari, yang secara langsung terlibat dalam pertumbuhan (Chris et al., 2018 ; Çiçek & Özoğul, 2021 ). Laporan lain mengaitkan efek selenium pada pertumbuhan dengan kemampuannya untuk meningkatkan gen faktor pertumbuhan mirip insulin 1 (IGF-1) dan hormon ghrelin (Jahanbakhshi et al., 2021 ). Penelitian lain menghubungkan modulasi pertumbuhan Se dengan tindakan stimulasi langsungnya pada fungsi usus sebagai prekursor selenoprotein, yang meningkatkan sintesis dan sekresi enzim pencernaan (Abd El-Kader et al., 2020 ; Wang et al., 2013 ). Penjelasan lain yang masuk akal untuk efek suplementasi Se diberikan oleh Dawood et al. ( 2020 ) dan Shi et al. ( 2011 ), yang melaporkan Se sebagai faktor penting yang memengaruhi komposisi mikrobioma usus. Untuk tujuan ini, dalam penelitian saat ini, kami mencoba menjelaskan perubahan yang menyertai suplementasi selenium dalam makanan ikan nila, ikan yang dibudidayakan di seluruh dunia.
Studi saat ini menunjukkan peningkatan signifikan dalam aktivitas amilase dan lipase pada kelompok ikan SeNPs1.5 dan hanya lipase pada kelompok ikan SeNPs0.75, dibandingkan dengan kelompok kontrol. Studi terbaru telah meneliti fungsi signifikan selenium sebagai koenzim dalam sintesis enzim pencernaan dan peningkatan protein intraseluler usus. Fungsionalitas enzim ini memfasilitasi pencernaan nutrisi oleh sel epitel usus (Çiçek & Özoğul, 2021 ; Dawood et al., 2019 ), yang akan ditunjukkan di bagian berikut. Namun, apakah peningkatan aktivitas enzim secara langsung terkait dengan kandungan Se yang tinggi dalam usus atau secara tidak langsung melalui efek sistematis Se pada organ lain yang terlibat dalam pencernaan dan metabolisme (misalnya, pankreas dan hati) masih harus dijelaskan.
Dalam studi terkini, penurunan signifikan serotonin (5HT) dan peningkatan signifikan metabolitnya 5HIAA tampak pada kelompok ikan yang menerima dosis SeNPs tinggi dibandingkan dengan dua kelompok lainnya. Temuan ini menyiratkan bahwa dosis Se tinggi mempercepat konversi 5HT menjadi bentuk aktifnya, 5HIAA. 5-HIAA mengatur peristaltik (Camilleri, 2009 ), yang dapat memengaruhi penyerapan nutrisi. Dalam konteks yang sama, 5-HIAA dapat memengaruhi mikrobiota usus dengan bertindak sebagai ligan untuk reseptor hidrokarbon aril pseudo-endogen (AHR) yang ada pada beberapa spesies mikroba dalam mikrobioma usus, sehingga menambah keragaman mikroba usus (Dong & Perdew, 2020 ).
Sedikit yang diketahui tentang komposisi mikrobioma usus pada ikan nila atau efek pemberian SeNP pada komposisinya. Seperti spesies ikan lainnya, keragaman mikroba bervariasi secara dinamis tergantung pada habitat inang, usia, tahap perkembangan, susunan genetik, suhu, dan makanan (Amoah et al., 2023 ; Amoah, Liu, et al., 2021 ; Fan et al., 2017 ). Keragaman mikroba pada kelompok kontrol dalam penelitian ini dapat dianggap sebagai dasar untuk ikan nila pada usia yang sama dan dipelihara dalam kondisi yang sama. Penelitian lain tentang mikrobioma usus ikan nila dilakukan pada kelompok usia yang berbeda (misalnya, burayak, Giatsis et al., 2015 ) dan habitat (misalnya, danau luas, Bereded et al., 2020 ), dan melaporkan kelas dan genus bakteri yang sama seperti dalam penelitian kami, meskipun dalam kelimpahan yang berbeda. Dalam penelitian ini, suplementasi dengan SeNP memengaruhi keragaman mikroba usus. Terlepas dari konsentrasi SeNP, Actinobacteria (filum yang paling umum), Cyanobacteria, Plantomycetota, Verrucomicrobiota, Firmicutes, Proteobacteria, Chloroflexi, Bdellovibrionota, Desulfobacterota, dan Patescibacteria merupakan filum yang paling melimpah. Kelompok SeNPs 0,75 menunjukkan kelimpahan relatif yang lebih tinggi secara signifikan ( p < 0,05) dari filum Actinobacteria, Plantomycetota, Verrucomicrobiota, Bdellovibrionota, dan Patescibacteria dan kelimpahan relatif yang lebih rendah secara signifikan ( p < 0,05) dari filum Cyanobacteria, Firmicutes, Chloroflexi, dan Desulfobacterota. Namun, kelompok ikan yang diberi suplemen SeNPs 1,5 menunjukkan hasil yang kontras. Karena ini adalah studi pertama yang menunjukkan efek berbagai tingkat SeNP pada komposisi mikroba usus ikan nila, studi lebih lanjut diperlukan untuk memastikan peran Se dalam mendorong perubahan ini. Tren serupa dilaporkan pada tikus yang menerima suplementasi SeNPs dari makanan dan terpapar herbisida diquat. Peningkatan signifikan diamati dalam kelimpahan relatif Patescibacteria, Cyanobacteria, dan Verrucomicrobiota dan penurunan dalam kelimpahan relatif Firmicutes.
Kelimpahan relatif dari genus Exiguobacterium , Bacillus , Agromyces , dan Streptomyces secara signifikan lebih tinggi pada kelompok ikan kontrol dan SeNPs 1.5 dibandingkan pada kelompok SeNPs 0.75 . Selain itu, kelompok SeNPs 1.5 memiliki kelimpahan genus Chloroplast , Jeotgalibacillus , dan Halobacillus yang secara signifikan lebih tinggi ( p < 0.05) dibandingkan kelompok lainnya. Kelompok yang diberi suplemen SeNP memiliki Candidatus Berkiella yang secara signifikan lebih banyak dibandingkan kelompok Ct. Exiguobacterium , Jeotgalibacillus, Halobacillus , dan Clostridium sensu stricto 1 adalah genus yang kurang dieksplorasi; namun, sebagian besar galur dari genus ini memiliki sifat yang menarik dalam bioremediasi, bioteknologi, kedokteran, farmasi, pertanian, dan proses industri. Beberapa Mycobacterium , Legionella , dan Candidatus Berkiella adalah patogen oportunistik. Anggota genus Bacillus digunakan sebagai probiotik untuk meningkatkan pertumbuhan, pemanfaatan pakan, respons imun, dan ketahanan terhadap penyakit pada ikan (Amoah et al., 2023 ; Amoah, Dong, et al., 2021 ; Buruiană et al., 2014 ; Kuebutornye et al., 2020 ; Soltani et al., 2019 ). Agromyces , yang termasuk dalam famili Microbacteriaceae dan ordo Micrococcales, diketahui memiliki khasiat obat. Streptomyces sp. menunjukkan aktivitas nematosida (Ma et al., 2017 ; Park et al., 2020 ). Spesies Jeotgalibacillus , seperti Jeotgalibacillus proteolyticus sp. nov., menunjukkan karakteristik pemacu pertumbuhan dan aktivitas antijamur (Desale et al., 2014 ). Genus Mycobacterium mencakup sekelompok besar spesies bakteri gram positif, berbentuk batang, tahan asam, dan beberapa spesiesnya bersifat patogen bagi ikan. Di antara spesies-spesies ini, M. marinum ( yang diamati dalam penelitian saat ini) merupakan penyakit zoonosis (Hashish et al., 2018 ). Sebagian besar anggota genus Legionella menyebabkan infeksi berat (Viasus et al., 2022 ). Se makanan dan SeNP bakteri telah dilaporkan membentuk komposisi mikroba dengan meningkatkan secara signifikan kandungan bakteri menguntungkan, seperti bakteri asam laktat, dan secara signifikan menurunkan kandungan patogen oportunistik yang diketahui, seperti Salmonella.(Al-Quwaie, 2023 ). Selain itu, peningkatan mikroba usus meningkatkan penyerapan nutrisi (Rehman et al. Rehman et al., 2022 ). Dalam penelitian sebelumnya, kelimpahan genera yang bermanfaat secara signifikan lebih tinggi, termasuk Akkermansia , Bacteroides , dan Parabacteroides , dan kelimpahan genera Helicobacter dan Ileibacterium yang dilaporkan patogen secara signifikan lebih rendah diamati setelah suplementasi dengan SeNP yang memadai pada tikus (Qiao et al., 2022 ). SeNP makanan yang disintesis oleh Lactobacillus casei ATCC 393 juga membentuk mikrobiota usus pada tikus dengan meningkatkan kelimpahan bakteri probiotik penghasil asam lemak rantai pendek, yang dikaitkan dengan peningkatan aktivitas enzim antioksidan (Qiao et al., 2020 ). Sayangnya, ada informasi terbatas mengenai penggunaan SeNP dalam akuakultur, dan tidak ada penelitian yang telah dilakukan tentang efeknya pada perubahan mikrobiota usus pada ikan nila.
Suplementasi diet dengan SeNP secara signifikan meningkatkan VH, VH/CD, dan VSA dibandingkan dengan kelompok kontrol, dan tidak ada lesi patologis yang diamati. Temuan ini menunjukkan peran potensial suplementasi diet SeNP dalam meningkatkan luas permukaan mukosa usus, sehingga meningkatkan penyerapan nutrisi. Temuan kami selanjutnya mengonfirmasi temuan Ghaniem et al. ( 2022 ), yang melaporkan bahwa suplementasi pakan dengan selenium, terlepas dari bentuknya, menyebabkan peningkatan tinggi vili dan kedalaman kripta pada ikan nila. Jumlah temuan histologis dari penelitian ini dengan jelas menunjukkan bahwa usus ikan yang menerima SeNP memiliki peningkatan luas permukaan untuk penyerapan, yang secara langsung disebabkan oleh peningkatan kadar selenium di usus atau secara tidak langsung melalui komposisi mikrobiota usus yang dimodifikasi, yang diketahui memengaruhi ukuran vili usus (Khajeh Bami et al., 2022 ; Tang et al., 2020 ) masih harus diselidiki.
5 KESIMPULAN
Studi ini dilakukan untuk mengevaluasi potensi SeNPs sebagai suplemen makanan untuk meningkatkan pertumbuhan ikan nila budidaya dan menjelaskan perubahan pada saluran usus yang terkait dengan pemberian Se. Hasil kami dengan jelas menunjukkan bahwa suplementasi SeNPs algogenik dalam makanan meningkatkan pertumbuhan, meningkatkan aktivitas enzim pencernaan, meningkatkan luas permukaan mukosa usus, dan memberikan pengaruh yang menguntungkan pada komposisi mikrobiota usus. Oleh karena itu, kami merekomendasikan penggunaan suplementasi pakan SeNPs untuk meningkatkan produksi ikan dan untuk meningkatkan keberlanjutan akuakultur untuk ikan nila.



