ABSTRAK
Sistem akuakultur resirkulasi parsial (PRAS) bertujuan untuk menggabungkan manfaat sistem aliran-melalui (penggunaan air sekitar 50.000 L kg −1 pakan) dan sistem akuakultur resirkulasi (RAS, 500–1000 L kg −1 pakan). Meskipun kualitas air biasanya sangat baik dalam sistem aliran-melalui, volume air yang besar dengan kualitas yang baik diperlukan. Dalam RAS, biaya investasi dan produksi bisa tinggi, dan karena tindakan mikroba yang biasanya terjadi dalam RAS, rasa yang tidak enak dapat terjadi dan terakumulasi dalam daging ikan. Di sini, evaluasi antara tiga tingkat pembaruan air (4000, 2000 dan 1000 L kg −1 pakan) dari PRAS dilakukan. Dalam percobaan, ikan trout pelangi Oncorhynchus mykiss dibesarkan dalam PRAS yang serupa. Pertumbuhan ikan dan berbagai parameter kualitas air dipantau, termasuk 14 senyawa rasa yang tidak enak dalam air yang bersirkulasi, dalam air masuk dan dalam daging ikan. Hasilnya tidak menunjukkan perbedaan statistik dalam rasio konversi pakan (FCR), laju pertumbuhan spesifik (SGR), dan mortalitas antara pembaruan air 2000 dan 4000 L kg −1 pakan, sementara pertumbuhan yang berkurang diamati pada 1000 L kg −1 pakan. Selain itu, total amonia nitrogen (TAN) dan nitrit–nitrogen (NO 2 ─N) meningkat pada laju pembaruan air yang berkurang dari 1000 dan 2000 L kg −1 pakan ( p < 0,005). Konsentrasi off-flavour tetap rendah dalam air yang bersirkulasi, tetapi dalam air yang bersirkulasi dan dalam daging ikan, mereka berada di atas ambang batas sensorik yang diketahui pada 1000 L kg −1 . Secara keseluruhan, hasilnya menunjukkan bahwa pakan 2000 L kg −1 memberikan pertumbuhan ikan yang baik, penggunaan pakan, dan mortalitas yang rendah tanpa akumulasi off-flavour yang tidak diinginkan.
1 Pendahuluan
Sistem akuakultur berbasis daratan secara garis besar dapat dibagi menjadi dua kelompok utama: sistem aliran-melalui dan sistem akuakultur resirkulasi (RAS). Peternakan ikan air tawar tradisional beroperasi menggunakan sistem aliran-melalui, yang memiliki tingkat pembaruan air yang tinggi (50.000 L kg −1 pakan; Vasquez-Mejia et al. 2023 ; Vielma et al. 2022 ) tetapi tidak menerapkan pengolahan air kecuali penggunaan oksigenasi air sesekali (Tahar et al. 2018 ). Di sisi lain, dalam RAS penuh, air akuakultur dibersihkan dalam banyak langkah proses (misalnya, penghilangan partikel dengan filter drum dan pemisah pusaran, senyawa nitrogen yang ditransformasikan dalam biofilter dan penghilangan CO 2 melalui filter tetes) dan disirkulasikan kembali ke sistem. Umumnya, sekitar 5% volume air diganti dalam RAS (pembaruan air 500–1000 L kg −1 pakan; Timmons et al. 2018 ), meskipun tingkat pertukaran air mendekati 0 telah dilaporkan (< 1%, Yogev et al. 2017 ; 2,1%, Gullian-Klanian dan Arámburu-Adame 2013 ).
Dalam sistem flow-through, kualitas air bergantung pada sumber air, biasanya diambil dari sungai atau danau. Volume air yang besar diperlukan yang menimbulkan kekhawatiran mengenai ketersediaan air yang sesuai dengan kualitas tinggi. Selain itu, izin lingkungan dengan batasan pelepasan nutrisi yang diizinkan dapat membatasi penggunaan flow-through. Di sisi lain, dalam RAS, biaya investasi dan manajemen tinggi, proses pemeliharaan rumit, dan produksinya intensif energi (Twibell dan Barron 2024 ). Selain itu, RAS lebih rentan terhadap pembentukan off-flavour karena metabolisme mikroba dan akumulasi dalam daging ikan, dan bahkan pertumbuhan yang berkurang telah diamati dalam RAS yang mengurangi profitabilitas produksi (Summerfelt et al. 2015 ; Mota et al. 2015 ).
Sistem akuakultur resirkulasi parsial (PRAS) menggabungkan metode pemeliharaan RAS dan flow-through (penggunaan air dalam kisaran 1000–5000 L kg −1 pakan), dan dalam skenario terbaik, sistem ini dapat menggabungkan manfaat keduanya. Umumnya, PRAS tidak menggunakan filtrasi biologis, dan laju pembaruan air harus memadai untuk menjaga kadar oksigen, karbon dioksida, dan nitrogen amonia agar sesuai untuk spesies ikan tertentu. Dalam beberapa tahun terakhir, sistem flow-through hibrida telah muncul di pasaran yang setara dengan PRAS tetapi dengan laju daur ulang air yang rendah sekitar 40%–70%.
Sistem akuakultur resirkulasi parsial dikembangkan secara paralel dengan sistem resirkulasi pada awal tahun 2000-an. Dalam beberapa tahun terakhir, pengembangan PRAS telah mendapat dorongan baru oleh keberhasilan produksi salmon. Ikan trout pelangi dipelihara di peternakan PRAS komersial terutama di Denmark (Danmarks Statistik 2025 ), tetapi juga di Jerman (Sindilariu et al. 2009 ) dan Amerika Serikat ( West 2010 ).
Penggunaan air yang lebih tinggi pada PRAS memungkinkan produksi tanpa biofilter yang berarti biaya investasi berkurang dan bahkan senyawa dengan rasa tidak enak berkurang karena biofilter telah dilaporkan sebagai salah satu titik panas untuk pembentukan rasa tidak enak pada RAS (Podduturi et al. 2017, 2020 ). Namun, penggunaan air yang lebih tinggi membuat pengolahan air limbah menjadi lebih sulit tetapi juga menimbulkan biaya tambahan untuk pengolahan air masuk dan pengendalian suhu.
Tanpa biofilter, nitrifikasi terbatas pada permukaan yang menampung bakteri autotrofik (Summerfelt et al. 2004 ), dan volume air pengganti yang cukup diperlukan untuk mempertahankan nitrogen amonia bebas pada tingkat yang rendah dan tidak beracun untuk spesies yang dibesarkan (12,5–30 µg L −1 ; Timmons et al. 2018 ). Tanpa biofilter, pengaktifan sistem lebih cepat daripada dalam RAS yang biasanya menggunakan satu atau beberapa biofilter (4–10 minggu untuk membangun nitrifikasi biofilter; Summerfelt et al. 2009 ). Ini juga dapat memungkinkan penggunaan disinfektan berbasis klorin bila diperlukan untuk biosekuriti (Summerfelt et al. 2009 ; Waldrop et al. 2009 ). Lebih jauh lagi, PRAS dengan tangki pembuangan ganda telah ditemukan dapat meningkatkan produksi ikan (Summerfelt et al. 2009 ). Desain tangki memungkinkan pembuangan pakan limbah dan partikel lainnya, bertindak sebagai pemisah pusaran (Summerfelt et al. 2004 ) dan mendukung pemeliharaan kualitas air yang baik (Vinci et al. 2004 ).
PRAS yang disederhanakan memungkinkan pengurangan biaya, misalnya, dalam penyesuaian pH, penambahan oksigen, dan konsumsi listrik. Misalnya, konsumsi energi adalah 4,23 kW kg −1 pakan dalam PRAS, sedangkan konsumsi energi adalah 5,70 kW kg −1 pakan dalam RAS ( Oncorhynchus mykiss di air tawar; Kiuru et al. 2022 ). Selain itu, kapasitas penuh dapat digunakan sejak awal sistem, dan bahkan perubahan cepat dalam pemberian pakan pun dimungkinkan. Berdasarkan hal ini, PRAS memiliki potensi besar dalam kultur salmonid (Summerfelt et al. 2015 ).
Dalam penelitian kami sebelumnya pada tahun 2020–2021 (data yang tidak dipublikasikan), pertumbuhan yang sangat baik diamati untuk ikan trout pelangi O. mykiss —laju pertumbuhan spesifik (SGR) 0,95%–1,50% (berat akhir 1270–3410 g) dan rasio konversi pakan yang sangat baik (FCR 0,83–0,98 untuk 1270–3410 g)—dalam PRAS dengan mortalitas rendah (1,8%–6,3% pada tahun 2020, 0,1%–1,7% pada tahun 2021). Lebih jauh lagi, konsentrasi off-flavour berada di bawah batas sensoris yang diketahui dalam air dan dalam daging ikan (Lindholm-Lehto dan Kiuru 2024 ). Sebagai perbandingan, Summerfelt et al. ( 2004 ) melaporkan FCR 1,0–1,3 dan SGR 1,32%–2,45% untuk ikan trout pelangi dan ikan char Arktik muda Salvelinus alpinus (dari 15 hingga 294 g) di PRAS, sementara Twibell dan Barron ( 2024 ) melaporkan SGR sebesar 1,72% dan kelangsungan hidup 100% untuk ikan salmon Chinook musim semi ( Oncorhynchus tshawytscha ) seberat 5,2–55 g.
Dalam sistem akuakultur dengan tingkat pembaruan air yang rendah, rasa tidak enak dapat terbentuk karena aktivitas mikroba dalam air akuakultur dan terakumulasi dalam jaringan otot ikan (Auffret et al. 2011 ). Rasa tidak enak biasanya diproduksi sebagai produk sampingan metabolisme dari berbagai spesies mikroba, seperti Cyanobacteria , Actinobacteria , Myxobacteria, dan Sorangium (Lukassen et al. 2017 ; Mahmoud dan Magdy 2021 ). Rasa tidak enak yang dirasakan pada ikan sering kali digambarkan sebagai rasa dan bau apek dan tanah yang tidak disukai oleh konsumen ikan (Lindholm-Lehto et al. 2023 ). Rasa-rasa ini biasanya disebabkan oleh senyawa terpenoid geosmin (GSM) dan 2-methylisoborneol (MIB) (Gerber 1968, 1969 ), meskipun berbagai senyawa lain juga diketahui menyebabkan rasa yang tidak diinginkan pada ikan, termasuk alkohol, aldehida, asam karboksilat, pirazin, dan terpena (Podduturi et al. 2017, 2021 ; Mahmoud dan Buettner 2017 ; Lindholm-Lehto 2022 ).
Bahasa Indonesia : Dalam penelitian kami sebelumnya (Lindholm-Lehto dan Kiuru 2024 ), pembersihan off-flavour dipelajari secara ekstensif pada otot ikan dan dalam air yang bersirkulasi ulang dari PRAS dan RAS. Di sini, tujuan kami adalah untuk berkonsentrasi pada pertumbuhan ikan, penggunaan pakan dan kualitas air di PRAS, termasuk pembentukan off-flavour pada tingkat pertukaran air yang berbeda. Penelitian ini memiliki dua tujuan utama: (1) Pertama, mempelajari nilai batas bawah untuk tingkat pertukaran air yang cocok untuk ikan trout pelangi yang dibesarkan di PRAS, dan (2) memeriksa apakah konsentrasi total amonia nitrogen (TAN) yang sedikit meningkat meningkatkan pertumbuhan ikan dan FCR. Kami berhipotesis bahwa pertumbuhan ikan dan kualitas air secara keseluruhan akan tetap baik pada semua tingkat pertukaran air yang dipelajari, dan konsentrasi TAN yang sedikit meningkat akan meningkatkan pertumbuhan ikan dan pemanfaatan pakan.
2 Bahan dan Metode
2.1 Desain Eksperimen
Desain eksperimen dilakukan dalam enam sistem individual yang terletak di tambak ikan Laukaa dari Natural Resources Institute Finland (Luke) seperti yang dijelaskan dalam Lindholm-Lehto dan Kiuru ( 2024 ). Singkatnya, setiap sistem terdiri dari tangki tipe Cornell dengan drainase bawah 600 L dengan pembuangan air melalui drainase bawah, sementara aliran drainase samping dipompa pada 2,5 L s −1 dengan pompa pengangkat udara sebagai unit aerasi. Udara disuplai ke keenam pengangkat udara dari satu blower saluran samping (FPZ, Concorezzo, Italia, K04 MS, 0,75–0,90 kW). Partikel padat dihilangkan dengan pengendap aliran radial tertutup di drainase aliran keluar.
Biofilter tidak digunakan. Akumulasi spesies nitrogen beracun dihindari dengan peningkatan laju pertukaran air dan penambahan hidrogen peroksida (H 2 O 2 ), yang dengan cepat mengoksidasi nitrit menjadi nitrat (J. Wang et al. 2017 ). Penambahan oksigen tidak diperlukan karena unit aerasi khusus tangki dan laju pertukaran air yang relatif tinggi. Oksigen terlarut dipantau setiap hari dengan meter genggam dan dipertahankan pada 9,2 ± 0,6 mg L −1 dan CO 2 pada 7,5 ± 2,4 mg L −1 , dipantau dengan pengukuran daring. Suhu diukur setiap hari (13,7 ± 1,2 °C) dengan termometer genggam (Traceable, VWR International, Helsinki, Finlandia). pH dalam sistem dipertahankan di bawah 6,8 dengan menyesuaikan penghilangan CO 2 . Lampu tetap menyala 24 jam per hari di tangki pemeliharaan.
Air masuk dialirkan tanpa diolah dari Danau Peurunka yang oligotrofik (62.44886, 25.85201, luas 694 ha, 59.600 m 3 , pH rata-rata 6,7). Suhu tahunan rata-rata di area tersebut adalah 4°C, dan curah hujan tahunan adalah 600 mm (Institut Meteorologi Finlandia 2023 ). Air masuk diambil sebagai campuran 1:1 air permukaan (kedalaman 3 m) dan dari lapisan afotik (kedalaman 8 m). Suhu air masuk disesuaikan dengan menggunakan penukar kalor pelat dan pemanas listrik (Alfa Laval 3×3 kW, Alfa Laval Nordic, Aalborg, Denmark) dan dialirkan ke setiap PRAS pada laju 0,2–1,3 L min −1 .
Kualitas air dipantau secara teratur dengan uji kualitas air mingguan dari TAN, nitrit-nitrogen (NO 2 ─ N) dan kebutuhan oksigen kimia (COD) menggunakan uji spektrofotometri cepat (Prosedur 8038 Nessler, LCK341/342, LCK340 dan LCK349 berturut-turut, DS 3900, Hach Lange, AS) dan H 2 O 2 bebas dengan strip uji peroksida kolorimetri (1–25 mg L −1 , MQuant, Merck, Darmstadt, Jerman). Selain itu, O 2 terlarut (Handheld YSI Pro20, Yellow Springs, AS), konsentrasi CO 2 dan suhu diukur dengan sensor genggam (S/N 1638, Franatech, Jerman), dan laju aliran air masuk disesuaikan secara manual seminggu sekali (DDI-222, Grundfos, Denmark). Alkalinitas diukur menggunakan metode titrasi standar (ISO 9963–1:1994, TitraLab AT1000, Hach, Loveland, AS).
Senyawa off-flavour yang dipilih (Tabel S1–S3 ) dikuantifikasi dengan metode analisis mikroekstraksi fase padat otomatis dan spektrometri gas dengan spektrometri massa tandem quadrupole rangkap tiga (SPME-GC-QQQ) seperti yang dilaporkan sebelumnya di Lindholm-Lehto ( 2022 ).
2.2 Ikan dan Makanannya
Penelitian ini mengikuti protokol yang disetujui oleh Komite Perawatan Hewan Luke, Helsinki, Finlandia, dan Arahan UE 2010/63/EU untuk percobaan hewan.
Secara total, 515 ekor ikan trout pelangi dengan berat rata-rata 252 ± 6,1 g (86 ekor per tangki) dari program pengembangbiakan Nasional Finlandia (Jalo) (kelas tahun 2022) dipelajari dalam percobaan tersebut. Sebelum percobaan, ikan tersebut diobati dengan Limoxin WS (1000 mg g −1 ) terhadap Flavobacterium ( Flavobacterium psychrophilum ) dan ditemukan sehat oleh dokter hewan sebelum percobaan dimulai.
Ikan diberi makan dengan sistem pemberian makan otomatis (T Drum 2000, Arvo-Tec, Huutokoski, Finlandia) dengan pakan ikan komersial (4,5 mm Crystal Astax, Alltech Fennoaqua Oy, Raisio, Finlandia) yang mengandung 43% protein, 28% lemak kasar, 2,1% serat kasar, 5,9% abu, 1,05% kalsium, 0,95% fosfor, dan 0,6% natrium seperti yang dilaporkan oleh produsen. Pakan diberikan terus-menerus 48 kali sehari. Ikan diperiksa secara visual setiap hari, dan kematian (jika ada) disingkirkan dan dicatat.
Ikan ditimbang sebelum dan sesudah percobaan (Hari ke-0 dan Hari ke-62), dan sekali selama percobaan (setelah 33 hari). Penimbangan ikan dilakukan secara berkelompok per tangki pemeliharaan, dan jumlah individu dihitung. Namun, berat masing-masing individu dan distribusi berat kelompok tidak ditentukan. Berat ikan yang mati dihitung sebagai rata-rata penimbangan awal dan akhir per fase dan ditambahkan ke pertumbuhan tangki.
2.3 Pengaturan Eksperimen
Ikan dipindahkan dari sistem resirkulasi (dijelaskan dalam Pulkkinen et al. 2021 ) ke enam PRAS serupa (sebagaimana dijelaskan dalam Bagian 2.1 ) untuk mencapai kepadatan ikan sebesar 36 kg m −3 (dimensi menurut Summerfelt et al. 2004 ) dan biomassa sebesar 22 kg di setiap sistem sebelum dimulainya percobaan. Tujuannya adalah untuk melipatgandakan berat ikan selama percobaan. Sebelum percobaan dimulai, ikan diaklimatisasi ke unit eksperimen baru selama 5 minggu. Selama periode aklimatisasi, ikan diberi diet terbatas sebesar 1%. Laju pertukaran air dijaga pada 4000 L kg −1 pakan di semua sistem.
Percobaan berlangsung dari akhir Februari hingga awal Mei (28 Februari hingga 2 Mei). Untuk percobaan, laju pertukaran air disesuaikan menjadi 4000, 2000 dan 1000 L kg −1 pakan, masing-masing dua sistem. Laju pertukaran air dipantau dan disesuaikan berdasarkan rata-rata pemberian pakan dalam seminggu.
Hidrogen peroksida (H 2 O 2 , Bang & Bonsomer Group Oy, Helsinki, Finlandia, 10 mg H 2 O 2 L −1 ) dipompa (Model PO 743–822S2, Milton Roy, Warminster, PA, AS) ke air masuk PRAS berdasarkan volume air masuk dan laju pembaruan air yang dipilih. Pertama, H 2 O 2 (larutan 25%) ditambahkan ke air masuk keenam PRAS (umpan 4000 L kg −1 , 71–97 mL H 2 O 2 hari −1 ; umpan 2000 L kg −1 , 35–48 mL H 2 O 2 hari −1 ; umpan 1000 L kg −1 , 18–22 mL H 2 O 2 hari −1 ; Tabel S4 ).
Selain itu, larutan H 2 O 2 5% ditambahkan (4000 L kg −1 pakan, 12 mL h −1 ; 2000 L kg −1 pakan, 41 mL h −1 ; 1000 L kg −1 pakan, 56 mL h −1 ). H 2 O 2 yang tersisa di setiap tangki dipantau dan dicatat (strip uji peroksida kolorimetrik, MQuant, Merck, Darmstadt, Jerman). Volume air pengganti, penambahan larutan H 2 O 2 dengan air masuk, dan H 2 O 2 tambahan disesuaikan dan diubah selama percobaan karena jumlah pakan bervariasi dengan biomassa dan pertumbuhan ikan (Tabel S4 ). H 2 O 2 dipertahankan pada 3,7 ± 0,8 mg L −1
2.4 Pengambilan sampel
Ikan-ikan tersebut diambil sampelnya sekali selama percobaan dan di akhir percobaan dari tangki pemeliharaan untuk analisis lebih lanjut. Tiga ekor ikan dipilih secara acak dan disuntik mati secara manusiawi dengan pukulan keras di kepala. Ikan-ikan tersebut ditimbang, dikeluarkan isi perutnya, difilet, dan diambil sampelnya dari bagian lateral filet seperti yang ditunjukkan dalam Hathurusingha dan Davey ( 2016 ). Ikan-ikan tersebut disimpan pada suhu -22°C hingga dilakukan analisis. Sampel gabungan dari tiga individu digunakan untuk analisis rasa tidak enak.
Sampel air diambil setiap minggu untuk memantau kualitas air seperti yang dijelaskan di Bagian 2.1 . Selain itu, air diambil sampelnya dari air masuk dan tangki pemeliharaan dan disimpan dalam botol HDPE 250 mL pada suhu -22°C untuk analisis rasa tidak enak.
2.5 Analisis Statistik
Analisis statistik dilakukan dengan IBM SPSS Statistics for Windows, Versi 27.0.1.0 (IBM Corporation, dirilis 2020, Armonk, AS). Analisis model campuran linier dilakukan untuk mempelajari perbedaan statistik dalam parameter kualitas air, rasa tidak enak pada otot ikan, penggunaan pakan, dan pertumbuhan antara sistem dengan penggantian air sebanyak 4000, 2000, dan 1000 L kg −1 pakan. Interval kepercayaan ditetapkan pada 95%.
3 Hasil
3.1 Pertumbuhan dan Kualitas Air
Selama percobaan, biomassa rata-rata meningkat dari rata-rata 21,8 ± 6,1 kg per tangki (87 ± 2 individu per tangki, 252 ± 6,1 g) menjadi 46,6 ± 3,5 kg (79 ± 3 individu per tangki, 589 ± 34 g; Tabel 1 ). Mortalitas tetap sangat rendah selama percobaan, tidak termasuk PRAS 3 dengan mortalitas 8% pada Fase 1 (Tabel 1 ). Namun, perbedaan signifikan tidak ditemukan antara tingkat pembaruan air yang berbeda ( p > 0,05; Tabel S5 ).
| Air (L kg −1 pakan) | Biomassa (kg) | Berat rata-rata (g) | Individu (tidak ada) | Angka Kematian (%) | ||
|---|---|---|---|---|---|---|
| Tahap 1 | ||||||
| PRAS 1 | 4000 | 21,8→32,6 | 250→403 | 87→85 | 2.3 | |
| PRAS 2 | tahun 2000 | 21,6→31,9 | 254→399 | 84→83 | 1.2 | |
| PRAS 3 | 1000 | 21,8→29,0 | 248→372 | 88→81 | 8.0 | |
| PRAS 4 | 4000 | 21,9→33,2 | 258→409 | 84→83 | 1.2 | |
| PRAS 5 | tahun 2000 | 21,9→33,2 | 243→382 | 88→88 | 0.0 | |
| PRAS 6 | 1000 | 21.9→31.1 | 258→388 | 84→82 | 2.4 | |
| Tahap 2 | ||||||
| PRAS 1 | 4000 | 32,6→49,4 | 403→617 | 81→81 | 0.0 | |
| PRAS 2 | tahun 2000 | 31,9→46,7 | 399→607 | 79→77 | 2.5 | |
| PRAS 3 | 1000 | 29,0→40,5 | 372→533 | 77→76 | 1.3 | |
| PRAS 4 | 4000 | 33.2→49.3 | 409→624 | 80→79 | 1.3 | |
| PRAS 5 | tahun 2000 | 33.2→49.3 | 382→580 | 85→85 | 0.0 | |
| PRAS 6 | 1000 | 31.1→44.7 | 388→573 | 79→78 | 1.3 | |
FCR rata-rata adalah 0,92, tanpa perbedaan signifikan ( p > 0,05) antara sistem dengan laju pembaruan air yang berbeda (Gambar 1A ; Tabel S5 ). Di sisi lain, SGR rata-rata adalah 1,35, dengan perbedaan signifikan ( p < 0,05) antara sistem dengan 1000 dan 4000 L kg −1 umpan dan antara 1000 dan 2000 L kg −1 pada fase kedua (Gambar 1B ; Tabel S5 ).

Konsentrasi TAN berkisar antara 5,3 hingga 20,7 mg L −1 , dan TAN tak terionisasi berkisar antara 3 hingga 46 µg L −1 , dengan konsentrasi tertinggi terjadi pada laju pembaruan air 1000 L kg −1 pakan (Gambar 2A,B ). Perbedaan signifikan dalam TAN ( p = 0,001) dan amonia ditemukan di antara ketiga sistem laju pembaruan air (Tabel S5 ).
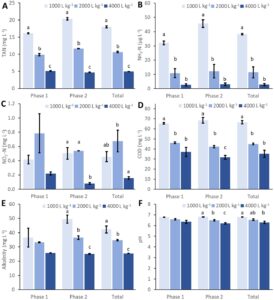
Dalam kasus NO 2 ─ N, konsentrasi tertinggi ditemukan pada pembaruan air 2000 L kg −1 umpan (Gambar 2C ). Secara keseluruhan, konsentrasi berkisar dari 0,07 hingga 1,06 mg L −1 dengan perbedaan yang signifikan ( p < 0,05) antara sistem dengan laju pembaruan air yang berbeda (Tabel S5 ). Demikian pula, untuk COD (Gambar 2D ), perbedaan yang signifikan diamati ( p = 0,001) antara 4000, 2000 dan 1000 L kg −1 umpan.
Alkalinitas berkisar antara 25 hingga 52 mg L −1 (Gambar 2E ) dengan perbedaan yang signifikan ( p < 0,05) antara sistem dengan pembaruan air umpan 1000, 2000 dan 4000 L kg −1 (Tabel S5 ). Rata-rata, pH berada pada 6,5 ± 0,2 (Gambar 2F ). Namun, perbedaan yang signifikan ( p < 0,05; Tabel S5 ) hanya ditemukan antara laju pembaruan air umpan 1000 dan 4000 L kg −1 .
3.2 Rasa yang Tidak Enak
Untuk sebagian besar senyawa, ada kecenderungan peningkatan konsentrasi pada 1000 L kg −1 pakan, terutama untuk GSM, MIB dan oktanal (tetapi tanpa perbedaan signifikan, p < 0,05). Dalam air tangki pemeliharaan, konsentrasi off-flavour tetap rendah, dan konsentrasi hingga 16 ng L −1 (oktanal) diamati (Gambar S1A, B ) setelah 1 bulan (Fase 1). Pada akhir percobaan (Fase 2), konsentrasi berkisar hingga 18 ng L −1 dalam air yang bersirkulasi (Gambar 3 ). Bahkan di sini, konsentrasi tertinggi diamati untuk GSM, MIB dan oktanal, semuanya meningkat saat laju pembaruan air menurun dari 4000 hingga 1000 L kg −1 pakan (Gambar 3 ).
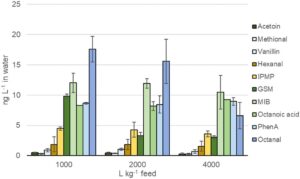
Konsentrasi dalam air masuk sangat rendah untuk sebagian besar senyawa dan di bawah atau mendekati LOD metode (Tabel S2 dan S6 ). Asam oktanoat dan fenilasetaldehida berkisar hingga 10 ng L −1 dalam air masuk pada awal percobaan tetapi menurun pada akhir percobaan. MIB ditemukan 8,3–9,3 ng L −1 , sementara semua senyawa lainnya ditemukan pada konsentrasi yang jauh lebih rendah (Tabel S6 ).
Secara keseluruhan, konsentrasi menunjukkan tren peningkatan pada tingkat pembaruan air yang menurun. Setelah 1 bulan percobaan, rasa tidak enak pada ikan sedang hingga rendah, dengan MIB menunjukkan konsentrasi tertinggi (400–500 ng kg −1 untuk GSM dan MIB; Gambar S2A ). Pada akhir percobaan, GSM menunjukkan konsentrasi tertinggi hingga 1560 ng kg −1 pada 1000 L kg −1 pakan (Gambar 4 ) di antara senyawa yang dianalisis.
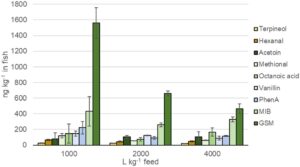
Mirip dengan pengamatan dalam air yang bersirkulasi, kecenderungan peningkatan konsentrasi off-flavour (tetapi tanpa signifikansi statistik p < 0,05) dari sebagian besar senyawa dalam ikan ditemukan pada 1000 L kg −1 pakan (Gambar 4 ). Konsentrasi MIB berkisar antara 400 dan 300 ng kg −1 , sementara semua senyawa lainnya tetap di bawah 250 ng kg −1 (Gambar 4 ). IBMP tidak terdeteksi dalam air yang bersirkulasi maupun dalam daging ikan, sementara terpineol, TCA, dan asam heksenoaat tetap di bawah tingkat kuantifikasi (LOQ). Konsentrasi GSM dalam daging ikan pada laju pertukaran air 2000 dan 4000 L kg −1 pakan lebih rendah (masing-masing 600 dan 500 ng kg −1 ) daripada 1000 L kg −1 pakan (1600 ng kg −1 ), tetapi berbeda secara signifikan ( p = 0,023) hanya antara sistem dengan 2000 dan 1000 L kg −1 pakan (Tabel S7 ). Untuk semua senyawa lainnya, perbedaan signifikan tidak ditemukan antara laju pembaruan air yang berbeda ( p > 0,05), meskipun kecenderungan peningkatan kecil diamati dalam konsentrasi saat laju pembaruan air menurun (Gambar 4 ).
4 Diskusi
Tiga tingkat pertukaran air PRAS yang berbeda (4000, 2000 dan 1000 L kg −1 pakan) tanpa biofilter dipelajari. Dalam penelitian ini, FCR jauh di bawah 1,0, yang sedikit lebih rendah daripada FCR 1,0–1,3 dalam sistem penggunaan kembali sebagian yang membesarkan benih ikan trout pelangi yang dilaporkan oleh Summerfelt et al. ( 2004 ). Ini menunjukkan kondisi pemeliharaan yang baik secara keseluruhan untuk ikan trout pelangi. FCR tetap sama sepanjang percobaan di semua sistem tanpa perbedaan pada penggunaan air pengganti yang berbeda. Kondisi pemeliharaan yang buruk (Øverli et al. 2006 ; Pulkkinen et al. 2018 ; Person-Le Ruyet et al. 2008 ) telah terbukti meningkatkan FCR, namun di sini, kualitas air yang diamati tidak memengaruhi FCR. Pakan mengambang berkualitas baik digunakan dalam percobaan, dan setiap pakan yang tidak dimakan diamati. Namun, SGR secara signifikan lebih rendah pada perlakuan pertukaran air terendah, yang mencerminkan bahwa ikan mengonsumsi lebih sedikit pakan pada perlakuan dengan 1000 L kg −1 pakan. Hal ini juga sesuai dengan penelitian sebelumnya, di mana kualitas air yang kurang optimal terbukti menurunkan asupan pakan (Davidson et al. 2011 ; Pulkkinen et al. 2018 ).
Wood ( 2004 ) menunjukkan bahwa konsentrasi rendah dari total amonia (70 µmol L −1 ) dapat berfungsi sebagai stimulan pertumbuhan pada ikan trout pelangi dan meningkatkan SGR, dan sebagai ambang batas kelangsungan hidup (Papadopoulos et al. 2024 ). Wood ( 2004 ) menyarankan bahwa khususnya amonia yang tidak terionisasi (23 μtorr, sekitar 16–34 µg L −1 ) dapat merangsang sintesis asam amino dan protein atau mengurangi biaya metabolisme, sementara Schram et al. ( 2010 ) melaporkan nafsu makan yang terstimulasi pada ikan lele Afrika Clarias gariepinus . Pada tingkat teoritis, amonia eksogen dapat merangsang sintesis dan pertumbuhan protein jika dimasukkan ke dalam asam amino (Randall dan Tsui 2002 ). Dalam studi kami sebelumnya, kami melaporkan peningkatan pertumbuhan yang terkait dengan peningkatan kadar TAN (5 mg L −1 TAN dalam PRAS, berarti 0,52–1,10 µmol L −1 amonia; Lindholm-Lehto dan Kiuru 2024 ). Dalam studi ini, konsentrasi amonia rata-rata adalah 11,5 µg L −1 dalam kelompok pertukaran air tengah dan 38,2 µg L −1 dalam kelompok pertukaran air terendah. Namun, kami tidak mengamati peningkatan pertumbuhan. Demikian pula, Kolarevic et al. ( 2013 ) tidak mengamati efek peningkatan amonia pada pemanfaatan pakan (0,1–32 µg L −1 NH 3 , salmon Atlantik, Salmo salar parr).
Konsentrasi TAN dan NO 2 ─N yang meningkat diamati pada laju pertukaran air yang lebih rendah (2000 dan 1000 L kg −1 pakan), keduanya signifikan secara statistik. Pada 1000 L kg −1 pakan, konsentrasi NH 3 ─N jauh di atas batas atas yang direkomendasikan untuk salmonid (30 µg L −1 ; Timmons et al. 2018 ). Mortalitas tertinggi diamati di salah satu tangki dengan penggunaan air terendah (1000 L kg −1 , 8%) pada fase pertama percobaan. Konsentrasi amonia yang tinggi mungkin memengaruhi mortalitas, meskipun tidak ada perbedaan statistik antara sistem. Twibell dan Barron ( 2024 ) melaporkan kelangsungan hidup yang sangat baik sebesar 100% dalam PRAS, sementara dalam penelitian ini, kelangsungan hidup rata-rata adalah 96%–100% dan antara 91% dan 99% pada 1000 L kg −1 pakan.
Kualitas air memegang peranan penting dalam kesejahteraan ikan di semua sistem pemeliharaan, termasuk PRAS. Akhir-akhir ini, semakin banyak perdebatan tentang kesejahteraan ikan di kalangan konsumen, komunitas penelitian, dan pembuat keputusan (Westerback et al. 2025 ). Konsumen, khususnya, ingin memastikan bahwa ikan yang mereka makan telah menjalani kehidupan yang baik (Seibel et al. 2020 ). Namun, dalam penelitian ini, parameter kesejahteraan apa pun tidak diukur.
Tingkat tertinggi NO 2 ─N diukur dalam tangki pada laju penghilangan air 2000 L kg −1 pakan (hingga 1,4 mg L −1 ), yang lebih tinggi daripada konsentrasi yang direkomendasikan untuk salmonid (Kroupova et al. 2008 ; Timmons et al. 2018 ). Sebagai perbandingan, NO 2 ─N tetap di bawah 0,01 mg L −1 dan TAN berkisar dari 0,02 hingga 0,08 mg L −1 dalam studi Twibell dan Barron ( 2024 ). Keduanya jauh lebih rendah daripada yang diukur dalam studi ini (NO 2 ─N, 0,07–1,06 mg L −1 ; TAN, 4,6–20,7 mg L −1 ).
Tingkat NO 2 ─N yang tinggi mengindikasikan nitrifikasi pasif dalam biofilm yang terbentuk pada permukaan tangki ikan. Tingkat menurun seiring berjalannya percobaan, yang merupakan hal yang umum terjadi ketika biofilm masih baru dan bakteri pengoksidasi nitrit menjadi dewasa (Pulkkinen et al. 2018 ). Namun, tidak jelas mengapa konsentrasi nitrit paling tinggi dalam kelompok pertukaran air 2000 L kg −1 . Mungkin konsentrasi amonia yang tinggi dalam kelompok pertukaran air terendah merangsang dimulainya nitrifikasi secara lengkap (Pulkkinen et al. 2018 ), dan dalam kelompok pertukaran air tertinggi, pengenceran menjaga konsentrasi nitrit tetap rendah. Kami tidak mengukur NO 3 ─N selama percobaan, jadi tidak mungkin untuk menentukan dengan lebih tepat bagaimana nitrifikasi dimulai atau diselesaikan. Akumulasi NO 2 ─N seharusnya tidak menjadi masalah dalam tangki pemeliharaan yang lebih besar, di mana luas permukaan per volume jauh lebih sedikit daripada dalam unit percobaan kecil (4,75 m 2 m −3 ). Konsentrasi NO 2 ─N yang tinggi pada dua kelompok perlakuan pertukaran air terendah mungkin telah memengaruhi asupan pakan, seperti yang sebelumnya diketahui oleh Roques et al. ( 2013 ) dan Gutiérrez et al. ( 2019 ). Lebih jauh lagi, hal ini mungkin telah menutupi potensi manfaat dari konsentrasi amonium yang sedikit meningkat. Pada Fase 2, ketika konsentrasi NO 2 ─N turun pada kelompok pertukaran air 2000 L kg⁻¹, SGR serupa dengan yang ada pada kelompok pertukaran air tertinggi.
Dalam penelitian sebelumnya, parameter kualitas air dasar dari RAS parsial telah diukur (Summerfelt et al. 2004, 2009 ), tetapi mereka hanya memantau parameter yang sangat dasar, seperti pH, suhu, oksigen terlarut, TAN dan CO 2 . Di sini, selain parameter kualitas air, penggunaan pakan dan pertumbuhan ikan, akumulasi 14 senyawa off-flavour yang berbeda dipantau dalam air dan pada ikan untuk menentukan apakah perbedaan kualitas air terjadi karena penggunaan air pengganti yang berbeda. Meskipun perbedaan yang signifikan hanya ditemukan untuk GSM antara sistem pakan 2000 dan 1000 L kg −1 , konsentrasi tertinggi dalam air dan pada ikan ditemukan pada sistem dengan pakan 1000 L kg −1 . Ini menegaskan bahwa pembentukan off-flavour terjadi dalam sistem bahkan tanpa biofilter (Podduturi et al. 2017, 2020 ).
Efek dari penggunaan air terbatas juga diamati sebagai peningkatan nilai alkalinitas, pH dan COD. COD menggambarkan jumlah bahan organik, bahan partikulat, atau fraksi organik terlarut dalam sistem. Bahan partikulat sangat tidak diinginkan karena bertindak sebagai permukaan pertumbuhan dan substrat untuk bakteri (Rojas-Tirado et al. 2018 ), bahkan untuk spesies yang menghasilkan off-flavour. Dalam penelitian ini, konsentrasi COD tetap relatif rendah, berkisar antara 30 hingga 65 mg L −1 dan menurun dengan laju penghilangan air yang lebih tinggi. Ini sesuai dengan hasil off-flavour; konsentrasi yang lebih rendah ditemukan pada peningkatan laju pembaruan air. H 2 O 2 residual lebih tinggi untuk laju pembaruan air 4000 L kg −1 umpan. Dalam hal ini, jumlah bahan partikulat pasti lebih rendah, dengan lebih sedikit zat untuk H 2 O 2 bereaksi.
Tanpa diduga, pH dan alkalinitas meningkat saat penggunaan air dikurangi. Hal ini mungkin disebabkan oleh komponen dalam pakan ikan, seperti kalsium, yang meningkatkan alkalinitas. Hal ini menggeser keseimbangan amonium ke arah amonia bebas yang lebih berbahaya. Dengan demikian, perbedaan nilai TAN antara dua unit dengan penggunaan air terendah sekitar dua kali lipat perbedaan nilai amonia yang tergabung. Hal ini menyoroti risiko pertukaran air yang rendah, yang harus dipertimbangkan saat merencanakan penggunaan air dalam PRAS.
Secara keseluruhan, konsentrasi bau tak sedap sangat rendah di air masuk. Ini merupakan prasyarat untuk keberhasilan pemeliharaan dan pembersihan tanpa masalah terkait bau tak sedap. Untuk GSM dan MIB, nilai batas 10 ng L −1 telah disarankan (Lindholm-Lehto dan Vielma 2019 ), meskipun bau tak sedap di air memengaruhi akumulasi pada ikan (Howgate 2004 ).
Pada awal percobaan, asam oktanoat, asam fenilasetat, MIB, dan IPMP menunjukkan nilai yang lebih tinggi (6–10 ng L −1 ) di air masuk, tetapi menurun mendekati LOD-nya pada akhir percobaan. Ini tidak luar biasa karena perubahan kelimpahan mikroba dapat terjadi di alam pada musim semi dan saat suhu air danau berubah (R. Wang et al. 2015 ). Hanya konsentrasi MIB dan asam fenil asetat yang tetap pada 8,7–9,1 ng L −1 di air masuk. Secara keseluruhan, konsentrasi dalam air yang bersirkulasi tetap pada tingkat rendah (hingga 18 ng L −1 ), meskipun konsentrasi di atas 10 ng L −1 menyebabkan risiko akumulasi off-flavour (Howgate 2004 ; Podduturi et al. 2017, 2021 ).
Dalam daging ikan, MIB ditemukan pada 250–400 ng kg −1 , vanilin, PhenA dan asam oktanoat berkisar antara 100 hingga 220 ng kg −1 , sedangkan konsentrasi senyawa lainnya berada di bawah 70 ng kg −1 . Hasilnya sejalan dengan konsentrasi rendah yang ditemukan di saluran masuk dan dalam air yang bersirkulasi. Selain itu, senyawa yang sama dengan konsentrasi tertinggi ditemukan baik di dalam air maupun di dalam ikan. Semua ini menunjukkan bahwa air saluran masuk memiliki kualitas yang baik dan senyawa off-flavour sebagian besar terbentuk di PRAS. Batas deteksi sensorik sebesar 700 ng kg −1 telah dilaporkan untuk MIB yang sedikit lebih tinggi daripada nilai yang ditemukan dalam penelitian ini (Grimm et al. 2004 ). Pada daging ikan, GSM ditemukan 450–1600 ng kg −1 yang berada di atas ambang batas sensorik 250 ng kg −1 (Grimm et al. 2004 ). Kemudian, bahkan nilai batas bawah ≤100 ng GSM kg −1 untuk salmon Atlantik telah disarankan (Davidson et al. 2023 ). Akan tetapi, nilai batas sensorik pada daging ikan belum ditentukan untuk semua rasa tidak enak yang diteliti (Lindholm-Lehto et al. 2023 ).
Agen pengoksidasi telah banyak dipelajari, yang bertujuan untuk mengurangi dan menghilangkan senyawa pengotor dalam air RAS (Schrader et al. 2010 ; Klausen dan Grønborg 2010 ; Rodriguez-Gonzalez et al. 2019 ; Pettersson et al. 2022 ), termasuk proses oksidasi lanjutan (AOP) yang membentuk radikal hidroksil yang sangat reaktif. Dalam kondisi air tawar, agen ini tidak membentuk produk sampingan yang berbahaya. Namun, banyak oksidan bereaksi secara tidak selektif dengan semua bahan organik, bukan hanya senyawa pengotor.
Konsentrasi H 2 O 2 yang sesuai relatif sempit untuk digunakan dalam RAS (Møller et al. 2010 ). Konsentrasi yang sangat rendah atau waktu paparan yang pendek tidak memungkinkan efisiensi yang memadai, sementara dosis tinggi dapat mengganggu proses mikroba yang bermanfaat, misalnya, dalam biofilter. Misalnya, Schwarz et al. ( 2000 ) melaporkan penghambatan parah oleh penambahan H 2 O 2 pada nitrifikasi dalam biofilter dan pengurangan penghilangan TAN pada dosis konstan 100 mg L −1 . Di sisi lain, Møller et al. ( 2010 ) melaporkan efek penghambatan sedang pada 10–13 mg L −1 selama 3 jam, sementara dalam studi Sortkjær et al. ( 2008 ), biofilter tidak terpengaruh pada penambahan 30 mg H 2 O 2 L −1 . Akan tetapi, dosis H2O2L − 1 hingga 30 mg telah dipelajari dan diamati bahwa bakteri pengoksidasi amonium dan nitrit mampu pulih dengan cepat setelah paparan singkat (Møller et al. 2010 ) . Selain itu, H2O2 bereaksi dengan NH3 dan mengoksidasinya menjadi spesies yang kurang berbahaya . Misalnya, H2O2 umumnya digunakan dalam pengolahan air limbah untuk melengkapi kinerja biofilter dan nitrifikasi, dan efisiensi penghilangan NH3 sebesar 80 % telah tercapai (Jóźwiakowski et al. 2017 ).
Dalam studi ini, 10 mg H 2 O 2 L −1 terus ditambahkan ke semua PRAS. Tidak seperti dalam RAS, efek penghambatan pada biofilter bukan masalah, tetapi nitrifikasi yang terjadi dalam biofilm mungkin telah dihambat. Konsentrasi yang digunakan dalam studi ini tetap di bawah batas atas yang aman untuk salmonid (70–100 mg H 2 O 2 L −1 , Pedersen dan Pedersen 2012 ). Namun, penambahan H 2 O 2 ini tidak sepenuhnya mencegah pembentukan off-flavour (terutama GSM) pada penggunaan air 1000 L kg −1 pakan. H 2 O 2 ditambahkan melalui air masuk langsung ke tangki pemeliharaan, tetapi pada tingkat ini, tampaknya tidak mempengaruhi pertumbuhan atau kesejahteraan ikan (Bögner et al. 2021 ). Perbedaan yang diamati dalam pertumbuhan dan kematian ikan lebih mungkin disebabkan oleh perbedaan penggunaan air dan akumulasi spesies nitrogen.
Summerfelt et al. ( 2009 ) mengamati bahwa tangki dasar melingkar, mirip dengan yang digunakan dalam penelitian ini, tidak dapat sepenuhnya mempertahankan pencampuran dan distribusi yang merata dalam volume air. Hal ini dapat disebabkan oleh dinamika aliran air dan kepadatan ikan yang relatif rendah (9–16 kg m −3 ; Summerfelt et al. 2009 ). Dalam penelitian kami, kepadatan ikan lebih tinggi (hingga 50 kg m −3 ), dan unit aerasi khusus tangki digunakan yang memungkinkan pencampuran yang lebih homogen melalui volume air. Hal ini memungkinkan kita untuk mempertimbangkan bahwa pengambilan sampel bersifat representatif dan hasil kualitas air dapat diandalkan.
5 Kesimpulan
Dalam studi ini, PRAS dengan tiga laju pembaruan air yang berbeda (1000, 2000 dan 4000 L kg −1 pakan) dan tanpa biofilter diaplikasikan untuk membesarkan ikan trout pelangi. Hasil penelitian menunjukkan bahwa kualitas air secara keseluruhan tetap sedang atau baik di semua sistem. Namun, khususnya konsentrasi NH 3 yang tidak terionisasi meningkat di atas nilai batas yang direkomendasikan pada laju pembaruan air terendah. FCR dan laju pertumbuhan baik di semua sistem, tetapi pertumbuhan berkurang secara sedang pada laju pembaruan air terendah. Kami tidak mengamati bahwa konsentrasi amonium yang sedikit meningkat meningkatkan pertumbuhan ikan, tetapi konsentrasi NO 2 ─N yang tinggi mungkin telah menutupi efeknya. Lebih jauh lagi, konsentrasi off-flavour rendah atau sangat rendah di semua sistem dalam air dan pada ikan tetapi, beberapa senyawa di atas batas deteksi sensorik mereka diamati pada laju pembaruan air terendah.
Berdasarkan hasil, laju pembaruan air sebesar 4000 dan 2000 L kg −1 pakan tampak cocok untuk pemeliharaan ikan trout pelangi di PRAS dalam hal pertumbuhan ikan, penggunaan pakan, dan meminimalkan rasa tidak enak. Pada kedua laju pembaruan air, kualitas air tetap baik, menunjukkan kondisi yang cukup dalam hal kesejahteraan ikan, meskipun parameter kesejahteraan apa pun tidak dipantau (selain inspeksi visual) dalam penelitian ini. Berdasarkan hasil, efek penambahan H 2 O 2 dan penggunaan air pengganti sulit dipisahkan. Secara keseluruhan, hasil tersebut merupakan tambahan yang berharga saat merancang produksi ikan di PRAS dan pemilihan kondisi pemeliharaan yang sesuai.



