ABSTRAK
Lamprey Pasifik yang diperbanyak secara artifisial ( Entosphenus tridentatus ) diproduksi untuk restorasi dan untuk digunakan dalam studi lintasan bendungan untuk mengurangi permintaan ikan liar. Penggunaan tersebut mensyaratkan bahwa hewan tersebut mewakili rekan-rekan liarnya. Penelitian sebelumnya menunjukkan bahwa hal ini berlaku untuk larva dan juvenil lamprey Pasifik yang dipelihara di tempat penetasan sehubungan dengan lamanya berenang berkelanjutan. Namun, perbedaan yang lebih halus dalam perilaku dan kinerja yang dibutuhkan lamprey untuk bertahan hidup belum dinilai. Dalam penelitian ini, ikan yang diperbanyak secara artifisial dan ikan liar dibandingkan dalam uji laboratorium dalam kondisi tanpa aliran untuk memeriksa penghindaran cahaya, kecepatan menggali, kecepatan berenang cepat, kecepatan berenang rutin yang disengaja, dan waktu untuk beristirahat. Sebagian besar larva menggali dalam waktu kurang dari satu menit, dan kami menemukan perbedaan yang sangat signifikan ( p < 0,001) antara waktu menggali larva yang diperbanyak secara artifisial dan larva liar, perilaku melarikan diri yang kritis. Hal ini dapat berimplikasi pada penelitian tentang masuknya larva di kanal pengalihan irigasi atau di bisul turbin di bendungan. Menariknya, semua ikan muda liar yang diuji segera beristirahat setelah dimasukkan ke dalam ruang (1,5 menit), sementara lamprey yang dikembangbiakkan secara artifisial berenang secara robotik di dekat permukaan dan 48% tidak beristirahat dalam 10 menit pertama (waktu rata-rata untuk beristirahat = 9,5 menit). Sebaliknya, ikan muda liar dengan cepat (rata-rata = 1,47 menit) mencari area di dekat dasar tangki dan menempel kuat dengan cakram oral mereka. Perbedaan perilaku tersebut dapat memiliki konsekuensi kelangsungan hidup yang penting bagi lamprey yang dikembangbiakkan secara artifisial saat mereka mendekati intake turbin, layar bypass, dan pintu air pengalihan irigasi. Studi ini menyoroti perlunya melakukan uji perilaku yang memeriksa kehalusan perilaku ikan yang dapat terlewatkan dengan perbandingan terowongan renang tradisional.
1 Pendahuluan
Penduduk asli Amerika di Cekungan Sungai Columbia telah lama mengakui pentingnya budaya dan ekologi lamprey Pasifik ( Entosphenus tridentatus ; Close et al. 2002 ; CRITFC 2011 ), dan Pemerintah AS ditugaskan untuk melindungi sumber daya tersebut sehubungan dengan hak perjanjian suku (Wicks-Arshack et al. 2018 ). Meskipun demikian, lamprey Pasifik dan spesies anadrom lainnya telah mengalami penurunan kelimpahan dan distribusi yang berkurang di Cekungan Sungai Columbia di Amerika Serikat bagian barat laut, sebagian besar disebabkan oleh bendungan sungai (Luzier et al. 2011 ). Bendungan merupakan hambatan bagi orang dewasa (Keefer et al. 2013 ; Clemens et al. 2017 , Clemens et al. 2023 ) tetapi juga merupakan sumber kematian bagi larva dan juvenil (Moser et al. 2015 , Moser et al. 2021 ). Perkiraan kelangsungan hidup diperlukan untuk setiap sumber potensial kematian selama migrasi lamprey hilir untuk memprioritaskan investasi sumber daya untuk konservasi dan pengelolaan (Haas et al. 2024 ).
Kebutuhan untuk menghasilkan hewan untuk studi lintasan hilir dan upaya restorasi di masa mendatang memberikan dorongan untuk pengembangan metode kultur lamprey (Lampman et al. 2016 ; Moser et al. 2019 ). Dengan penurunan tajam dalam kelimpahan lamprey Pasifik di seluruh Cekungan Sungai Columbia (CRITFC 2011, 2018 ; Clemens et al. 2021 ), hewan studi spesies ini sulit diperoleh untuk penelitian. Tujuan dari upaya perbanyakan dan pemeliharaan buatan ada dua: untuk menghasilkan larva dan juvenil yang ditransformasi untuk digunakan dalam penelitian lintasan dan untuk aktivitas restorasi Suku (CRITFC 2018 ; Moser et al. 2020 ; Lampman et al. 2021 ). Akibatnya, penting untuk mengevaluasi apakah lamprey yang diperbanyak secara buatan merupakan pengganti yang memadai untuk ikan liar. Hal ini telah menjadi tantangan yang berkelanjutan dalam penggunaan salmonid yang dibesarkan di peternakan ( Oncorhynchus spp.) untuk penelitian jalur (misalnya Noakes et al. 2014 ; Cogliati et al. 2023 ) dan dapat memengaruhi kesesuaian lamprey yang diperbanyak secara buatan.
Pada salmonid, ada bukti bahwa ikan yang dibesarkan di tempat penetasan memiliki kondisi, performa, dan/atau kebugaran yang berkurang dibandingkan dengan ikan liar (misalnya McDonald et al. 1998 ; Araki et al. 2008 ; Pedersen et al. 2008 ; McMillan et al. 2023 ). Efek seleksi domestikasi tersebut dapat lebih jelas terlihat pada lamprey karena waktu pemeliharaannya yang lama di air tawar (3–9 tahun; Hess et al. 2022 ). Namun, untuk lamprey, efisiensi reproduksi buatan dan mortalitas yang lebih rendah dalam kultur dapat mengimbangi penipisan kumpulan gen dan perubahan perilaku yang diakibatkan oleh domestikasi (Kujawa et al. 2019 ). Seperti halnya salmonid, kondisi pemeliharaan di tempat penetasan biasanya memberikan larva lamprey dengan lebih sedikit heterogenitas dalam ukuran butiran substrat, kecepatan air, pemberian makanan, dan fotoperiode daripada yang ditemui di alam liar (Kujawwa et al. 2018 ; Moser et al. 2019 ). Pemeliharaan dalam substrat buatan, pencahayaan, aliran, dan suhu dapat mengubah fisiologi atau perilaku larva lamprey, dan kondisi kultur yang padat dapat mengurangi pertumbuhan dan berpotensi memengaruhi kemampuan berenang (Lampman et al. 2021 ).
Performa berubah secara alami saat lamprey berkembang. Larva lamprey Pasifik hidup menggali di sedimen lunak, tetapi mereka dapat terlepas oleh peristiwa pengikisan, kondisi aliran tinggi, atau gangguan sedimen lainnya (yaitu tindakan restorasi, pengerukan, pengeringan), yang membuat mereka rentan terhadap pemangsaan, paparan, keterlibatan, dan benturan (Close et al. 2002 ; Dauble et al. 2006 ; Liedtke, Harris, et al. 2023 ). Dengan demikian, kemampuan berenang cepat dan kemampuan untuk menggali sangat penting untuk bertahan hidup dalam tahap kehidupan ini, dengan penggalian lengkap ditentukan oleh cakupan fotoreseptor ekor (Binder et al. 2013 ). Dengan metamorfosis, lamprey muda mengembangkan mata dan bagian mulut yang memungkinkan mereka menempel pada substrat halus dan mencari area berlindung di kerikil atau batu bulat. Perilaku mencari dan bertahan berlindung ini berfungsi untuk melindungi anak-anaknya dari pemangsa atau kondisi buruk. Saat mereka memulai migrasi ke arah laut, ikan-ikan muda ini cenderung bergerak di dekat dasar aliran air dan sungai selama sesi berenang yang lama, terutama di malam hari (Dauble et al. 2006 ; Liedtke et al. 2019 ).
Saat larva dan lamprey muda yang sedang bertransformasi bermigrasi ke laut dari daerah pembiakan, mereka menghadapi serangkaian bahaya, khususnya di sungai dan anak sungai yang terbendung (Moser et al. 2015 , Moser et al. 2021 ). Kemampuan untuk menahan aliran yang menarik mereka ke pengalihan irigasi, pipa pengambilan air dan/atau layar bypass turbin dapat menentukan apakah mereka dapat melarikan diri atau terjepit/terhanyut (Moursund et al. 2001 , Moursund et al. 2003 ; Rose dan Mesa 2012 ). Penghindaran cahaya pada lamprey didorong oleh fotoreseptor di dermis ekor yang merupakan bagian dari sistem garis lateral (Binder et al. 2013 ). Pencahayaan pada fotoreseptor ini merangsang pergerakan larva lamprey dan aktivitas menggali (Deliagina et al. 1995 ). Stamina renang (larva dan juvenil) dan kemampuan menggali dengan cepat (larva) memungkinkan lamprey memilih tempat berlindung dengan lebih efektif dan menghindari predator ikan atau bahaya lainnya (seperti terjepit). Kami mengembangkan pengujian kami dengan mempertimbangkan persyaratan kinerja ini.
Apakah lamprey Pasifik yang diperbanyak secara artifisial merupakan pengganti yang memadai untuk ikan liar? Moser et al. ( 2020 ) menemukan bahwa laju respirasi rutin larva dari kelompok perlakuan yang diperbanyak secara artifisial dan liar serupa untuk anakan tahun dan anakan tahun. Untuk larva dan juvenil, lamprey liar dan yang diperbanyak secara artifisial memiliki kemampuan berenang berkelanjutan yang serupa (Mueller et al. 2019 ; Moser et al. 2020 ), tetapi kemampuan berenang penting lainnya (cepat, lama, dan sukarela) tidak diperiksa. Uji laju menggali sederhana tidak mengungkap kekurangan apa pun pada larva yang diperbanyak secara artifisial dibandingkan dengan larva liar dengan ukuran yang sama (Moser et al. 2020 ). Namun, percobaan ini tidak memeriksa perilaku yang mungkin dibutuhkan lamprey untuk bertahan hidup di lingkungan alami, seperti waktu untuk memulai menggali, atau rangsangan yang memunculkan respons melarikan diri ini.
Percobaan kami menguji perbedaan perilaku yang melampaui metrik kinerja yang telah diuji sebelumnya (misalnya berenang dengan paksa), tetapi masih memiliki aplikasi langsung pada pengelolaan lamprey di sungai-sungai di Pacific Northwest. Respons cepat terhadap cahaya dapat melindungi lamprey yang terperangkap dalam bisul turbin dari predator burung, sementara penggalian cepat memungkinkan pelarian dari predator ikan di dekat spillway bendungan dan pintu air kanal irigasi. Selain metrik ini, kami menguji perilaku berenang dengan kemauan dan durasi berenang yang diperlukan untuk membendung arus yang dapat menerjang atau menyeret larva dan juvenil lamprey.
Kami melakukan evaluasi laboratorium di bawah suhu aliran dan kondisi pencahayaan yang realistis menggunakan larva dan remaja lamprey Pasifik yang dikumpulkan dari alam liar atau diperbanyak secara buatan dan dibesarkan di penangkaran. Karena tahap perkembangan dan ukuran tubuh dapat memengaruhi respons perilaku atau kemampuan berenang (Quintella et al. 2007 ; Moser et al. 2020 ), kami berusaha untuk memiliki kelompok perlakuan dengan ukuran tubuh dan tahap perkembangan yang sama. Dalam serangkaian percobaan individu, kami menguji reaktivitas terhadap iluminasi ekor (yaitu respons fotokinetik) dan menggali untuk larva, serta perubahan dalam perilaku istirahat dan kinerja berenang spesifik tahap (ledakan dan rutin) untuk larva dan remaja. Dalam setiap kasus, hipotesis nol adalah bahwa lamprey yang diperbanyak secara buatan tidak akan berbeda secara signifikan dari lamprey liar dengan ukuran dan tahap riwayat hidup yang sama.
2 Metode
2.1 Lamprey Eksperimental
Uji coba fotokinesis dan penggalian pada larva lamprey Pasifik dilakukan di Survei Geologi AS, Laboratorium Penelitian Sungai Columbia (CRRL) di Cook, Washington. Larva lamprey adalah tahap kehidupan tanpa mata, pemakan saringan yang biasanya berada di substrat (Clemens 2019 ). Kelompok perlakuan yang diperbanyak secara artifisial untuk uji coba ini dipelihara dari telur di Yakama Nation’s Fish Hatchery di Prosser, Washington dan dikumpulkan pada September 2021. Larva liar untuk uji coba yang sesuai dikumpulkan dengan cara memancing dengan listrik dari Gibbons Creek dekat Washougal, Washington pada Agustus 2021. Larva ditahan setidaknya selama 24 jam setelah memancing dengan listrik untuk membatasi efek penangkapan pada perilaku dan kinerja (Moser et al. 2007 ).
Larva dipelihara dalam tangki fiberglass (51 × 43 × 27 cm) dengan pasir (ukuran butiran 0,3–0,5 mm) untuk menggali (kedalaman 5 cm) dan diberi air yang disaring (1,5 L/menit), dipanaskan (10,3°C ± 1°C) dari Sungai Little White Salmon. Setiap tangki diisi dengan 25 larva. Selama pemeliharaan, lamprey diberi bubur ragi aktif (5,3 g/tangki) dan makanan burayak komersial (0,6 g/tangki, Gemma Wean 0,1; Skretting, Vancouver, British Columbia, Kanada) dalam suspensi setidaknya dua kali setiap minggu. Suspensi dimasukkan ke dalam tangki yang diberi aerasi, dan aliran air dimatikan selama 6–7 jam selama pemberian makan (prosedur dari Rose dan Mesa [ 2012 ]).
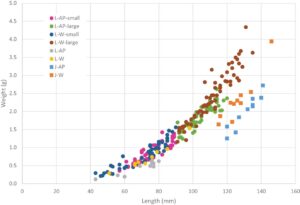
Karena ukuran dapat berperan dalam penggalian (Quintella et al. 2007 ; Moser et al. 2020 ), larva percobaan dari kelas ukuran yang berbeda—kecil (≤90 mm, potensi pra-metamorf) dan besar (>90 mm, potensi metamorf; Tabel 1 )—dipilih secara acak dari tangki pada saat setiap percobaan. Uji coba untuk larva yang diperbanyak secara artifisial dimulai setelah periode penahanan laboratorium minimal 2 minggu. Uji coba untuk larva liar dimulai 1 hari setelah kedatangan mereka di laboratorium untuk membatasi potensi efek domestikasi dan menangkap kondisi dasar. Empat percobaan diselesaikan dari Agustus 2021 hingga Januari 2022. Suhu air rata-rata di tangki penampungan adalah 10,3°C ± 2°C (dengan pengecualian periode 3 hari di akhir eksperimen ketika kisarannya adalah 4,9°C–13°C karena kegagalan pemanas). Uji coba dilakukan menggunakan sumber air yang sama yang digunakan untuk tangki penampungan lamprey dan tidak dilakukan selama periode ketika pemanas rusak. Panjang dan berat pada saat uji coba dicatat untuk setiap individu (Gambar 1 ; untuk pengukuran, ikan dibius dengan tricaine methanesulfonate 50 mg/L yang dibuffer [MS-222 oleh Argent, Redmond, Washington untuk larva dan Syncaine oleh Syndel, Ferndale, Washington untuk juvenil]).
| Kelompok perawatan | Kelas ukuran/tahap perkembangan | Sumber | Kinerja penggalian (CRRL) | Respons fotokinetik (CRRL) | Performa renang (WEC) |
|---|---|---|---|---|---|
| AP—Larva | Kecil | Peternakan Ikan Bangsa Yakama | 76,6 (0,20) | 75,5 (0,17) | — |
| Besar | Peternakan Ikan Bangsa Yakama | 103,5 (0,17) | 101,8 (0,15) | — | |
| W—Larva | Kecil | Sungai Gibbons, Washougal, Washington | 73,0 (0,21) | 73,7 (0,21) | — |
| Besar | Sungai Gibbons, Washougal, Washington | 111.1 (0.17) | 110,9 (0,17) | — | |
| AP—Larva | Pusat Air dan Lingkungan | — | — | 69.8 (1.04) | |
| W—Larva | Sungai Umatilla, Mission, OR | — | — | 70.7 (1.50) | |
| AP—Remaja | 5,87 (4,33–6,67) | Pusat Teknologi Perikanan Abernathy | — | — | 131.7 (1.00) |
| W—Remaja | 6.27 (5.33–7) | Sungai Ahtanum Hulu, Ahtanum, WA | — | — | 126.2 (1.27) |
Uji coba yang menilai kecepatan berenang dan waktu untuk beristirahat dilakukan di Water and Environmental Center (WEC) di kampus Walla Walla Community College. Uji coba ini memiliki perbandingan untuk larva dan juvenil (Gambar 2 ) dan dilakukan selama 1 minggu pada pertengahan Februari 2022. ‘Juvenil’ eksperimental termasuk larva yang bertransformasi dan bermata yang merupakan ciri khas tahap metamorf yang bermigrasi di aliran air alami (Clemens 2019 ). Kami mencocokkan rentang ukuran dan tahap perkembangan antara kelompok perlakuan yang diperbanyak secara artifisial dan liar (Tabel 1 ). Untuk menstandardisasi kondisi pra-eksperimen di antara kelompok, keempat kelompok perlakuan ( masing-masing n = 10 ) disimpan dalam tangki 10-L terpisah dengan aerasi pada 10,0°C–12,1°C selama minimal 48 jam sebelum pengujian. Larva yang diperbanyak secara artifisial untuk uji coba ini dipelihara dari telur di WEC mengikuti protokol dalam Lampman et al. Kelompok larva liar yang sesuai dikumpulkan melalui penangkapan ikan dengan alat elektro pada tanggal 15 Februari 2022 dari Sungai Umatilla dekat Mission, Oregon. Suhu air saat pengumpulan adalah 10°C. Larva-larva tersebut diangkut dalam pendingin ber-aerasi dengan sedimen dan diaklimatisasi hingga 11°C ± 1,0°C dengan laju < 1,0°C/jam). Juvenil yang diperbanyak secara artifisial dibesarkan di Pusat Teknologi Ikan Abernathy milik US Fish and Wildlife Service dari larva Prosser Hatchery (tahun pengeraman 2015 dan 2016). Larva-larva tersebut dikumpulkan saat bertransformasi pada bulan November 2021–Januari 2022, yang diadakan di CRRL milik US Geological Survey di Cook, WA, tempat larva-larva tersebut digunakan sebagai spesimen kontrol dalam eksperimen terpisah dan diangkut ke WEC seminggu sebelum pengujian. Ikan-ikan muda liar dikumpulkan oleh ahli biologi Yakama Nation Fisheries dari Kanal Proyek Irigasi Upper Wapato (Ahtanum Creek) dekat Tampico, Washington pada bulan Desember 2021. Ikan-ikan tersebut ditahan di fasilitas penampungan lamprey Yakama Nation di Prosser Fish Hatchery dan dipindahkan ke WEC seminggu sebelum pengujian. Kedua kelompok perlakuan ikan muda diaklimatisasi dari air penampungan ke suhu 11°C ± 1°C dengan laju 1°C/jam dan ditahan setidaknya selama 48 jam sebelum pengujian. Di WEC, kondisi aklimatisasi berbeda di antara kelompok perlakuan: larva yang diperbanyak secara artifisial ditahan paling lama dalam kondisi pengujian (air sumur 11,8°C ± 1°C), ikan-ikan muda dari kedua kelompok ditahan untuk jangka waktu yang sama dan larva liar ditahan untuk jangka waktu terpendek (48 jam).

2.2 Respon Fotokinetik terhadap Pencahayaan Ekor
Kami mengukur respons fotokinetik larva lamprey yang diperbanyak secara artifisial dan liar terhadap penerangan ekor menggunakan peralatan dan prosedur penerangan foto yang dikembangkan oleh Binder et al. ( 2013 ). Peralatan (Gambar 3 ) terdiri dari ruang cahaya dengan bukaan kecil tempat seekor lamprey dapat diposisikan sedemikian rupa sehingga hanya ekornya yang diterangi. Ruang cahaya (20 × 20 × 30 cm) terbuat dari plastik putih setebal 5 mm dan menggunakan tabung akrilik bening berudara (diameter dalam 19 mm) dengan kasa 2 mm di salah satu ujungnya untuk memposisikan lamprey. Panjang tabung cocok dengan perkiraan panjang total lamprey yang diuji. Lampu pijar putih lembut 40 watt dan kamera inframerah dipasang pada tutup ruang cahaya, yang direndam dalam bak air (kedalaman 6,5 cm). Intensitas cahaya di dalam bilik dapat disesuaikan dan ditetapkan pada 10 lux di permukaan air (diukur dengan pengukur cahaya digital, Extech Instruments model 401025 1 ).
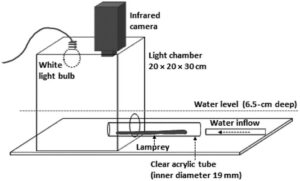
Pengujian dilakukan di ruangan gelap, menggunakan cahaya merah redup untuk melihat. Sebanyak 146 individu tersedia untuk pengujian dengan kemungkinan penggunaan ulang ikan percobaan secara acak, dengan total 229 pengujian. Larva lamprey dipindahkan ke tangki penampungan di ruangan gelap setidaknya 30 menit sebelum percobaan untuk memungkinkan fotoreseptor menyesuaikan diri dengan kondisi pengujian. Untuk memulai pengujian, seekor lamprey ditempatkan ke dalam tabung akrilik sehingga hanya daerah ekor (posterior ke sirip punggung anterior) yang berada di dalam ruangan. Lamprey dibiarkan beristirahat selama 10 menit, dan pengujian tidak dimulai sampai lamprey tidak bergerak selama setidaknya 30 detik. Cahaya di dalam ruangan kemudian diaktifkan, dan lamprey diberi waktu 60 detik untuk merespons. Respons didefinisikan sebagai defleksi lateral ekor. ‘Waktu untuk merespons’ adalah waktu dari aktivasi cahaya hingga waktu pergerakan, berdasarkan tinjauan video setiap individu.
2.3 Kinerja Penggalian
Pengujian kinerja penggalian dilakukan pada siang hari di akuarium kaca (51 × 26 × 32 cm), yang diisi pasir sedalam 18 cm (ukuran partikel < 2 mm). Pengujian dilakukan dalam kondisi air statis, dan tangki dibilas setelah setiap pengujian untuk mempertahankan suhu air yang konsisten (10,3°C ± 1°C).
Uji coba dilakukan menggunakan 13–15 lamprey dari setiap ukuran dan kombinasi jenis pemeliharaan (empat kelompok). Lamprey dipilih secara acak, dikeluarkan dari tangki penampungannya, dan ditempatkan dalam corong plastik (diameter atas 140 mm, kedalaman 125 mm, bukaan bawah 19 mm) dengan kasa yang menutupi bagian bawah untuk mencegah keluarnya lamprey. Corong diposisikan di atas akuarium dengan sepertiga bagian bawahnya di bawah permukaan air. Setelah menahan selama 1 menit, kasa corong dilepas, dan lamprey memasuki akuarium (pengenalan akuarium). Larva sering menjelajahi akuarium dan mencoba membuat liang sebelum berhasil membuat liang sepenuhnya. ‘Inisiasi pembuatan liang’ didefinisikan sebagai waktu sejak pengenalan akuarium hingga dimulainya upaya pembuatan liang yang berhasil. ‘Waktu pembuatan liang’ didefinisikan sebagai waktu sejak dimulainya upaya pembuatan liang yang berhasil hingga pembuatan liang selesai (ujung ekor sepenuhnya berada di bawah permukaan sedimen).
2.4 Performa Renang
Pengukuran kecepatan berenang dan waktu untuk beristirahat dilakukan di tangki fiberglass berukuran 53 × 181 cm dengan air sumur yang tergenang dijaga pada kedalaman air 11 cm melalui pipa tegak berdiameter 5 cm (Gambar 4 ). Selama uji coba, pipa tegak ditutup untuk mencegah ikan kabur. Tangki diterangi menggunakan dua strip lampu LED 90 cm yang ditutupi alas filter untuk menciptakan pencahayaan yang menyebar, mirip dengan kondisi alam dengan cahaya redup. Semua uji coba kinerja difilmkan dengan lampu ruangan dimatikan untuk meningkatkan kontras.
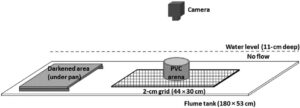
Uji coba difilmkan menggunakan kamera GoPro Hero 3 1 (GoPro, Inc. San Mateo, CA) yang diposisikan sekitar 66 cm di atas dasar tangki. Sepotong kaca plexiglass berukuran 30 × 44 cm ditandai dengan kisi persegi berukuran 2 cm dan dipusatkan di bawah kamera untuk memungkinkan penghitungan kecepatan berenang nanti. Di atas kisi ini, kami memposisikan arena start berdiameter 20 cm yang terbuat dari PVC dan dilapisi dengan alas saringan putih untuk mencegah juvenil menempel di sisinya. Di salah satu ujung tangki, loyang aluminium berukuran 30 × 43 cm diposisikan 1 cm dari dasar tangki untuk menciptakan area yang gelap (Gambar 4 ).
Protokol kinerja direplikasi untuk semua kelompok perlakuan (larva dan juvenil dari perlakuan yang diperbanyak secara artifisial dan liar; n = 10 untuk masing-masing dari empat kelompok) pada tiga percobaan terpisah. Lamprey individu dituangkan ke dalam arena awal dengan kecepatan 1 L/detik dari ember 20 L yang berisi sekitar 3 L air sumur (Gambar 4 ). Setelah setiap ikan dimasukkan ke dalam arena awal, mereka dibiarkan maksimal 10 menit untuk beristirahat (yaitu menempel dengan kuat di dasar untuk juvenil atau berbaring tengkurap menyamping di dasar selama 20 detik untuk larva). Waktu istirahat ini dicatat. Jika ikan tidak menempel di arena, total waktu yang mereka habiskan di arena digunakan sebagai waktu perlekatan arena (sekitar 10 menit). Arena kemudian dengan hati-hati dikeluarkan dari tangki, dan ikan distimulasi dengan semburan air dari pipet kalkun (seperti dalam Sutphin dan Hueth 2010 ; Haas 2021 ). Sebagian besar ikan merespons rangsangan ini dengan berenang cepat (‘renang cepat’). Dalam kasus di mana respons kaget tidak langsung terjadi atau lamprey tidak sepenuhnya beristirahat, waktu pelepasan arena diberi label sebagai permulaan berenang, dan tidak ada data renang cepat untuk individu tersebut.
Setiap ikan kemudian diizinkan 10 menit untuk menjelajahi tangki dan menempel (juvenil) atau berhenti berenang (larva). Waktu untuk menetap di area yang gelap (tanpa kemunculan kembali berikutnya) atau menetap pertama dicatat untuk setiap individu selama 10 menit. Jika ikan tidak menempel selama seluruh periode percobaan 10 menit di dalam tangki, waktu dari pelepasan hingga akhir percobaan digunakan sebagai waktu pemasangan tangki pertama (misalnya sekitar 10 menit). Jika dalam perjalanan menjelajahi tangki, lamprey berenang melintasi area kisi-kisi tepat di bawah kamera perekam, metrik kecepatan berenang rutin dapat dinilai menggunakan tinjauan video. Seluruh protokol segera diulang dengan ikan yang sama dua kali lagi untuk total tiga percobaan replikasi untuk setiap individu, dengan beberapa peluang data untuk mengumpulkan kecepatan berenang cepat dan metrik kecepatan berenang rutin. Analisis hanya menggunakan hasil percobaan pertama untuk metrik waktu istirahat untuk menghindari masalah pembiasaan terhadap rangsangan, stres fisiologis, dan pembelajaran. Untuk kecepatan renang cepat, kecepatan renang cepat maksimum dalam menanggapi rangsangan kaget dari tiga kali percobaan dilaporkan, karena hal ini difokuskan pada kemampuan kecepatan dan bukan pada tanggapan proporsional serta tidak bergantung pada pembiasaan atau pembelajaran.
Suhu selama semua percobaan dipertahankan pada 11,8°C ± 1,0°C dan dicatat pada awal setiap percobaan. Jika suhu mendekati 12,5°C, seluruh tangki dikuras dan air tawar dimasukkan. Sebisa mungkin, ikan liar dan ikan yang dikembangbiakkan secara buatan dari setiap tahap kehidupan diselingi dalam percobaan.
Pada akhir pengujian untuk setiap individu, ikan dibius dalam 50–100 mg/L buffer MS-222 (sekitar 3 menit), diukur (mm terdekat), difoto dan ditimbang (0,01 g terdekat). Foto lateral dan ventral setiap individu yang mencakup mata dan close-up cakram oral digunakan untuk menetapkan tahap metamorfosis berdasarkan morfologi mata dan gigi (McGree et al. 2011 ). Ini diselesaikan oleh tiga peneliti berpengalaman, dan tahap perkembangan dirata-ratakan untuk setiap ikan. Faktor kondisi ( K ) juga dihitung menggunakan rumus khusus lamprey ( K = W × 105 / L 2,6 ; Lampman et al. 2016 ) untuk setiap individu untuk memberikan ukuran relatif bentuk tubuh (Ricker 1975 ). Dalam setiap tahap kehidupan, panjang rata-rata dan faktor kondisi dibandingkan antara ikan yang diperbanyak secara buatan dan ikan liar menggunakan uji -t dua sisi .
2.5 Analisis
Statistik multivariat sering kali lebih tangguh daripada perbandingan berpasangan individual karena kemampuannya untuk menganalisis beberapa variabel dependen secara bersamaan. Meskipun ada upaya untuk memperbaiki pelanggaran asumsi parametrik (normalitas, linearitas, homogenitas varians, outlier, dan multikolinearitas) melalui transformasi dan penskalaan, kumpulan data kami tidak sesuai dengan sebagian besar asumsi MANOVA. Akibatnya, kami menggunakan uji berpasangan dan uji Mann–Whitney nonparametrik untuk membuat perbandingan.
2.5.1 Kinerja penggalian
Kami menghitung waktu minimum, maksimum, dan median untuk memulai penggalian dan waktu penggalian. Kedua metrik tersebut tidak terdistribusi secara normal. Perbandingan antara kelompok liar dan yang dikembangbiakkan secara artifisial dan antara kategori ukuran dilakukan menggunakan uji Mann–Whitney.
2.5.2 Respon fotokinetik terhadap iluminasi ekor
Persentase larva lamprey yang bergerak dan median serta kisaran waktu respons dilaporkan. Perbandingan antar kelompok dilakukan menggunakan uji jumlah peringkat Mann–Whitney karena respons tidak terdistribusi secara normal.
2.5.3 Performa renang
Semua video ditinjau dan diberi cap waktu untuk kejadian renang mendadak. Episode renang rutin volisional juga diidentifikasi. Gerakan kepala lamprey (jarak tempuh dan waktu) dianalisis (seperti dalam Haas [ 2021 ]) menggunakan perangkat lunak Kinovea 1 sumber terbuka (Charmant dan Kontributor 2021 ). Kecepatan mendadak (cm/s) dan kecepatan renang rutin volisional (cm/s) dihitung menggunakan alat kinematika linier (Gambar 5 ). Untuk setiap individu, kecepatan sesaat tercepat dari 0,5 detik pertama (15 bingkai video) dari respons mendadak awal digunakan untuk analisis kecepatan mendadak.
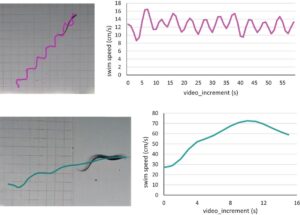
Selama penjelajahan tangki, ada beberapa kejadian ketika lamprey berenang melalui bidang video yang ditargetkan (yaitu tidak ada stimulus untuk bergerak). Untuk ini, kami menghitung kecepatan renang rutin volitional dengan alat kinematika linear dan dirata-ratakan pada interval 1-s (30 bingkai video; Gambar 5 ). Kecepatan renang burst maksimum dan kecepatan renang rutin volitional untuk setiap individu dalam dua kelompok perlakuan (diperbanyak secara artifisial dan liar) untuk setiap tahap kehidupan (juvenil dan larva) dibandingkan menggunakan uji – t kecuali data tidak memenuhi uji normalitas. Jika data gagal dalam uji normalitas atau varians yang sama, uji Mann-Whitney digunakan untuk membuat perbandingan (Zar 1984 ).
2.5.4 Pemasangan/istirahat
Untuk percobaan pertama dengan setiap individu, kami mengukur lamanya waktu dari pelepasan lamprey ke arena hingga perlekatan pertama atau penghentian gerakan di arena (waktu untuk istirahat). Untuk percobaan itu, kami juga mengukur lamanya waktu (menit) dari pelepasan arena hingga perlekatan pertama mereka (juvenil) atau berbaring tengkurap (larva) di tangki yang lebih besar (Gambar 4 ). Jika ikan masuk ke dalam kegelapan dan tidak segera muncul kembali, itu diasumsikan sebagai waktu perlekatan pertama. Waktu-waktu ini dibandingkan untuk individu yang diperbanyak secara buatan dan liar dalam kelompok larva dan juvenil dan di seluruh kategori ini menggunakan uji jumlah peringkat Mann-Whitney karena data ini tidak terdistribusi normal. Regresi linier digunakan untuk menghubungkan tahap perkembangan yang ditetapkan dengan waktu untuk beristirahat di arena dan tangki untuk kelompok larva liar dan yang diperbanyak secara buatan.
3 Hasil
3.1 Lamprey Eksperimental
Untuk larva yang digunakan dalam pengujian performa berenang (WEC), tidak ada perbedaan signifikan antara panjang rata-rata hewan uji yang diperbanyak secara buatan dan hewan uji liar ( n = 20; t = 0,684, df = 18, p = 0,503). Namun, larva yang diperbanyak secara buatan lebih ringan dan memiliki faktor kondisi yang secara signifikan lebih rendah daripada larva yang ditangkap di alam liar ( n = 20; t = 7,305, df = 18, p < 0,001). Larva yang digunakan dalam kinerja menggali dan uji respons fotokinetik dibagi menjadi dua kelas ukuran berdasarkan ukurannya pada saat uji coba. Kelompok berukuran kecil sebanding ukurannya dengan larva yang digunakan dalam semua pengujian kinerja lainnya. Larva besar, khususnya kelompok liar, lebih analog dengan ukuran juvenil (tetapi belum bermetamorfosis; Gambar 1 ).
Lamprey muda yang digunakan dalam percobaan performa renang kami semuanya berada pada tahap akhir transformasi (Tabel 1 ; Gambar 2 ) dan semuanya diamati menggunakan cakram oral untuk menempel pada substrat (termasuk individu dengan skor tahap transformasi terendah). Skor transformasi rata-rata untuk juvenil yang diperbanyak secara buatan adalah 5,87 (kisaran 4,3–6,3), dan untuk ikan liar, adalah 6,27 (kisaran 6,3–7,0). Tidak ada perbedaan signifikan dalam panjang rata-rata juvenil yang diperbanyak secara buatan dan liar ( t = 1,29, df = 18, p = 0,213), faktor kondisinya ( t = 1,290, df = 18, p = 0,213) atau tahap transformasi ( t = 1,469, df = 18, p = 0,159) (Tabel 1 ). Akan tetapi, juvenil yang diperbanyak secara buatan memiliki rentang skor transformasi rata-rata yang lebih luas daripada ikan liar.
3.2 Respon Fotokinetik terhadap Pencahayaan Ekor
Persentase keseluruhan lamprey yang menunjukkan respons fotokinetik terhadap penerangan ekor serupa di antara jenis pemeliharaan, dengan semua dalam kisaran tingkat respons 53,7%–74,6% (Tabel 2 ). Dari 229 pengujian pada lamprey individu, 64,6% larva yang diperbanyak secara artifisial menunjukkan pergerakan dibandingkan dengan 62,9% untuk lamprey liar. Proporsi lamprey kecil yang diperbanyak secara artifisial yang bergerak secara konsisten lebih sedikit daripada proporsi lamprey besar yang diperbanyak secara artifisial (Tabel 2 ). Lamprey liar menunjukkan tren yang berlawanan, dengan lebih banyak ikan kecil yang bergerak daripada ikan besar. Untuk ikan besar, lebih banyak larva yang diperbanyak secara artifisial menunjukkan respons fotokinetik, meskipun larva liar cenderung merespons dalam waktu yang lebih singkat daripada rekan-rekan mereka yang diperbanyak secara artifisial (Tabel 2 ). Waktu respons tidak berbeda secara signifikan antara jenis pemeliharaan untuk larva kecil, meskipun lamprey kecil di kedua kelompok pemeliharaan cenderung memiliki waktu respons yang lebih cepat daripada kelompok besar yang sesuai. Rata-rata waktu respons keseluruhan untuk keempat kelompok tidak berbeda secara signifikan ( χ 2 = 7,52, p = 0,06).
| Perilaku | Ukuran sampel | Minimum | Maksimum | Rata-rata | Statistik uji |
|---|---|---|---|---|---|
| Kecil | |||||
| Performa penggalian | |||||
| Inisiasi penggalian (min) | U = 847,5, p < 0,001 | ||||
| Diperbanyak secara buatan | 57 | angka 0 | 5.5 | 0,15 | |
| Liar | 50 | 0,02 | 3.53 | 0,05 | |
| Waktu menggali (menit) | U = 639,0, p < 0,001 | ||||
| Diperbanyak secara buatan | 57 | 0,15 | 3.65 | 0,65 | |
| Liar | 50 | 0.13 | 1.37 | 0.28 | |
| Respon fotokinetik (s) | U = 503,5, p = 0,392 | ||||
| Diperbanyak secara buatan | 31 | 1 | 57 | 18 | |
| Liar | 37 | 1 | 57 | 12 | |
| % menunjukkan respons fotokinetik | Persentase yang merespons | χ2 = 6,930 , p = 0,008 | |||
| Diperbanyak secara buatan | 60 | 51,7% dari | |||
| Liar | 52 | 71,5% dari | |||
| Besar | |||||
|---|---|---|---|---|---|
| Performa penggalian | |||||
| Inisiasi penggalian (min) | U = 1729,0, p = 0,127 | ||||
| Diperbanyak secara buatan | 63 | 0,02 | 2.33 | 0,07 | |
| Liar | 65 | 0,02 | 3.03 | 0,05 | |
| Waktu menggali (menit) | U = 792,0, p < 0,001 | ||||
| Diperbanyak secara buatan | 63 | 0.23 | tanggal 11.07 | 1.23 | |
| Liar | 65 | 0,15 | 5.88 | 0.42 | |
| Respon fotokinetik (s) | Nilai U = 681,5, p = 0,458 | ||||
| Diperbanyak secara buatan | 42 | 3 | 60 | 25 | |
| Liar | 36 | 1 | 55 | 18 | |
| % menunjukkan respons fotokinetik | Persentase yang merespons | χ 2 = 5,299, p = 0,021 | |||
| Diperbanyak secara buatan | 56 | 75,0% | |||
| Liar | 64 | 56,3% | |||
3.3 Kinerja Penggalian
Larva lamprey secara konsisten mulai menggali dengan cepat, dengan median kelompok uji (ukuran dan sumber) berkisar dari 0,05 menit (3 detik) hingga 0,15 menit (9 detik). Dengan kelas ukuran digabungkan, lamprey liar memulai menggali secara signifikan lebih cepat daripada larva yang diperbanyak secara buatan ( U = 5049, p < 0,001). Lamprey liar juga menyelesaikan penggalian lebih cepat daripada larva yang diperbanyak secara buatan ( U = 3085, p < 0,001). Temuannya sama untuk kategori ukuran besar dan kecil: larva liar memiliki waktu inisiasi dan penggalian yang lebih cepat daripada lamprey yang diperbanyak secara buatan. Perbedaan ini adalah inisiasi penggalian yang signifikan pada ikan kecil dan waktu penggalian untuk kedua kelas ukuran (Tabel 2 ).
3.4 Performa Renang
Perangkat lunak pelacakan gerakan Kinovea (Charmant dan Kontributor 2021 ) memungkinkan analisis gerakan di sepanjang lintasan yang berkelok-kelok. Untuk ikan muda, kecepatan renang cepat maksimum terjadi dalam 0,5 detik pertama setelah stimulus (Gambar 5 ) dan setelah itu melambat hingga sebanding dengan kecepatan renang rutin sukarela yang kami ukur. Akibatnya, kecepatan renang cepat rata-rata untuk semua ikan muda (50,3 cm/dtk, n = 19) secara signifikan lebih cepat ( t = 4,591, df = 29, p < 0,001) daripada kecepatan renang rutin sukarela mereka (24,4 cm/dtk, n = 12).
Untuk semua larva, kecepatan renang cepat maksimum (18,3 cm/dtk, n = 17) tidak jauh lebih cepat ( U = 113,5, p = 0,843) daripada kecepatan renang rutin yang disengaja (17,8 cm/dtk, n = 14). Sementara juvenil memiliki kecepatan renang cepat yang jauh lebih tinggi daripada larva ( t = 7,956, df = 34, p < 0,001), kecepatan renang rutin yang disengaja yang kami catat tidak berbeda secara signifikan antara tahap kehidupan ( U = 77,0, p = 0,738).
Untuk juvenil, pengujian kami menunjukkan bahwa tidak ada perbedaan signifikan antara individu yang dikembangbiakkan secara buatan dan individu liar selama renang rutin spontan atau sukarela (Tabel 3 ; Gambar 6 ). Demikian pula, untuk larva yang dikembangbiakkan secara buatan dan liar, tidak ada perbedaan signifikan baik dalam renang rutin spontan maupun sukarela.
| Perilaku | Ukuran sampel | Minimum | Maksimum | Rata-rata | Statistik uji |
|---|---|---|---|---|---|
| Larva | |||||
| Kecepatan renang cepat (cm/s) | U = 22,0, p = 0,291 | ||||
| Diperbanyak secara buatan | 11 | 0.1 | 0.32 | 0.19 | |
| Liar | 6 | 0,07 | 0.43 | 0.14 | |
| Kecepatan berenang rutin (cm/s) | U = 6,0, p = 0,279 | ||||
| Diperbanyak secara buatan | 8 | 0,08 | 0.13 | 0.11 | |
| Liar | 3 | 0.11 | 0.17 | 0,15 | |
| Arena: Saatnya istirahat (menit) | U = 267,0, p = 0,213 | ||||
| Diperbanyak secara buatan | 10 | 0.13 | 9.33 | 0.72 | |
| Liar | 10 | 0.47 | 2.17 | 0.9 | |
| Tangki: Saatnya beristirahat (menit) | U = 291,0, p = 0,721 | ||||
| Diperbanyak secara buatan | 10 | 0.13 | 12.27 | 1.28 | |
| Liar | 10 | 0.42 | 5.73 | 1.19 | |
| Remaja | |||||
|---|---|---|---|---|---|
| Kecepatan renang cepat (cm/s) | Nilai t = -1,646, p = 0,118 | ||||
| Diperbanyak secara buatan | 9 | 0.13 | 0,59 | 0.51 | |
| Liar | 10 | 0.35 | 0.73 | 0.56 | |
| Kecepatan berenang rutin (cm/s) | U = 6,0, p = 0,073 | ||||
| Diperbanyak secara buatan | 5 | 0,06 | 0.2 | 0.1 | |
| Liar | 7 | 0,09 | 0,55 | 0.33 | |
| Arena: Saatnya istirahat (menit) | U = 78,0, p < 0,001 | ||||
| Diperbanyak secara buatan | 10 | 0,97 | Tanggal 13.22 | 9.52 | |
| Liar | 10 | 0.3 | 6.73 | 1.47 | |
| Tangki: Saatnya beristirahat (menit) | Nilai U = 207,0, p = 0,004 | ||||
| Diperbanyak secara buatan | 10 | 0.83 | 11.71 | 1.3 | |
| Liar | 10 | 0,03 | 3.78 | 0.48 | |
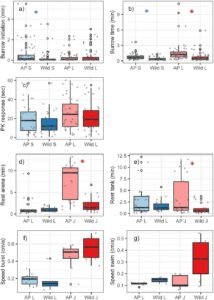
3.5 Keterikatan/Istirahat
Tidak mengherankan, larva dan remaja lamprey Pasifik menunjukkan perilaku yang sangat berbeda saat beristirahat. Larva, yang tidak memiliki cakram mulut, tidak dapat menempel pada permukaan tangki saat beristirahat. Setelah berhenti berenang, mereka akan berbaring tengkurap di satu sisi, meluruskan tubuh dan bersantai sampai dirangsang untuk bergerak lagi. Sebaliknya, remaja biasanya menempel dengan kuat di dasar tangki dan sering kali sulit dilepaskan saat dirangsang untuk bergerak, terutama untuk ikan liar. Untuk kedua tahap, kami mengamati berkurangnya waktu istirahat pada percobaan kedua dan ketiga (Frick et al. 2022 ), mungkin karena pembiasaan dengan tangki atau kelelahan. Akibatnya, hanya data dari percobaan pertama untuk setiap individu yang digunakan.
3.5.1 Waktu istirahat larva
Semua larva lamprey dari kedua kelompok perlakuan (yang diperbanyak secara buatan dan liar) beristirahat di arena dalam durasi pengujian 10 menit. Waktu rata-rata untuk pertama kali beristirahat di arena untuk larva yang diperbanyak secara buatan tidak berbeda secara signifikan dengan ikan liar (Tabel 3 ; Gambar 6 ). Demikian pula, semua kecuali satu larva (ikan yang diperbanyak secara buatan) beristirahat di akuarium dalam ketiga percobaan.
3.5.2 Waktu istirahat bagi remaja
Berbeda dengan larva lamprey Pasifik, beberapa juvenil tidak beristirahat dalam waktu 10 menit di arena percobaan. Dalam 27 percobaan yang kami lakukan dengan juvenil yang diperbanyak secara artifisial, perlekatan di arena hanya diamati dalam 14 percobaan (52%). Semua ikan liar menempel di arena selama 10 menit pertama (28 percobaan). Karena alasan ini, waktu rata-rata untuk beristirahat (perlekatan pertama) di arena untuk juvenil yang diperbanyak secara artifisial secara signifikan lebih tinggi daripada untuk ikan liar (Tabel 3 ; Gambar 6 ). Tidak ada hubungan antara tahap perkembangan dan waktu untuk beristirahat di arena untuk juvenil di kelompok liar ( t = 0,914, df = 9, p = 0,387) atau yang diperbanyak secara artifisial ( t = 0,935, df = 8, p = 0,381).
Di tangki yang lebih besar, waktu untuk istirahat (perlekatan pertama) untuk juvenil yang dibiakkan secara buatan secara signifikan lebih tinggi daripada untuk ikan liar (Tabel 3 ; Gambar 6 ). Ketika juvenil dilepaskan ke tangki yang lebih besar, lima dari 27 percobaan menggunakan ikan yang dibiakkan secara buatan berakhir setelah berenang terus menerus selama durasi tersebut (tanpa perlekatan; 18,5%). Sebaliknya, semua ikan liar dalam 28 percobaan menempel dalam periode waktu 10 menit. Tahap perkembangan tidak berhubungan secara signifikan dengan waktu untuk istirahat di tangki baik untuk juvenil liar ( t = 0,622, df = 8, p = 0,554) atau yang dibiakkan secara buatan ( t = 1,805, df = 9, p = 0,109).
4 Diskusi
Studi lintasan ikan di bendungan mengharuskan hewan penelitian yang digunakan untuk pengujian mewakili hewan liar (Cogliati et al. 2023 ). Hal ini berlaku tidak hanya untuk performa spesies (misalnya kapasitas berenang) tetapi juga untuk perilaku yang lebih halus (Cogliati et al. 2019a ). Dalam studi ini, kami membandingkan performa dan perilaku lamprey Pasifik liar dan yang dikembangbiakkan secara artifisial dan menemukan beberapa perbedaan perilaku halus yang tidak terungkap dalam pengujian kinerja renang standar (Mueller et al. 2019 ; Moser et al. 2020 ).
Larva liar mampu menggali lebih cepat daripada larva yang diperbanyak secara artifisial dengan ukuran yang sama. Sementara penggalian biasanya dimulai dalam hitungan detik dan larva terkubur sepenuhnya dalam waktu kurang dari satu menit, ikan liar menyelesaikan penggalian hampir tiga kali lebih cepat (median = 15 detik untuk kecil dan 31 detik untuk besar) daripada larva yang diperbanyak secara artifisial (median = 60 detik untuk kecil dan 80 detik untuk besar). Moser et al. ( 2020 ) tidak menemukan perbedaan dalam kapasitas menggali dari larva lamprey Pasifik yang diperbanyak secara artifisial dan liar dan melaporkan bahwa waktu menggali meningkat seiring dengan panjang total. Namun, dalam penelitian tersebut, waktu menggali didefinisikan sebagai waktu dari pelepasan ke dalam ruang uji hingga lamprey terkubur sepenuhnya, dan ukuran sampel lebih kecil. Dalam penelitian kami, eksplorasi tangki dan upaya menggali dipisahkan dari tindakan menggali itu sendiri. Kami menemukan bahwa larva yang lebih besar membutuhkan waktu lebih lama untuk menggali, seperti yang dilaporkan oleh Moser et al. ( 2020 ) untuk lamprey Pasifik dan oleh Quintella et al. ( 2007 ) untuk lamprey laut ( Petromyzon marinus ).
Kemampuan menggali penting bagi larva lamprey dan merupakan perilaku mereka yang paling khas (Quintella et al. 2007 ). Larva harus mampu menggali secara efektif untuk meminimalkan pengeluaran energi dari berenang dan membatasi kerentanan mereka terhadap pemangsaan. Sementara kami menemukan kinerja menggali yang secara statistik lebih rendah oleh larva yang diperbanyak secara artifisial, penting untuk mengevaluasi apakah temuan ini bermakna secara biologis. Baik larva lamprey yang diperbanyak secara artifisial maupun yang liar menyelesaikan penggalian dalam waktu rata-rata kurang dari 1 menit (Tabel 2 ), yang meminimalkan kekhawatiran tentang risiko pemangsaan. Dengan pengecualian satu outlier di setiap kelompok (diperbanyak secara artifisial pada menit ke-11,07; liar pada menit ke-5,88), waktu menggali maksimum adalah 1–3 menit.
Kemampuan menggali dengan cepat dan bertahan di sedimen dapat berimplikasi pada studi tentang masuknya larva ke dalam saluran pengalihan irigasi. Lamprey uji yang dibesarkan di lingkungan laboratorium berpotensi menyebar lebih jauh ke hilir setelah masuk karena mereka membutuhkan waktu sedikit lebih lama dalam kondisi statis untuk berorientasi dan menyelesaikan proses menggali dibandingkan dengan rekan-rekan mereka di alam liar. Distribusi larva yang dibesarkan di saluran irigasi untuk waktu yang lama dapat berbeda tergantung pada apakah lamprey berasal dari sumber liar atau penetasan.
Uji respons fotokinetik terkait dengan kinerja menggali, tetapi mereka mengambil langkah berikutnya menuju penilaian langsung fungsi sensorik larva lamprey Pasifik yang diperbanyak secara artifisial dan liar. Larva lamprey Pasifik menggunakan reseptor dermal pada ekor untuk mengetahui kapan mereka terkubur sepenuhnya dalam sedimen, dan penerangan reseptor ini memulai aktivitas menggali (Deliagina et al. 1995 ). Malformasi atau fungsi fotoreseptor yang berkurang dari akuakultur, jika didokumentasikan, dapat mencegah ikan yang diperbanyak secara artifisial dari merasakan cahaya secara akurat dan karena itu dapat secara langsung memengaruhi kelangsungan hidup mereka. Deformasi tahap awal kehidupan telah didokumentasikan dalam akuakultur lamprey (Lampman et al. 2021 ), jadi masalah ini layak diselidiki.
Dalam studi ini, kami menemukan sedikit bukti bahwa larva lamprey Pasifik yang dikembangbiakkan secara artifisial dan yang liar memiliki respons fotokinetik yang berbeda terhadap penerangan ekor. Prosedur kami didasarkan pada Binder et al. ( 2013 ), yang melaporkan bahwa 95% larva lamprey laut menunjukkan pergerakan sebagai respons terhadap penerangan ekor, dengan waktu respons median kurang dari 10 detik. Secara komparatif, lamprey Pasifik memiliki persentase larva yang bergerak lebih rendah sebagai respons terhadap penerangan ekor (63%–65%) dan waktu respons median yang agak lebih lambat (13–19 detik). Perbedaan ini dapat dikaitkan dengan kinerja spesies yang bervariasi, variabilitas dalam spesies, kondisi pencahayaan tertentu, atau pengaturan eksperimen dan ukuran sampel (Binder et al. 2013 , n = 20; studi kami, n = 146).
Metamorfosis menandai perubahan dramatis dari gaya hidup larva yang menggali dan menyaring makanan menjadi migrasi aktif dan pengembangan peralatan makan parasit pada juvenil. Ini termasuk pengembangan mata dan kemampuan visual dan penginderaan cahaya tambahan di kompleks pineal dan otak (Binder et al. 2013 ) dan umumnya terjadi selama migrasi aktif pada lamprey Pasifik juvenil (Clemens 2019 ). Respons fotokinetik terhadap penerangan ekor juga terkait dengan tahap kehidupan lamprey. Pada lamprey laut, Binder et al. ( 2013 ) menemukan bahwa lebih banyak larva yang bergerak sebagai respons terhadap cahaya (85%) daripada juvenil (61%) dan bahwa waktu respons larva (kurang dari 10 detik) lebih cepat daripada juvenil (sekitar 20 detik). Menggali dan menghindari cahaya adalah kemampuan penting bagi larva lamprey, yang membutuhkan koordinasi beberapa sistem dalam tubuh. Oleh karena itu, pengujian respons terhadap cahaya memberikan ukuran kuantitatif fungsi-fungsi ini, yang penting untuk penghindaran predator dan orientasi terhadap kedalaman kolom air (misalnya selama terbawa arus dalam bisul permukaan yang mungkin terjadi selama melewati bendungan; Moser et al. 2015 ). Evaluasi respons fotokinetik pada lamprey muda akan menjadi langkah logis berikutnya.
Ikan lamprey Pasifik yang dibesarkan di laboratorium mungkin terpapar pada siklus dan pola pencahayaan yang tidak alami dan heterogenitas substrat yang terbatas. Hal ini khususnya berlaku untuk juvenil yang diperbanyak secara artifisial yang kami gunakan yang dibesarkan sepanjang hidup mereka tanpa akses ke substrat batu alam atau celah lain yang menyediakan area untuk berlindung dan bersembunyi (Lampman et al. 2016, 2021 ; Moser et al. 2020 ). Kami mencatat bahwa juvenil yang diperbanyak secara artifisial lebih berorientasi pada permukaan daripada ikan liar, berenang secara refleks di antarmuka udara-air daripada di dasar tangki, dan ini bisa jadi akibat dari kondisi pemeliharaan. Apakah perbedaan perilaku ini dalam kondisi laboratorium yang relatif statis akan terwujud dalam lingkungan yang lebih kompleks seperti bendungan hidroelektrik masih harus diselidiki. Pekerjaan di masa depan harus menguji efek dari kondisi pemeliharaan yang lebih ‘mirip alam’ untuk lamprey, serupa dengan pekerjaan yang dilakukan di tempat penetasan salmonid (misalnya Chittenden et al. 2010 ).
Seperti dalam pengujian performa renang untuk renang berkelanjutan (Mueller et al. 2019 ; Moser et al. 2020 ), kami tidak menemukan perbedaan signifikan baik dalam performa renang rutin spontan maupun sukarela untuk lamprey yang dikembangbiakkan secara buatan dan yang liar. Hal ini berlaku untuk larva dan juvenil, meskipun secara keseluruhan larva menunjukkan kecepatan renang spontan yang jauh lebih rendah daripada juvenil (Gambar 6 ). Hal ini sangat menarik mengingat larva yang dikembangbiakkan secara buatan yang kami gunakan memiliki massa yang jauh lebih ringan dan kondisi yang lebih rendah daripada larva liar (Tabel 1 ; Gambar 1 ).
Kecepatan renang cepat rata-rata untuk semua larva (18,2 cm/s) sangat mirip dengan prediksi 20,2 cm/s dari sebuah model yang dikembangkan oleh Suthpin dan Hueth ( 2010 ) untuk larva lamprey Pasifik liar berukuran 70 mm. Selain itu, kecepatan renang rutin sukarela untuk larva yang kami uji adalah 17,8 cm/s. Pada kecepatan ini, Suthpin dan Hueth ( 2010 ) memperkirakan bahwa larva lamprey Pasifik liar dapat berenang selama 19,4 menit. Faktanya, dalam penelitian kami, satu larva yang diperbanyak secara artifisial berenang selama 25 menit selama percobaan pertamanya (yaitu gabungan waktu arena dan waktu tangki) tanpa pernah berhenti. Informasi ini selanjutnya menunjukkan bahwa larva yang diperbanyak secara artifisial berkinerja pada level yang mirip dengan ikan liar, meskipun kondisinya lebih rendah dan bobotnya lebih ringan.
Bagi ikan-ikan muda, kecepatan renang cepat rata-rata (50,3 cm/s) kira-kira dua kali lebih cepat dari kecepatan renang rutin sukarela (24,4 cm/s) dan juga lebih cepat dari kecepatan renang cepat bagi ikan-ikan muda lamprey laut berukuran 150 mm yang diuji dalam kondisi serupa (33,8 cm/s; Haas et al. 2023 ). Haas et al. ( 2023 ) melaporkan bahwa kecepatan renang cepat maksimum tertinggi yang tercatat bagi ikan-ikan muda lamprey laut adalah 56,7 cm/s, yang mirip dengan nilai rata-rata kami yaitu 50,3 cm/s.
Jelas, baik juvenil yang diperbanyak secara artifisial maupun yang liar mampu menghasilkan kecepatan lepas yang cepat (berenang cepat), tetapi mereka tidak mempertahankannya untuk waktu yang lama. Hal ini konsisten dengan hasil dari pengujian kinerja sebelumnya (Mueller et al. 2019 ; Moser et al. 2020 ), di mana juvenil hanya mampu membendung arus 11 cm/s selama kurang dari satu menit sebelum lelah. Menariknya, juvenil liar dalam percobaan kami menunjukkan kecepatan berenang rutin kemauan rata-rata sebesar 32,7 cm/s, tetapi mereka biasanya tidak berenang lebih dari beberapa menit sebelum beristirahat (Gambar 6 ).
Perbedaan paling mencolok yang kami temukan antara ikan yang dikembangbiakkan secara buatan dan ikan liar adalah lamanya waktu juvenil berenang sebelum beristirahat dan menempel di dasar atau sisi akuarium. Berenang terus-menerus tanpa beristirahat di arena dan akuarium jauh lebih lama untuk ikan yang dikembangbiakkan secara buatan dibandingkan dengan ikan liar (Gambar 6 ). Juvenil yang dikembangbiakkan secara buatan cenderung tidak menempel di permukaan akuarium dibandingkan ikan liar dengan ukuran yang sama. Namun, kami percaya bahwa ini lebih merupakan fungsi perilaku daripada kapasitas berenang dan daya tahan. Ikan yang dikembangbiakkan secara buatan lebih jarang menempel dan tampak berenang seperti robot di sekitar akuarium, tetap berada di dekat permukaan dan tidak memperhatikan struktur atau mengubah kecepatan gerakannya. Sebaliknya, ikan liar menunjukkan kecenderungan untuk menempel kuat pada substrat dan, ketika dirangsang, mereka sering mengubah arah dan mencari jalan keluar di sepanjang dasar sebelum menempel kembali. Seringkali diperlukan rangsangan yang sangat kuat untuk membuat mereka mulai bergerak lagi.
Perbedaan-perbedaan dalam perilaku antara kelompok-kelompok perlakuan juvenil ini dapat dikaitkan dengan perubahan-perubahan halus dalam kemampuan mereka untuk menempel dengan cakram oral selama tahap-tahap metamorfosis selanjutnya. Meskipun tidak signifikan secara statistik, skor rata-rata untuk tahap transformasi pada juvenil liar lebih tinggi dan rentangnya lebih ketat daripada skor rata-rata yang diberikan pada juvenil yang diperbanyak secara artifisial. Meskipun ini mungkin tidak tampak penting dalam konteks laboratorium, ini dapat menjadi penting untuk kinerja dalam pengaturan lapangan, khususnya untuk ikan yang membawa transponder terintegrasi pasif atau pemancar aktif yang dapat digunakan untuk mengevaluasi kelangsungan hidup saat melewati bendungan (Moser et al. 2017 ; Liedtke, Weiland, et al. 2023 ). Atas alasan-alasan ini, penelitian-penelitian di masa depan harus mempertimbangkan untuk menggunakan individu-individu pada tahap transformasi yang sama persis sejauh mungkin, karena metamorfosis adalah proses yang kompleks dan bertahap (McGree et al. 2011 ).
Perbedaan perilaku dan kinerja tidak begitu jelas dalam perbandingan larva yang dikembangbiakkan secara buatan dan yang liar. Hal ini menarik mengingat ikan yang dikembangbiakkan secara buatan yang kami gunakan tidak sekuat hewan liar dengan panjang yang sama dan mereka memiliki waktu aklimatisasi yang jauh lebih lama. Meskipun larva yang dikembangbiakkan secara buatan mungkin merupakan pengganti yang memadai untuk ikan liar, larva tersebut umumnya tidak diperlukan untuk penelitian tentang perjalanan karena ada persediaan larva liar yang lebih banyak daripada ikan muda liar.
Ikan lamprey Pasifik yang liar dan yang dikembangbiakkan secara buatan tampaknya memiliki performa renang yang serupa; namun, kelompok perlakuan ini menunjukkan perbedaan halus dalam perilaku yang berpotensi memengaruhi hasil pengujian performa di bendungan, tergantung pada jenis pengujian yang dilakukan. Ini menyoroti pentingnya melakukan uji perilaku selain pengujian performa renang yang umum, baik untuk lamprey maupun spesies akuatik lainnya di mana hewan yang dibesarkan secara buatan digunakan sebagai pengganti ikan liar (Oscar et al. 2013 ; Cogliati et al. 2019a ). Perjalanan melalui bendungan menghadirkan lingkungan sensorik yang kompleks bagi ikan dan perubahan cepat dalam kondisi hidrolik. Bagaimana ikan yang dikembangbiakkan secara buatan merespons kondisi ini akan secara langsung memengaruhi validitas pengujian yang dilakukan terhadap mereka dan harus dieksplorasi lebih lanjut.
Berdasarkan hasil ini, kami menyarankan agar pengelola berhati-hati saat mempertimbangkan penggunaan lamprey muda yang dikembangbiakkan secara artifisial sebagai pengganti bagi lamprey muda liar dalam studi peralihan. Penting untuk mengenali potensi perbedaan perilaku antara kelompok-kelompok ini. Lamprey Pasifik muda liar umumnya jumlahnya sedikit, dan jumlah yang banyak biasanya hanya tersedia selama kurun waktu yang sangat sempit (Moser et al. 2015 ). Oleh karena itu, mengembangkan praktik penetasan untuk lamprey Pasifik yang menghasilkan pengganti yang lebih mirip dengan lamprey muda liar dapat bermanfaat.
Jika perbedaan biologis antara lamprey liar dan yang dikembangbiakkan secara buatan terwujud dalam studi di sungai, mungkin perlu untuk mengkondisikan juvenil yang dikembangbiakkan secara buatan sebelum studi perjalanan untuk memastikan bahwa hewan percobaan lebih mewakili ikan liar. Untuk menghasilkan lebih banyak salmonid yang mirip dengan ikan liar, Wild Fish Surrogate Project di Oregon State University membesarkan pengganti yang dikembangbiakkan secara buatan dengan pola makan dan pemberian makan, lingkungan inkubasi dan pemeliharaan, serta kepadatan pemeliharaan yang meniru ikan liar (Cogliati et al. 2019a , Cogliati et al. 2019b , Cogliati et al. 2023 ; Pollock 2019 ). Pengganti diberi makan makanan rendah lemak dan nutrisi tinggi secara berkala untuk mensimulasikan pemberian makan di alam liar. Kepadatan pemeliharaan dikurangi, dan substrat ditambahkan ke tangki. Beberapa ide ini berpotensi diterapkan pada praktik kultur lamprey Pasifik. Penambahan sederhana berupa kecepatan aliran yang tinggi dan bervariasi dapat membantu mengondisikan ikan yang dikembangbiakkan secara artifisial ke kondisi sungai/aliran air yang realistis. Larva juga dapat dikembangbiakkan secara artifisial dan kemudian dibesarkan di lingkungan semi-alami (misalnya saluran pengalihan irigasi, kolam penampungan pembenihan) untuk pengumpulan dan penggunaan selanjutnya dalam penelitian lintas sungai.
Studi ini dikembangkan untuk mengatasi penggunaan lamprey Pasifik yang dikembangbiakkan secara artifisial untuk penelitian lintasan, tetapi memiliki implikasi untuk pelepasan larva yang dikembangbiakkan secara artifisial ke alam liar. Upaya terkini untuk memulihkan atau menambah populasi lamprey telah mencakup pelepasan lamprey yang dikembangbiakkan secara artifisial ke area terpilih dan pemantauan keberhasilannya (CRITFC 2018 ). Penggunaan ikan ini untuk menjajah kembali benteng lamprey bersejarah dapat terhambat jika ikan yang dikembangbiakkan secara artifisial lebih rentan terhadap predasi atau berperilaku berbeda dari ikan liar. Oleh karena itu, mungkin perlu melepaskan larva pada tahap perkembangan kehidupan yang sangat awal sehingga mereka mengembangkan kemampuan yang lebih alami.



