ABSTRAK
Ikan seperti hewan darat lainnya, memiliki kebutuhan khusus untuk mineral individu yang mendukung pertumbuhan dan pemeliharaan kesehatan ikan normal dan fungsi biologis lainnya di antara spesies ikan budidaya yang berbeda. Mineral ini dapat berupa mineral makro atau mikro yang dipasok ke tubuh ikan melalui makanan atau diserap dari lingkungan sekitarnya melalui kulit, insang atau saluran pencernaan. Namun, bioavailabilitas mineral ini ke tubuh ikan dipengaruhi oleh beberapa faktor, termasuk tingkat asupan nutrisi, interaksi dengan mineral atau nutrisi lain dan spesies ikan budidaya. Untuk meningkatkan bioavailabilitas yang efektif untuk ikan budidaya, diet yang berkelanjutan, sehat dan seimbang mineral harus diadopsi untuk mencapai kinerja pertumbuhan ikan yang lebih baik, dan tingkat kelangsungan hidup yang tinggi untuk produksi dan produktivitas tinggi sambil memastikan ketahanan lingkungan budidaya. Dalam tinjauan ini, komposisi mineral kuantitatif dari berbagai sumber mineral ditinjau dan dilaporkan. Selain itu, kebutuhan mineral pada beberapa ikan budidaya baik spesies ikan air tawar maupun air laut untuk lima mineral makro (kalsium, fosfor, natrium, kalium dan magnesium) dan tujuh mineral mikro (seng, besi, tembaga, mangan, yodium, kromium dan selenium) telah disusun dan dilaporkan. Ikan nila mendominasi spesies budidaya air tawar di Tanzania, diikuti oleh ikan lele dan ikan trout pelangi, sementara ikan bandeng mendominasi spesies budidaya laut yang dipraktikkan di sepanjang garis pantai dari wilayah Tanga Utara ke wilayah Mtwara Selatan. Selain itu, tinjauan ini juga mencakup informasi tentang hubungan antara mineral dan ikan budidaya, mekanisme penyerapan mineral pada ikan dan implikasi yang terkait dengan bioavailabilitas mineral baik dalam tubuh hewan akuatik maupun lingkungan sekitarnya, serta penelitian mineral dalam perspektif masa depan dalam pengembangan industri akuakultur. Oleh karena itu, tinjauan ini mencakup semua informasi ini tentang pentingnya mineral dan bioavailabilitasnya pada ikan budidaya untuk produksi dan produktivitas akuakultur berkelanjutan.
1 Pendahuluan
Populasi global diperkirakan akan terus tumbuh selama 50/60 tahun mendatang, dan diproyeksikan mencapai 10,3 miliar orang pada pertengahan 2080-an, di mana lebih dari 50% pertumbuhan populasi global diperkirakan terjadi di Afrika pada tahun 2050 (FAO 2024 ). Namun, peningkatan ini diperkirakan akan berlipat ganda di wilayah Afrika sub-Sahara (FAO 2024 ). Karena populasi terus meningkat, hal itu menyebabkan peningkatan permintaan yang sesuai untuk ikan dan produk perikanan untuk makanan (Sakschewski et al. 2014 ; Keating et al. 2014 ). Akuakultur diperkirakan menjadi salah satu subsektor paling kritis untuk diperluas untuk tujuan memberi makan populasi yang terus tumbuh karena berkurangnya sumber daya perikanan liar alami (FAO 2022 ; Xu et al. 2023a ). Saat ini, subsektor ini telah menyediakan lebih dari 50% ikan untuk konsumsi manusia pada tahun 2022 (FAO 2024 ). Pada tahun 2022, produksi akuakultur global meningkat menjadi sekitar 130,9 juta ton, di mana akuakultur darat berkontribusi sekitar 62,6% terhadap hewan akuatik yang dibudidayakan, sedangkan akuakultur laut dan pesisir berkontribusi 37,4% (FAO 2024 ). Di Tanzania, produksi akuakultur mengikuti tren yang sama dengan produksi akuakultur global, di mana produksi meningkat dari 18.716 MT pada tahun 2020 (URT 2020 ) menjadi 33.525 MT pada tahun 2024 (URT 2024 ), dengan ikan nila ( Oreochromis niloticus ) sebagai spesies budidaya yang dominan, diikuti oleh ikan lele ( Clarias gariepinus ) (Kaliba et al. 2006 ; Chenyambuga et al. 2014 ; Mmanda et al. 2020 ). Namun, peningkatan tersebut masih rendah dibandingkan dengan negara-negara Asia meskipun ada upaya pasca-pemerintah, kesesuaian wilayah, dan potensi sumber daya air yang besar untuk mendukung praktik pertanian di negara tersebut. Lambatnya pertumbuhan industri akuakultur di Tanzania dan di seluruh wilayah Afrika Timur disebabkan oleh buruknya adopsi metode dan teknologi pertanian modern, kurangnya pasokan input pertanian (pakan dan benih berkualitas), praktik manajemen yang buruk, dan kurangnya modal investasi (Mmanda et al. 2020 ).
Perluasan operasi akuakultur secara terus-menerus di seluruh dunia dikaitkan dengan meningkatnya permintaan akan diet yang seimbang, kaya akan nutrisi (seperti protein, lemak kasar, serat, karbohidrat dan mineral) dan energi (NRC 2011 ). Baik mineral makro maupun mikro merupakan elemen esensial yang dibutuhkan dalam jumlah kecil oleh ikan budidaya untuk meningkatkan penyerapan dan metabolisme nutrisi yang tepat, meningkatkan efisiensi konversi pakan dan kinerja pertumbuhan, serta meningkatkan kesehatan dan sistem kekebalan hewan akuatik. Namun, informasi tentang mineral potensial dan implikasi bioavailabilitas terkaitnya terhadap nutrisi ikan telah didokumentasikan di tempat lain di seluruh dunia. Oleh karena itu, kompilasi dan dokumentasi untuk penggunaan publik sangat dibutuhkan untuk memudahkan akses dan aplikasi untuk produksi dan produktivitas akuakultur berkelanjutan.
Mineral memainkan peran penting dalam komposisi makanan ikan, berdampak positif pada kesehatan dan pertumbuhan ikan jika hadir dalam jumlah yang tepat. Elemen-elemen ini dalam makanan ikan umumnya ditambahkan dalam dua bentuk: mineral organik atau anorganik. Mineral organik merujuk pada suplemen mineral yang berasal dari sumber alami seperti tumbuhan, hewan, atau mineral yang telah diikat secara organik (Bao dan Choct 2009 ; Świątkiewicz et al. 2014 ). Dalam konteks pakan akuakultur, mineral organik digunakan untuk menyediakan nutrisi penting bagi ikan dan organisme akuatik lainnya dalam bentuk yang mudah diserap dan digunakan oleh tubuh mereka (Ng dan Koh 2017 ). Mineral organik dikenal luas karena bioavailabilitas dan efisiensinya dibandingkan dengan suplemen mineral anorganik, yaitu, mereka lebih baik diserap, disimpan, dan digunakan oleh ikan yang dibudidayakan (Lall dan Kaushik 2021 ). Namun, mineral organik ini tidak membahayakan kinerja pertumbuhan dan kesehatan ikan secara umum, tetapi juga berkontribusi terhadap profitabilitas produsen, ekosistem perairan, dan rasa karkas/fillet ikan (Lall dan Kaushik 2021 ; Yin et al. 2024 ). Selain itu, pemanfaatan mineral organik yang tepat oleh ikan budidaya mencegah hilangnya mineral tersebut ke lingkungan, yang pada gilirannya menghindari dampak negatif pada kualitas air di lingkungan budidaya (Lall dan Milley 2008 ). Di sisi lain, beberapa mineral anorganik seperti vannamin (77 mineral organik) yang dikembangkan oleh Guybro Chemical Pvt Ltd, telah dilaporkan meningkatkan bioavailabilitas mineral mikro suplemental dari makanan dan meningkatkan kesehatan hewan air, sehingga meningkatkan hasil dan profitabilitas bagi petani skala kecil. Ke-77 mineral organik dalam vannamin ini dicirikan dengan memiliki ukuran nanopartikel, yaitu 100.000 kali lebih kecil dari mineral logam, 10.000 kali lebih kecil dari sel darah merah, dan sama ukurannya dengan molekul air. Selain itu, mineral mudah dicerna dan diasimilasi, dicerna terlebih dahulu dan bersifat hidrofilik, meningkatkan respons imun, membuang logam berat yang mengendap di dalam tubuh, merangsang penggunaan oksigen intraseluler dan memiliki muatan listrik negatif (Bedi dan Karthik 2016 ). Selain itu, mineral dapat ditambahkan dalam bentuk mineral anorganik. Mineral ini berasal dari organisme tak hidup seperti batu dan digunakan sebagai sulfida, karbonat atau oksida (Perry et al. 2007 ; Gadd 2010). Mineral-mineral ini bersifat hidrofobik dan membawa muatan listrik positif, yang menghambat pemanfaatan dan penyerapannya dalam tubuh ikan. Beberapa mineral anorganik ini bersaing untuk proses transporter dan metabolisme untuk penyerapan, sehingga membatasi bioavailabilitasnya bagi organisme akuatik. Mineral-mineral anorganik ini juga bertindak sebagai prooksidan, yang menyebabkan oksidasi pakan, sehingga memengaruhi kualitas pakan dan memerlukan penggunaan antioksidan untuk menjaga nilai gizi pakan (Desbruslais dan Wealleans 2022 ). Menurut National Research Council (NRC 2011 ), perkiraan tingkat penyerapan untuk Tembaga, Mangan, dan Seng masing-masing adalah 5%, 0,75%, dan 15% (Berrett et al. 2015 ). Chelating mineral anorganik dengan pembawa organik, yang dikenal sebagai ligan, dapat meningkatkan bioavailabilitasnya bagi ikan (Bhagwat et al. 2021 ; Caetano-Silva et al. 2021 ; Byrne and Murphy 2022 ). Penelitian sebelumnya yang dilakukan oleh Awual et al. ( 2015 ) dan Bai et al. ( 2020 ) melaporkan bahwa ligan mineral yang cocok harus tetap tidak terpisahkan dari mineral anorganik, tahan disintegrasi saat mineral berjalan melalui saluran pencernaan, menjaga mineral agar tidak terikat oleh antagonis dan menunjukkan stabilitas tinggi untuk memastikan bahwa mineral tiba utuh di tempat penyerapan. Ada sekitar 20 elemen anorganik yang dianggap penting bagi kehidupan hewan, termasuk ikan. Nutrisi penting ini dapat diklasifikasikan lebih lanjut sebagai mineral makro seperti kalsium (Ca), magnesium (Mg), natrium (Na), kalium (K), fosfor (P), klorin (Cl) dan sulfur (S), serta mineral mikro atau mineral jejak, seperti besi (Fe), seng (Zn), mangan (Mn), tembaga (Cu), yodium (I), kobalt (Co), fluor (F), vanadium (V), kromium (Cr), molibdenum (Mo), selenium (Se), nikel (Ni), timah (Sn) dan silikon (Si) (Tacon 1987 ). Selain itu, merkuri (Hg), timbal (Pb), kadmium (Cd) dan arsenik (As) dianggap mineral tidak penting dalam nutrisi ikan karena bersifat toksik dan dapat mengganggu proses metabolisme dan biokimia (Mondal et al. 2018 ; Rahman dan Singh 2019 ; Vulla et al. 2023 ).
Mineral esensial adalah mineral yang penting dalam makanan spesies ikan budidaya karena ketidakmampuan tubuh untuk memproduksi mineralnya (Drago 2022 ; Miller 2017 ). Mineral-mineral ini memainkan peran penting dalam menjaga tekanan osmotik, mengatur keseimbangan asam-basa, dan mengendalikan pH darah, hemolimfa, urin, dan cairan tubuh lainnya (Wheatly dan Gannon 1995 ; Millamena 2002 ; Su et al. 2020 ; Lall 2022 ). Selain itu, mineral-mineral ini penting untuk pembentukan jaringan lunak, enzim, vitamin, hormon, dan pigmen pernapasan tertentu yang diperlukan untuk kontraksi otot dan transmisi impuls saraf (Lall 2022 ; Gasco et al. 2018 ). Di sisi lain, ada beberapa interaksi antara mineral dan nutrisi, serta mineral dengan mineral lain seperti tembaga bersama dengan besi untuk pembentukan hemoglobin, dan mangan dengan seng dalam bentuk konformasi yang tepat dari molekul Asam Nukleat Ribosa (RNA) di hati, atau peran kalsium dan fosfor bersama-sama dalam pembentukan hidroksiapatit tulang (Hilton 1989 ; Vannucchi 1991 ; Skibsted 2016 ; O’Dell 1989 ; Lall 2022 ). Interaksi juga dapat terjadi sebagai hasil dari partisipasi simultan unsur-unsur di pusat aktif enzim, seperti besi dan molibdenumin dalam xantin oksidase atau tembaga dan besi dalam sitokrom oksidase. Selain itu, beberapa mineral seperti besi dan tembaga telah dilaporkan memainkan peran penting dalam komunitas mikroba di lingkungan budidaya (Dong et al. 2022 ). Oleh karena itu, penting untuk memasukkan mineral ke dalam makanan ikan untuk pertumbuhan dan produktivitas yang optimal dan untuk mengurangi pembuangan limbah. Meningkatkan bioavailabilitas mineral penting bagi ikan, seperti kromium, kobalt, tembaga, yodium, besi, mangan, molibdenum, selenium, dan seng, dapat meningkatkan kesejahteraan dan kesehatan ikan secara umum secara signifikan. Mineral-mineral ini dibutuhkan dalam jumlah kecil dan memainkan peran penting dalam berbagai proses biokimia, menjaga sistem koloid, dan perkembangan otot rangka (Lall dan Kaushik 2021 ; Lall 2022 ), sebagaimana dirinci dalam Tabel 1 dan 2 . Setiap penyakit, gangguan, atau gangguan pada ikan dapat dikaitkan dengan kekurangan mineral.
| Produk sampingan hewan | Ca | Bahasa Inggris: K | Tuhan | Tidak | P | Fe | M N | Aku | Seng | Lihat | Referensi |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Tepung ikan (sarden) | 3820 | 440 | 390 | 3070 | 4900 | 29 | 1.1 | 1.9 | 13.1 | 0.53 | 1 |
| Makanan darah | 3400 | 3800 | 200 | 3870 | 2800 | 202 | 6 | 12 | 24 | 0.6 | 2 |
| Makanan bulu | 12.700 orang | tahun 1400 | 800 | tahun 1320 | 8400 | 536 | 16 | 10 | 138 | 0.8 | 2 |
| Belatung lalat | tahun 1400 | 11.100 orang | tahun 2200 | 3600 | 6600 | 370 | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | 3 |
| Udang laut | 5400 | 12.400 | 3200 | 11700 | 8300 | 97 | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | 3 |
| Udang air tawar | 16.300 orang | 11.300 | tahun 1400 | 4700 | 9900 | 328 | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | 3 |
| Limbah kepala udang (Panaeus monodon) | 26.600 orang | 5900 | 4200 | 5500 | 12.300 | 223 | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | 3 |
| Panaeus spp. (Panaeus spp.) adalah nama umum untuk tanaman yang tumbuh di dataran tinggi di Amerika Serikat. | 777 | 383 | 163 | tahun 2733 | tahun 1046 | 126 | 49 | 14 | 546 | Tidak ada jawaban | 4 |
| Sisa-sisa ikan nila | 18.500 | 3900 | tahun 1600 | 4700 | 17.800 | 94 | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | Tidak ada jawaban | 3 |
| Macrobrachium rosenbergii | tahun 1290 | 433 | 90 | 2863 | 753 | 163 | 150 | 32 | 707 | Tidak ada jawaban | 4 |
Catatan: 1 Haytowitz dkk. ( 2018 ); 2 INRAE-CIRAD ; 3 Mmanda dkk. ( 2019 ); 4 Balogun dan Akegbejo-Samsons (1992). Singkatan: NQ, tidak dikuantifikasi.
| Produk sampingan pertanian | Ca | Bahasa Inggris: K | Tuhan | Tidak | P | Fe | M N | Aku | Seng | Lihat | Referensi |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Dedak jagung | 420 | 440 | 640 | 70 | 720 | 27.9 | 1.4 | 2.5 | 15.6 | 165 | 1 |
| Dedak padi | tahun 2260 | 230 | 880 | 36.1 | Tidak ada jawaban | 54.1 | 71.1 | 1.6 | 28.4 | 0,02 | 2 |
| Kue biji bunga matahari | 780 | 6450 | 3250 | 90 | 6600 | 52.5 | Tidak ada jawaban | 18.9 | 50 | 0,05 | 3 |
| Bungkil kedelai | 310 | tahun 2050 | 280 | 127 | 670 | Tidak ada jawaban | 41 | 15 | 48 | Tidak ada jawaban | 4 |
| Bungkil kedelai penuh lemak | tahun 1820 | 20.840 | tahun 2770 | 490 | 8190 | 66 | 3 | 15 | 49 | Tidak ada jawaban | 5 |
| Dedak gandum | tahun 1400 | 4450 | 4200 | 80 | 11.000 | 165 | 128 | 13 | 87 | 0.5 | 6 |
| Tepung biji kapas | tahun 2100 | 15.600 orang | 5600 | 180 | 10.500 | tahun 1565 | 26 | 22 | 93 | 0.1 | 6 |
| Poles beras | 400 | tahun 2100 | tahun 1100 | 350 | tahun 2400 | 50 | 11 | 13 | 15 | 0.1 | 6 |
| Gandum yang dipangkas | 9100 | 49.900 | 4300 | tahun 2470 | 700 | 173 | 74 | 6 | 18 | Tidak ada jawaban | 6 |
Catatan: 1 Ranum dkk. ( 2014 ); 2 Oluremi dkk. ( 2013 ); 3 Blicharz-Kania dkk. ( 2023 ); 4 Batal dkk. ( 2010 ); 5 Traina dan Breene ( 1994 ); 6 INRAE-CIRAD . Singkatan: NQ: Tidak dikuantifikasi.
Kekurangan mineral pada spesies ikan budidaya dapat memiliki dampak negatif yang signifikan pada kesehatan dan pertumbuhan mereka. Efek karena kekurangan mineral telah dilaporkan pada spesies ikan yang berbeda di tempat lain di seluruh dunia (Gatlin 2003 ; Khan et al. 2017 ; Baeverfjord et al. 2019 ; Noor et al. 2021 ; Lall 2022 ). Secara umum, pertumbuhan terhambat, katarak, hiperplasia tiroid, anoreksia, mineralisasi tulang berkurang, erosi sirip, distrofi otot dan deformitas rangka adalah beberapa efek kekurangan mineral yang telah dilaporkan pada spesies ikan budidaya (Baeverfjord et al. 2019 ; Lall 2022 ). Pada ikan, mineral mikro seperti seng, selenium dan zat besi sangat penting untuk berbagai proses fisiologis termasuk pertumbuhan, sistem kekebalan tubuh dan metabolisme; Oleh karena itu, berbagai penelitian telah melaporkan bahwa kekurangannya dapat melemahkan sistem imun, membuat ikan lebih rentan terhadap infeksi dan/atau penyakit (Gatlin 2003 ; Zheng et al. 2015; Khan et al. 2017 ; Noor et al. 2021 ). Selain itu, kalsium dan fosfor merupakan mineral esensial untuk perkembangan tulang dan sisik yang kuat pada ikan, oleh karena itu, kekurangannya dapat menyebabkan kelainan bentuk rangka seperti tulang belakang bengkok dan pertumbuhan tulang yang tidak normal (Boglione dan Costa 2011 ; Boglione et al. 2013 ; Mmanda et al. 2019 ). Selain itu, kekurangan mineral telah dilaporkan menyebabkan beberapa komplikasi reproduksi pada spesies ikan budidaya. Misalnya, kekurangan magnesium dan selenium dapat menyebabkan penurunan kesuburan dan masalah reproduksi pada spesies ikan budidaya (NRC 2011 ; Chandra et al. 2024 ). Lebih jauh lagi, kekurangan mineral esensial dapat menyebabkan peningkatan stres pada ikan, yang menyebabkan komplikasi perilaku dan penurunan kesehatan ikan secara keseluruhan. Ikan yang stres lebih rentan terhadap penyakit dan karenanya menunjukkan perilaku abnormal seperti penurunan nafsu makan dan agresi (Oliva-Teles 2012 ; Dawood 2021 ).
Oleh karena itu, mineral merupakan komponen penting dari makanan ikan dan kekurangannya memiliki efek merugikan pada kesehatan dan kesejahteraan spesies ikan yang dibudidayakan. Pembudidaya ikan perlu memastikan bahwa ikan budidaya mereka menerima jumlah mineral esensial yang cukup melalui makanan mereka untuk mencegah efek negatif ini. Dalam tinjauan ini, beberapa pertanyaan penelitian telah dibahas, yaitu (i) Apa sumber utama mineral esensial bagi spesies ikan yang dibudidayakan dan lingkungan sekitarnya; (ii) Apa saja kebutuhan mineral bagi spesies ikan yang dibudidayakan, (iii) Apa saja manfaat dan implikasi potensial yang terkait dengan komposisi mineral dalam lingkungan yang dibudidayakan; (iv) Apa saja penelitian mineral saat ini dalam perspektif masa depan dan (v) Keterkaitan antara mineral, dan nutrisi, dan antara mineral itu sendiri serta dalam peran fungsional mineral. Dokumen ini mengulas pengetahuan tentang kandungan mineral dalam semua aspek dari fisiologi ikan hingga lingkungan budidaya, dengan fokus pada penelitian terkini tentang mineral pada hewan akuatik dan media di sekitarnya, tetapi juga menggabungkan penelitian yang dikumpulkan dari berbagai sumber, sebagian besar pada penelitian sebelumnya yang dilakukan secara global untuk jangka waktu antara tahun 1989 dan 2024 dan menyusunnya untuk dokumen publik bagi generasi sekarang dan mendatang.
2 Elemen Mineral Potensial dalam Spesies Ikan yang Dibudidayakan
2.1 Unsur Makro (Kalsium, Fosfor, Magnesium, Natrium dan Kalium)
Kalsium dan fosfor sangat penting untuk pengembangan dan pemeliharaan sistem rangka dan berperan dalam beberapa proses fisiologis, termasuk keseimbangan asam-basa dalam tubuh. Sisik ikan adalah tempat utama untuk metabolisme dan pengendapan kalsium. Laju pertukaran kalsium dalam sisik ikan tiga kali lebih tinggi daripada yang ada di tulang (Larsen et al. 2000 ). Menurut penelitian yang dilakukan oleh Garrod dan Newell ( 1958 ), kandungan kalsium dalam sisik ikan nila berkisar antara 19% hingga 24% dari berat keringnya. Rasio kalsium terhadap fosfor di seluruh tubuh berbagai spesies ikan berkisar antara 0,7 hingga 1,6, sedangkan tingkat fosfor di seluruh tubuh sekitar 0,4% hingga 0,5% dari berat basah segar (Lall dan Keth 1991 ).
Ca merupakan unsur makro yang paling melimpah dalam tubuh ikan, yang berperan penting dalam pembentukan tulang dan pemeliharaan sistem rangka. Selain itu, Ca memiliki berbagai fungsi, termasuk kontraksi otot, pembekuan darah, transmisi saraf, pemeliharaan integritas membran sel, dan aktivasi beberapa enzim (Rajagopal dan Ponnusamy 2017 ; Timiras dan Navazio 2007 ; Manzini et al. 2021 ). Selain itu, Ca terikat pada fosfolipid untuk mengendalikan permeabilitas membran dan mengatur penyerapan nutrisi oleh sel (Manzini et al. 2021 ). Ikan memperoleh sebagian besar kalsium yang dibutuhkannya dari lingkungan sekitarnya. Namun, mineral seperti magnesium, seng, strontium, dan tembaga dapat mengganggu penyerapan kalsium. Meskipun kekurangan kalsium belum dilaporkan pada sebagian besar spesies ikan, kekurangan kalsium secara umum dapat mengakibatkan berkurangnya pertumbuhan, konversi pakan yang buruk, anoreksia, dan berkurangnya mineralisasi tulang (El-Mowafi dan Maage 1998 ; Musharraf dan Khan 2020 ; Andrews et al. 1973 ).
Fosfor adalah makronutrien penting setelah kalsium dalam nutrisi ikan yang dibutuhkan dalam jumlah besar. Fosfor ada sebagai fosfat anorganik (Pi) dan fosfat organik, yang mengikat molekul seperti gula dan protein, membentuk komponen penting dari setiap sel dalam tubuh (Bird dan Eskin 2021 ). Fosfat memiliki berbagai fungsi termasuk perannya dalam komponen struktural, di mana ia muncul sebagai fosfolipid, keterlibatannya dalam produksi energi (ATP) sebagai bagian dari metabolisme antara dan kontribusinya terhadap materi genetik seperti RNA dan Asam Deoksiribonukleat (DNA, Roy-Burman 2012 ; Manyanga dan Sithole 2014 ). Sebagian besar fosfat yang dibutuhkan oleh ikan diperoleh melalui makanan mereka, karena air tawar (FW) dan air laut (SW) umumnya memiliki konsentrasi fosfat yang rendah (Lall 2002 ; Lall dan Kaushik 2021 ). Pada ikan FW, spesies ikan mengeluarkan lebih banyak fosfat melalui urin dibandingkan dengan ikan SW, karena tingkat buang air kecilnya minimal pada ikan SW (Greenwell et al. 2003 ). Mengingat pentingnya fosfor dalam tubuh ikan, kekurangan fosfor pada ikan dapat menyebabkan gejala seperti pertumbuhan terhambat, anoreksia, konversi pakan buruk, mineralisasi tulang menurun, kelainan bentuk rangka, kelainan bentuk tengkorak, tulang belakang melengkung dan membesar, serta peningkatan lemak visceral (Uyan et al. 2007 ; Chen et al. 2017 ; Sugiura et al. 2004 ).
Magnesium berfungsi sebagai kofaktor dalam sejumlah reaksi enzimatik yang terlibat dalam metabolisme intermediet. Enzim-enzim ini meliputi fosfokinase, yang memfasilitasi pemindahan fosfat; pirofosfatase, yang menghidrolisis fosfat dan gugus fosfat; tiokinase, yang mengoksidasi asam lemak melalui asetil koenzim A dan sintetase asam amino, yang mengaktifkan sintesis asam amino (Lall dan Kaushik 2021 ). Lebih jauh lagi, magnesium penting untuk sistem rangka, osmoregulasi, dan transmisi saraf (Evans dan Claiborne 2008 ). Ikan memperoleh dosis Mg langsung dari air melalui insang atau dari saluran gastrointestinal. Studi yang dilakukan oleh Shearer dan Åsgård ( 1992 ) telah menunjukkan bahwa konsentrasi Mg sebesar 46 mg L −1 dalam air dihitung cukup untuk memenuhi kebutuhan Mg dari ikan trout pelangi yang diberi diet bebas Mg. Selain itu, untuk lingkungan budidaya dengan konsentrasi Mg berkisar antara 1 dan 3 mg L −1 dalam air, pakan ikan harus dilengkapi dengan konsentrasi Mg antara 0,025% dan 0,07%. Menurut temuan penelitian sebelumnya yang dilakukan terhadap defisiensi Mg pada spesies ikan budidaya seperti ikan mas dan ikan lele (Gatlin et al. 1982 ), ikan trout pelangi (Knox et al. 1981 ) dan ikan nila biru (Reigh et al. 1991 ), gejala klinis akibat efek defisiensi Mg biasanya meliputi anoreksia, pertumbuhan terhambat, kelesuan, mortalitas tinggi, kalsinosis ginjal, deformitas vertebra dan degenerasi serat otot dan sel epitel di sekum pilorus dan filamen insang. Konsentrasi Mg yang tinggi di lingkungan sekitar atau lingkungan kultur telah dilaporkan menyebabkan tingkat Mg yang lebih tinggi dalam plasma darah pada ikan (Kopp et al. 2013 ; Terech-Majewska et al. 2016 ). Namun, udang/udang galah melaporkan tingkat konsentrasi magnesium yang tinggi, sedangkan yang paling sedikit dilaporkan dalam darah sapi, diikuti oleh tepung ikan (FM, Mmanda et al. 2019 ), dan pakan komersial yang dipasok mungkin tidak sepenuhnya memenuhi kebutuhan Mg ikan (Terech-Majewska et al. 2016 ). Tanda-tanda kekurangan magnesium dalam makanan meliputi pertumbuhan yang buruk, anoreksia, kelesuan, otot lembek, kejang, kelengkungan tulang belakang, mortalitas tinggi dan kadar magnesium yang tertekan di seluruh tubuh, serum darah dan tulang (Gatlin 1996).
Natrium (Na), kalium (K), dan klorida (Cl) adalah elektrolit yang paling melimpah dalam tubuh semua organisme hidup. Natrium dan klorida masing-masing adalah kation dan anion utama dalam cairan ekstraseluler tubuh, sedangkan kalium dan magnesium adalah elektrolit intraseluler utama. Kadar Na, K, dan Cl dalam air umumnya cukup untuk memenuhi kebutuhan nutrisi dasar ikan, tetapi pakan ikan yang diberikan kepada ikan harus dicirikan oleh konsentrasi Na, K, dan Cl yang optimal untuk pertumbuhan dan perkembangan yang optimal. Unsur-unsur ini telah berperan dalam ikan termasuk mengatur tekanan osmotik dan keseimbangan asam-basa (Henry et al. 2012 ; Preuss et al. 2020 ). Kekurangan Na, K, dan Cl sulit dipelajari karena ikan memperoleh jumlah unsur-unsur ini yang cukup dari lingkungan perairan di sekitarnya. Gejala kekurangan kalium, seperti nafsu makan yang buruk, tremor, tetani, dan kematian, jarang dilaporkan, sedangkan kekurangan Na dan Cl tidak diamati. Namun, pada pH rendah, asupan Na dan Cl melalui epitel insang menurun, dan penyerapan unsur-unsur ini dari makanan lebih tinggi (Kopp et al. 2013 ; Terech-Majewska et al. 2016 ). Tingkat K dalam makanan telah meningkatkan pertumbuhan ikan secara signifikan, namun, suplementasi natrium klorida (NaCl) ke pakan ikan selama formulasi dan produksi pakan ikan telah menambahkan beberapa manfaat. Suplemen NaCl merangsang aktivitas pompa Na/K dalam mikrosom insang dan memfasilitasi adaptasi terhadap lingkungan baru. Di sisi lain, konsentrasi Cl yang lebih tinggi dalam air melindungi ikan terhadap efek berbahaya nitrat (Krupowa et al. 2005; Terech-Majewska et al. 2016 ), serta menghambat pertumbuhan mikroba dan dengan demikian menghindari wabah penyakit. Selain itu, penurunan aktivitas air (aw) substrat dianggap sebagai mekanisme penghambatan NaCl pada pertumbuhan mikroba (Terech-Majewska et al. 2016 ). Selain itu, penelitian sebelumnya telah mendokumentasikan bahwa NaCl telah memainkan peran penting dalam mengganggu pemanfaatan substrat dalam mikroorganisme (Krupowa et al. 2005; Terech-Majewska et al. 2016 ). Pengaruh NaCl sendiri dan efek interaktifnya dapat menghambat pertumbuhan mikroba dalam makanan dan media laboratorium dengan meningkatkan tekanan osmotik dan mengurangi aw, tetapi beberapa mikroba, seperti Staphylococcus aureus dan Listeria monocytogenes , dapat mentoleransi konsentrasi garam yang tinggi, sementara yang lain, seperti Escherichia coli O157:H7 lebih rentan (Robinson 2014 ).
2.2 Unsur Mikro (Besi, Tembaga, Seng, Kobalt, Yodium, Selenium, dan Mangan)
Besi (Fe) merupakan elemen esensial dalam proses respirasi seluler karena aktivitas oksidasi-reduksi dan transfer elektronnya (Koochana et al. 2018 ). Fe terutama ditemukan dalam bentuk kompleks yang terikat pada protein seperti hemoglobin, mioglobin, enzim heme termasuk sitokrom, katalase dan peroksidase, serta senyawa non-heme seperti transferin, feritin dan flavoprotein yang mengandung besi (Crichton dan Boelaert 2001 ; Teh et al. 2024 ). Konsentrasi besi dalam air sangat bervariasi karena pengaruh berbagai faktor. Senyawa Fe sangat larut dalam air dengan pH < 7, tetapi mereka mudah teroksidasi dan mengendap sebagai oksida di air permukaan. Oksida besi koloid memainkan peran penting dalam penyerapan dan koagulasi zat dan ion koloid lainnya, terutama logam jejak. Misalnya, Fe mengikat senyawa lain dalam air sungai, sementara di air asin dengan pH tinggi, ia terakumulasi di endapan dasar (Terech-Majewska et al. 2016 ). Penelitian sebelumnya telah melaporkan bahwa kadar Fe di air laut dan air tawar masing-masing diukur sebesar 0,06–44 µg L −1 dan 10–1400 µg L −1 . Penyerapan zat besi dipengaruhi oleh beberapa faktor, termasuk usia, status kesehatan, kadar zat besi, kondisi di saluran pencernaan dan bentuk zat besi organik atau anorganik. Dalam kondisi normal, defisiensi zat besi tidak mungkin terjadi kecuali disebabkan oleh diet rendah zat besi. Ketika defisiensi zat besi terjadi, hal itu dapat dikaitkan dengan gejala-gejala seperti pertumbuhan terhambat, konversi pakan yang buruk, anemia mikrositer hipokromik, kadar hematokrit dan hemoglobin rendah, penurunan zat besi plasma dan saturasi transferin besi (Oppenheimer dan Hendrickse 1983 ).
Tembaga (Cu) merupakan elemen jejak penting dalam semua organisme hidup. Ia memainkan peran penting dalam fungsi beberapa enzim yang terlibat dalam reaksi oksidasi-reduksi. Metalloenzim Cu ini penting untuk produksi energi seluler (seperti sitokrom c oksidase), melindungi sel dari kerusakan radikal bebas (seperti superoksida dismutase [SOD]), produksi neurotransmitter di otak (termasuk dopamin hidroksilase dan peptidil α-amidating monooksigenase), sintesis kolagen (seperti lisil oksidase) dan produksi melanin (tirosinase). Cu juga terikat pada protein seruloplasmin, yang ditemukan dalam sel dan plasma dan terlibat dalam pemanfaatan zat besi. Ikan dapat menyerap dosis Cu baik secara langsung dari air atau melalui pasokan dalam makanan yang mereka makan (Makwinja dan Geret al. 2020 ). Berbeda dengan ekosistem laut, Cu yang diserap dari kolom air oleh spesies ikan FW seperti nila tidak dapat memenuhi kebutuhan Cu mereka (Zhang dan Nakajima 2014 ) dan karenanya diperlukan suplemen Cu dalam makanan. Para peneliti telah menyarankan untuk menambahkan Cu ke ikan dalam kisaran yang sempit untuk menjaga keseimbangan antara memenuhi kebutuhan nutrisi dan menghindari toksisitasnya meskipun hal ini sangat sulit dicapai (Zhang dan Nakajima 2014 ; Makwinja et al. 2020 ). Karena konsentrasi Cu banyak terdapat dalam bahan pakan dan lingkungan perairan, ikan hanya akan mengalami defisiensi dalam kondisi ekstrem (Makwinja et al. 2020 ). Untuk hewan darat, gejala defisiensi tembaga meliputi anemia, kelainan tulang, depigmentasi rambut dan bulu, demielinasi sumsum tulang belakang, fibrosis miokardium, gangguan gastrointestinal, dan ruptur aorta. Kadar tembaga yang tinggi dalam air alami atau kondisi percobaan yang terkontrol dapat menyebabkan kerusakan pada insang, ginjal, dan hati, serta dapat mengurangi pertumbuhan (Leeson 2009 ; Rajeswari dan Swaminathan 2014 ). Sebuah penelitian oleh Singh dkk. ( 2008 ) meneliti dampak tembaga pada profil hematologi ikan FW. Penelitian lain oleh Pulsford dkk. ( 1995 ) melaporkan dampak tembaga pada sistem imun ikan pipih.
Seng (Zn) sangat penting karena fungsi struktural dan katalitiknya yang vital dalam lebih dari 300 protein yang memainkan peran penting dalam pertumbuhan, reproduksi, perkembangan, penglihatan, dan fungsi kekebalan ikan (Bury et al., 2003 ). Selain itu, ia memainkan peran kunci sebagai komponen dari berbagai enzim dan sebagai katalis untuk mengatur reaksi enzim yang bergantung pada seng (Kambe et al. 2015 ). Selain itu, ia juga penting untuk pertumbuhan normal, berbagai jalur metabolisme, osmoregulasi, pembentukan tulang dan sisik, biomineralisasi dan fungsi kekebalan bawaan pada ikan (Makwinja dan Geremew 2020 ). Ikan menyerap Zn langsung dari air dan pakan, tetapi bioavailabilitasnya lebih tinggi dalam makanan dibandingkan dengan air. Penyerapan seng ditentukan oleh kualitas pakan dan interaksi dengan elemen lain (Makwinja dan Geremew 2020 ). Elemen ini merupakan antagonis utama Cd dan Cu, dan penyerapan seng juga dapat dikurangi oleh Ca dan Mg (Brucka-Jastrzębska et al. 2010 ). Yuan et al. ( 2023 ) melaporkan bahwa diet yang diberi makan ikan yang kekurangan seng dapat meningkatkan penyerapan Zn dari air hingga 50% dalam beberapa kasus. Selain itu, ketergantungan ikan pada diet sebagai sumber utama penyerapan Zn berkurang karena konsentrasi Zn dalam air sangat tinggi (Niyogi et al. 2007 ). Di sisi lain, insang pada ikan dapat bertindak untuk melengkapi penyerapan Zn bila diperlukan. Sementara itu, penyerapan Zn berkurang karena konsentrasi Ca dan P meningkat dengan mengikat Zn ke kompleks fosfat yang tidak larut yang tidak diserap dari tintustin (Terech-Majewska et al. 2016 ). Bioavailabilitas seng dari pakan yang mengandung fitat dan kalsium fosfat rendah, dan kadar makanannya harus ditingkatkan melalui suplementasi Zn (Tacon 1987 ). Ketika seng disuplemenkan pada 20 mg kg −1 pakan, pertambahan berat tertinggi diamati pada ikan yang diberi seng sulfat, dan pertambahan terendah terjadi pada ikan yang diberi seng klorida (Watanabe et al. 1997 ; Terech-Majewska et al. 2016 ). Ketika hadir dalam jumlah optimal, seng mengatur metabolisme karbohidrat, lipid, dan protein. Lebih jauh, seng mungkin juga memiliki peran struktural dalam nukleoplasma dan prostaglandin (Kumar et al. 2020 ). Jumlah pasokan seng yang tidak mencukupi dapat menyebabkan masalah yang signifikan pada ikan, seperti katarak, kematian tinggi, erosi sirip dan kulit, gangguan perkembangan otot dan dwarfisme, seperti yang dilaporkan dalam beberapa penelitian termasuk Xu et al. ( 2023a ) pada ikan lele kuning, Huang et al. ( 2015 ) pada ikan nila dewasa dan Cui et al. ( 2023 ) pada ikan mas rumput.
Kobalt (Co) adalah elemen jejak penting dalam nutrisi ikan, terutama bertindak sebagai komponen vitamin B12 (Sianokobalamin) (Chanda et al. 2015 ). Vitamin ini sangat penting untuk beberapa fungsi biologis pada ikan, seperti metabolisme energi. Ini membantu metabolisme karbohidrat dan lemak, berkontribusi pada produksi energi secara keseluruhan pada ikan (Makwinja dan Geremew 2020 ). Selain itu, kobalt mendukung pertumbuhan dan pembelahan sel, yang sangat penting untuk perkembangan dan pertumbuhan benih dan juvenil ikan (Yamada 2013 ). Di sisi lain, kobalt terlibat dalam produksi asam amino, yang menekankan perannya dalam sintesis protein. Asupan Co harian rata-rata berkisar antara 0,3 hingga 1,77 mg/kg diperlukan untuk pengaturan tekanan darah yang efektif dan fungsi tiroid yang tepat pada ikan (Makwinja dan Geremew 2020 ). Penyerapan Co pada ikan FW sangat bergantung pada spesiasi Co dan konsentrasi kalsium dalam air, tetapi secara keseluruhan, efek kondisi lingkungan, termasuk pH, masih kurang terdokumentasi (Wood et al. 2012 ). Namun, konsentrasi Co yang tinggi dapat berdampak buruk pada manusia karena dapat menyebabkan polisitemia, anemia, dan gagal jantung kongestif. Oleh karena itu, sangat penting untuk mempertimbangkan kebutuhan Co selama formulasi dan produksi pakan ikan (Makwinja dan Geremew 2020 ). Ketika hadir dalam jumlah yang kurang, defisiensi kobalt dapat menyebabkan berbagai gejala klinis seperti pertumbuhan terhambat atau berkurangnya pertambahan berat badan pada ikan yang kekurangan Co (Makwinja dan Geremew 2020 ; Chanda et al. 2015 ). Gejala klinis lainnya adalah produksi sel darah merah yang buruk, yang mengakibatkan anemia, yang dapat bermanifestasi sebagai pucat atau lesu. Dalam kasus yang parah, defisiensi Co dapat menyebabkan kelainan tulang pada larva ikan yang berkembang lebih awal (Paustenbach et al. 2013 ). Selain itu, defisiensi Co dapat berdampak buruk pada kesehatan reproduksi, yang menyebabkan tingkat kesuburan yang lebih rendah atau kelainan perkembangan pada keturunan (Makwinja dan Geremew 2020 ). Terakhir, defisiensi kobalt dapat menyebabkan penurunan fungsi kekebalan tubuh, sehingga ikan lebih rentan terhadap infeksi dan penyakit (Paustenbach et al. 2013 ).
Yodium (I) sangat penting untuk fungsi tiroid karena penting untuk biosintesis hormon tiroid, tiroksin dan triiodotironin, pada ikan, burung, amfibi, reptil, dan mamalia (McNabb dan Darras 2015 ; Darras 2022 ). Lima persen dari total yodium yang diserap dalam tubuh ikan digunakan oleh kelenjar tiroid. Hormon tiroid mengendalikan oksidasi seluler dan memengaruhi pertumbuhan, kelenjar endokrin lainnya, fungsi neuromuskular, dinamika peredaran darah, dan metabolisme nutrisi utama (Riddell et al. 2003 ; Schifter et al. 2021 ). Ikan memperoleh yodium secara langsung dari lingkungan air di sekitarnya dan dalam jumlah kecil dari sumber pakan (Eckhoff dan Maage 1997 ). Hunt dan Eales ( 1979 ) melaporkan bahwa ikan trout pelangi memperoleh yodium terutama dari air (80%), diikuti oleh pakan (19%), dengan jumlah yang dapat diabaikan yang berasal dari daur ulang yodium dari degradasi hormon tiroid (kurang dari 1%). Di sisi lain, Carlsen et al. ( 2018 ) telah melaporkan bahwa yodium makanan yang direkomendasikan untuk ikan nila berada dalam kisaran 4–5 mg/kg. Namun, penelitian yang lebih komprehensif diperlukan untuk menentukan peran yodium dan kebutuhannya pada spesies FW. Tidak seperti hewan, defisiensi yodium pada ikan adalah penyebab utama hipotiroidisme, seperti yang dilaporkan dalam penelitian sebelumnya (Eales 2019 ; Triggiani et al. 2009 ).
Selenium (Se) sangat penting untuk berbagai spesies hewan, dan metabolismenya telah diteliti secara ekstensif. Ini adalah pusat aktif integral dari selenoenzim seperti glutathione peroksidase (GPx), enzim yang penting untuk melindungi sel dan membran ikan dari kerusakan oksidatif (Watanabe et al. 1997 ; Iqbal et al. 2017 ). Pada mamalia, aktivitas GPx dalam sel darah merah, plasma dan jaringan lain menurun secara korelatif dengan asupan selenium yang lebih rendah, yang diyakini berkontribusi pada tanda-tanda defisiensi selenium yang diamati pada hewan darat. Selain itu, ia bertindak sebagai agen katalitik untuk enzim yang sangat terkait dengan sistem metabolisme, endokrin dan imun pada ikan (Yada dan Nakanishi 2002 ). Ikan memperoleh selenium langsung dari air dan pakan. Ikan menelan selenium dalam jumlah besar dengan air melalui insang dan menyimpannya dalam berbagai jaringan, kecuali hati, dan dalam bentuk anorganik (Terech-Majewska et al. 2016 ). Menurut Terech-Majewska et al. ( 2016 ), selenium makanan terutama diserap dalam bentuk organik seperti selenometionina, yang sangat penting untuk kesehatan ikan, tetapi memiliki batas yang sempit antara asupan esensial dan toksisitas, sehingga memerlukan keseimbangan yang cermat. Bahan-bahan yang berasal dari hewan, seperti tepung ikan dan produk sampingan laut, sangat kaya akan Se (Beheshti et al. 2018 ; Makwinja dan Geremew 2020 ). Selain itu, bahan tanaman telah dilaporkan kaya akan kandungan Se dalam jumlah yang bervariasi (Paranamana et al. 2015 ). Gejala ikan akibat toksisitas diamati pada 13–15 mg Se kg −1 pakan atau 40–130 µg Se L −1 air (Makwinja dan Geremew 2020. Di dalam air, kadar selenium umumnya tetap di bawah 0,1 µg L −1 (Watanabe et al. 1997 ). Selain itu, kebutuhan Se untuk pertumbuhan optimum ikan nila berkisar antara 0,5 hingga 15 mg Se/kg makanan (Ning et al. 2019 ; Makwinja dan Geremew 2020 ). Seperti yang dijelaskan oleh Underwood ( 1976 ), efek toksik selenium pada hewan kemungkinan besar disebabkan oleh persaingannya dengan senyawa yang mengandung sulfur atau kecenderungannya untuk membentuk kompleks sulfur–selenium yang kuat. Namun, mekanisme biokimia yang mendasari toksisitas selenium belum sepenuhnya dijelaskan. Makanan yang tinggi sulfur atau protein dapat memberikan beberapa efek perlindungan terhadap toksisitas selenium.
Mangan (Mn) adalah elemen penting untuk pertumbuhan normal, reproduksi dan pencegahan kelainan rangka pada hewan darat dan ikan (Lin et al. 2008 ). Mangan terlibat dalam sistem biokimia sebagai aktivator enzim dan sebagai metalloenzim, misalnya, SOD (De Rosa et al. 1980). Mangan dapat diserap langsung dari air melalui insang dan saluran pencernaan, tetapi mangan dari makanan lebih mudah diserap oleh ikan. Tidak seperti logam jejak lainnya, mekanisme penyerapan Mn dari insang, usus, kulit dan jaringan lain serta toksisitas telah terdokumentasi dengan baik (Rouleau et al. 1995). Ketersediaan hayatinya terbatas pada konsentrasi Ca yang tinggi dengan adanya fitat (Watanabe et al. 1997 ). Mn dapat diberikan sebagai suplemen makanan dalam bentuk mangan sulfat atau mangan klorida daripada mangan karbonat (Terech-Majewska et al. 2016 ). ( 2008 ) melaporkan bahwa kebutuhan Mn dalam makanan yang cukup untuk ikan nila muda adalah sekitar 7 mg Mn per kilogram makanan. Suplementasi Mn yang tepat dengan mangan sulfat dalam makanan ikan telah menghasilkan pertambahan berat badan yang lebih tinggi, peningkatan sintesis protein dan penurunan sintesis lipid di hati (Watanabe et al. 1997 ; Terech-Majewska et al. 2016 ). Kebutuhan mangan ikan berkisar antara 2,5 hingga 25 mg/kg makanan (Lall dan Kaushik 2021 ). Beberapa perbedaan ini kemungkinan besar disebabkan oleh perbedaan penyerapan Mn dalam air dan bioavailabilitas Mn dalam makanan percobaan. Selain itu, penyediaan perkiraan yang baik tentang kebutuhan Mn untuk ikan telah menunjukkan kinerja pertumbuhan yang baik (Lall dan Kaushik 2021 ). Berdasarkan laju pertumbuhan spesifik dan rasio konversi pakan, kebutuhan Mn dalam makanan untuk salmon coho pasca-larva masing-masing adalah 17,35 dan 19,75 mg/kg (Liu et al. 2023 ). Defisiensi Mn dan kelebihan Mn memiliki efek negatif pada pertumbuhan dan perkembangan spesies ikan budidaya (Liu et al. 2023 ). Gejala khas defisiensi Mn pada hewan akuatik meliputi pertambahan/penurunan berat badan, deformitas rangka, kejang, gangguan perkembangbiakan, dan gangguan pergerakan. Selain itu, pertumbuhan ikan lele kuning muda terhambat karena kandungan Mn turun di bawah 3,1 mg/kg dalam makanan (Tan et al. 2011 ). Pan et al. ( 2008 ) melaporkan bahwa defisiensi Mn, khususnya ketika kandungan Mn dalam makanan lebih rendah dari 13,03 mg/kg, dapat menyebabkan deformitas rangka pada ikan mas gibel muda. Selain itu, defisiensi Mn pada kerapu muda dapat menghambat asupan pakannya, sehingga menyebabkan terhambatnya pertumbuhan dan timbulnya masalah kesehatan lainnya (Ye et al. 2009).). Selain itu, kelebihan Mn dapat menyebabkan keracunan pada spesies ikan yang dibudidayakan. Misalnya, kelebihan Mn menyebabkan ketidakseimbangan ion logam pada ikan brook charr (Gonzalez et al. 1990 ), dan kelebihan Mn mempengaruhi asimilasi glukosa pada ikan nila (Barnhoorn et al. 1999 ). Asupan Mn yang berlebihan dalam makanan ikan telah mengurangi kelangsungan hidup, pertambahan berat badan, dan efisiensi pakan hewan akuatik (Liu et al. 2023 ).
2.3 Hubungan Antara Mineral dan Kesehatan Ikan
Kesehatan ikan dipengaruhi oleh banyak faktor, dengan mineral yang memainkan peran penting dalam kesejahteraan mereka secara keseluruhan. Mineral adalah nutrisi penting yang berkontribusi pada berbagai proses fisiologis, termasuk pertumbuhan, reproduksi, dan fungsi kekebalan tubuh. Memahami hubungan antara mineral dan kesehatan ikan sangat penting untuk praktik akuakultur, konservasi lingkungan, dan keberlanjutan populasi ikan.
Kalsium dan fosfor adalah mineral penting untuk perkembangan tulang dan sisik, dengan kekurangan yang berpotensi menyebabkan kelainan bentuk rangka dan gangguan pertumbuhan; fosfor juga memainkan peran penting dalam metabolisme energi dan fungsi seluler (Jiaying et al. 2022 ; Zhao et al. 2021 ). Magnesium sangat penting untuk fungsi enzim, kontraksi otot dan transmisi saraf, dan kekurangannya dapat mengakibatkan respons stres dan peningkatan kerentanan terhadap penyakit (Lall dan Kaushik 2021 ). Selain itu, elemen jejak seperti seng dan tembaga sangat penting untuk aktivitas enzim, fungsi sistem kekebalan tubuh dan mekanisme pertahanan antioksidan, dan kekurangan mineral ini dapat mengganggu pertumbuhan dan meningkatkan kerentanan terhadap infeksi (Stefanache et al. 2023 ; Ermakov dan Jovanović 2022 ).
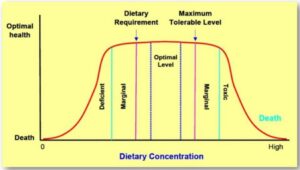
Mineral sangat penting untuk kesehatan ikan, tetapi ketidakseimbangan, baik karena kekurangan atau kelebihan, dapat menyebabkan masalah kesehatan yang signifikan. Kekurangan mineral penting dapat mengakibatkan masalah seperti pertumbuhan yang buruk, respons imun yang melemah, dan peningkatan mortalitas. Misalnya, kekurangan selenium dapat menyebabkan degenerasi otot, peningkatan kerentanan terhadap infeksi virus (Lescure et al. 2009 ; Guillin et al. 2019 ) dan memberikan efek perlindungan terhadap toksisitas logam berat seperti kadmium dan merkuri (Lall 1989 ). Di sisi lain, kekurangan atau kelebihan zat besi dapat memengaruhi fungsi sistem imun dan pertahanan inang terhadap infeksi pada ikan (Bhaskaram 1988 ). Menurut Lall et al. ( 1985 ), diet yang mengandung 4,5 mg yodium per kilogram sangat penting untuk melindungi salmon Atlantik dari infeksi penyakit ginjal bakteri (BKD). Namun, asupan mineral tertentu yang berlebihan dapat bersifat toksik, karena kadar tembaga yang tinggi dapat menyebabkan kerusakan hati dan mengganggu fungsi fisiologis normal (Gaetke dan Chow 2003 ), lihat Gambar 1. Sangat penting untuk memantau komposisi mineral air dan pakan untuk mencegah toksisitas tersebut. Selain itu, hubungan antara mineral dan kesehatan ikan memengaruhi seluruh ekosistem, dan limpasan nutrisi dari praktik pertanian dapat menyebabkan eutrofikasi, mengubah komposisi mineral lingkungan perairan dan berdampak pada populasi ikan (Tiwari dan Pal 2022 ; Naeem et al. 2014 ). Eutrofikasi dan perubahan komposisi mineral di media perairan dapat mengakibatkan mekarnya alga berbahaya yang menghasilkan racun yang merugikan kesehatan ikan dan mengganggu jaring makanan. Dalam akuakultur, mineral tertentu dapat digunakan secara strategis untuk meningkatkan kesehatan ikan; misalnya, menambahkan probiotik atau mineral organik dapat meningkatkan kesehatan usus dan penyerapan nutrisi, sehingga meningkatkan pertumbuhan dan ketahanan terhadap penyakit yang lebih baik (Vulla et al. 2024 ). Namun, efektivitas praktik ini bergantung pada spesies dan kondisi lingkungan tertentu.
2.4 Mekanisme Penyerapan Mineral pada Organ Vital Ikan Budidaya
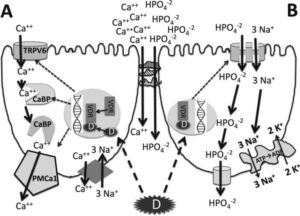
Mekanisme penyerapan mineral pada organ vital merupakan interaksi kompleks dari proses biokimia yang mendukung berbagai fungsi fisiologis yang penting untuk menjaga kesehatan ikan. Mineral sangat penting untuk berfungsinya organ vital dengan baik, berkontribusi pada berbagai proses fisiologis. Kalsium sangat penting untuk kesehatan tulang, kontraksi otot, dan fungsi jantung (Theobald 2005 ; Berchtold et al. 2000 ), sementara kalium mengatur fungsi saraf, irama jantung, dan keseimbangan cairan di ginjal (Palmer dan Clegg 2016 ). Magnesium mendukung produksi energi, relaksasi otot, dan kesehatan kardiovaskular (Fatima et al. 2024 ). Zat besi sangat penting untuk transportasi oksigen dalam sel darah merah, reaksi enzimatik, dan fungsi kekebalan tubuh (Hod dan Spitalnik 2012 ; Vogt et al. 2021 ). Seng berperan penting dalam aktivitas enzimatik, respons imun, dan penyembuhan luka (Awad et al. 2019 ; Kishawy et al. 2020 ), sedangkan selenium memberikan pertahanan antioksidan, mendukung fungsi tiroid, dan meningkatkan kesehatan jantung (Ventura et al. 2017 ; Kumar et al. 2018 ). Asupan mineral yang seimbang sangat penting untuk kesehatan dan kesejahteraan secara keseluruhan, karena kekurangan atau ketidakseimbangan dapat menyebabkan masalah kesehatan yang serius.
Penyerapan mineral pada ikan terutama terjadi melalui insang dan sistem pencernaannya, yang memungkinkan mereka untuk memanfaatkan nutrisi penting dari lingkungan perairannya secara efektif. Di insang, sel-sel epitel khusus memfasilitasi penyerapan mineral terlarut dari air di sekitarnya melalui mekanisme transpor aktif dan difusi pasif (Evans et al. 2005 ). Proses ini dipengaruhi oleh faktor-faktor seperti salinitas air, pH, dan konsentrasi mineral tertentu. Selain itu, ikan menyerap mineral melalui makanannya, di mana makanan yang dicerna dipecah dalam saluran pencernaan, yang memungkinkan mineral dilepaskan dan diserap terutama di usus (Bakke et al. 2010 ). Epitel usus mengandung protein transpor dan saluran yang membantu penyerapan selektif mineral penting seperti kalsium, magnesium, dan fosfor serta elemen jejak seperti zat besi dan seng (Miller 2017 ). Efisiensi penyerapan mineral dapat dipengaruhi oleh berbagai faktor, termasuk tingkat asupan nutrisi dan bentuk kimianya (Fitat), daya cerna makanan yang memasok mineral, jenis metode pengolahan pakan, spesies ikan yang dibudidayakan, keadaan fisiologis dan patologis ikan yang dibudidayakan, kondisi lingkungan dan keberadaan ion atau zat yang bersaing dalam air atau makanan (Lall dan Kaushik 2021 ). Secara keseluruhan, mekanisme penyerapan mineral pada ikan disetel dengan baik untuk memastikan penyerapan mineral individu yang memadai, yang sangat penting untuk fungsi fisiologis, pertumbuhan dan kesehatan secara keseluruhan. Misalnya, mekanisme penyerapan beberapa mineral kationik (Ca 2+ , K + , Na + ) seperti yang ditunjukkan pada Gambar 2 .
3 Sumber Mineral dalam Ikan
Ikan, seperti hewan lainnya, membutuhkan mineral untuk pertumbuhan, perkembangan dan kesehatannya, dimana sumber utamanya adalah makanan/pakan atau diperoleh langsung dari air budidaya atau lingkungan sekitarnya (Lall dan Kaushik 2021 ). Proses penyerapan mineral ditentukan oleh berbagai faktor, sebagian besar konsentrasi mineral di media akuatik tetapi juga parameter air lainnya (Terech-Majewska et al. 2016 ). Oleh karena itu, konsentrasi mineral harus ditentukan sebelum memulai rejimen suplementasi di fasilitas budidaya. Berbeda dengan spesies ikan FW, spesies ikan laut budidaya memperoleh dosis harian mineral (unsur makro/mikro) seperti kalsium, tembaga, besi, magnesium, kalium, natrium, selenium dan seng langsung dari badan air di sekitarnya daripada dari makanan/pakan seperti yang dilakukan pada spesies ikan FW (Gatlin 1996). Pakan ikan untuk ikan budidaya diformulasikan menggunakan bahan pakan lokal, yang digunakan sebagai nutrisi (protein, lipid, serat, mineral dan karbohidrat) atau sumber energi. Namun, kandungan mineral dalam bahan pakan lokal bervariasi dari satu zona geografis ke zona geografis lainnya karena beberapa faktor, seperti jenis tanaman, tahap kematangan tanaman, kesuburan tanah atau lingkungan budidaya, jenis tanah (tanah vulkanik, lembah retakan, dataran tanah dan pegunungan), konsentrasi mineral tanah/air dan kondisi iklim. Selain itu, pemrosesan, penyimpanan dan kemungkinan kontaminasi sampel sebelum analisis dapat berdampak pada konsentrasi mineral (Salvador et al. 2014 ; Funakawa et al. 2012 ; Abdulkarim et al. 2016 ; Onyango et al. 2018 ; Mmanda et al. 2019 ).
Bahan pakan lokal sebagai sumber utama mineral pada ikan dikelompokkan menjadi beberapa kelompok, yaitu produk sampingan hewani, produk sampingan pertanian, daun tanaman, produk sampingan industri, produk sampingan fermentasi, produk anorganik, dan tanaman air (Mmanda et al. 2019 ; Mmanda 2020 ). Sumber mineral lainnya termasuk air tawar dan air laut (Terech-Majewska et al. 2016 ).
3.1 Produk Sampingan Hewan
Produk sampingan hewani, seperti FM, darah sapi, sisa ikan nila, cacing tanah, udang air tawar dan laut, tepung tulang dan daging, tepung bulu, tepung tulang, dan kerang laut, merupakan sumber mineral penting dalam ikan budidaya. Produk sampingan ini kaya akan kalsium, fosfor, magnesium, zat besi, seng, tembaga, dan selenium, yang penting untuk berfungsinya berbagai proses fisiologis pada ikan dan bentuk kehidupan akuatik lainnya (Lall 2022 ; Mmanda et al. 2019 ; Haytowitz et al. 2019 ; Sreng et al. 2020 ). Komposisi mineral bahan pakan lokal asal hewan ditunjukkan pada Tabel 1 . Kandungan mineral yang dilaporkan dalam sebagian besar bahan-bahan ini berkisar antara 0,9 hingga 17,8 g P, <0,1 hingga 26,6 g Ca, 3,2–12,4 g K, 2,4–11,7 g Na, <0,1 hingga 4,2 g Mg, 94–370 mg Fe dan 3–294 mg I (Mmanda et al. 2019 ; NRC 2011). Di sisi lain, Basis Data Nutrisi Nasional USDA untuk Referensi Standar telah melaporkan bahwa komposisi mineral FM (ikan sarden) adalah sebagai berikut: Ca (3820 mg/kg), Fe (29,2 mg/kg), Mg (390 mg/kg), P (4900 mg/kg), K (3970 mg/kg), Na (3070 mg/kg), Zn (13,1 mg/kg), Cu (1,9 mg/kg), Mn (1,1 mg/kg), dan Se (0,527 mg/kg) (Haytowitz et al., 2019 ). Sementara tepung darah dilaporkan mengandung Mg (200 mg/kg), K (3800 mg/kg), Na (3870 mg/kg), Zn (24 mg/kg), Cu (12 mg/kg), Mn (6 mg/kg), Fe (2202 mg/kg), Se (0,6 mg/kg), Co (0,1 mg/kg), Mo (0,2 mg/kg) dan I (0,4 mg/kg) ( INRAE-CIRAD , https://feedtables.com/content/blood-meal ). Namun, sebuah penelitian yang dilakukan oleh Vulla et al. ( 2023 ) telah melaporkan kandungan timbal (Pb) yang tinggi dalam sampel tepung darah sapi, yang merupakan logam berat yang beracun. Hal ini diasumsikan disebabkan oleh pemberian pakan timbal oleh sapi dari berbagai sumber di peternakan. Oleh karena itu, disarankan untuk memeriksa status regulasi tepung darah sebelum menggunakannya dalam pakan ikan. Komposisi mineral dari beberapa produk sampingan hewan yang umum digunakan dalam makanan spesies ikan budidaya telah dirangkum dalam Tabel 1 .
3.2 Hasil Sampingan Pertanian
Produk sampingan pertanian seperti dedak jagung, polesan beras, pollard gandum, dedak padi, kedelai penuh lemak, kacang kedelai, bungkil biji kapas, bungkil biji bunga matahari dan bungkil kacang kedelai telah ditinjau dan didokumentasikan. Produk sampingan dari pertanian ini sekarang digunakan sebagai bagian dari makanan untuk spesies ikan yang dibudidayakan. Ini membantu menyediakan nutrisi penting seperti protein, lipid, serat, karbohidrat dan mineral esensial (Kari et al. 2023 ). Penggunaan produk sampingan pertanian dalam makanan ikan telah mengurangi persaingan untuk bahan-bahan yang juga digunakan untuk makanan manusia, dan mengurangi ketergantungan pada bahan pakan mahal seperti FM, bungkil kedelai, kedelai penuh lemak dan minyak ikan (FO). Produk sampingan pertanian mudah diakses dan terjangkau bagi petani ikan skala kecil (Verdegem et al. 2021 ). Produk sampingan pertanian seperti dedak jagung, dedak padi, polesan beras, dedak gandum dan pollard gandum merupakan sumber energi yang baik untuk ikan; Bungkil biji kedelai, kedelai penuh lemak, bungkil biji kapas, bungkil kacang tanah, dan bungkil biji bunga matahari merupakan sumber protein nabati yang baik dan digunakan sebagai pengganti FM dalam pakan ikan (Mmanda et al. 2020 ). Komposisi mineral berbagai produk sampingan pertanian yang umum digunakan dalam akuakultur dari berbagai penelitian disajikan dalam Tabel 2 .
3.3 Produk Sampingan Industri
Produk sampingan industri seperti ragi bekas bir (BSY) dan biji-bijian bekas bir (BSG) merupakan sumber mineral penting yang berharga dalam akuakultur (Mmanda et al. 2020 ; Jackowski et al. 2020 ; Estévez et al. 2022 ). Produk sampingan tersebut mengandung mineral dalam kadar yang signifikan seperti kalsium, fosfor, magnesium, zat besi, selenium, kromium, dan tembaga (Murugan 2015 ; Ikram et al. 2017 ; Mmanda et al. 2019 , Mmanda 2020 ; Jin et al. 2022 ). ( 2016 ) melaporkan bahwa komposisi mineral makro ekstrak BSY adalah 12,3 g/kg Na, K (9,15 g/kg), Ca (0,03 g/kg) dan Mg (0,27 g/kg), sedangkan untuk mineral mikro adalah 0,19 mg/kg Cr (0,19 mg/kg), Fe (17,6 mg/kg), Mn (5,64 mg/kg), Co (0,3 mg/kg), Mo (0,03 mg/kg), Zn (199 mg/kg), Cu (3,64 mg/kg) dan Se (0,3 mg/kg). Menurut Mussatto dan Roberto ( 2006 ), komposisi mineral BSG adalah Ca (3,52 g/kg), Na (0,31 g/kg), K (0,26 g/kg), Mg (1,96 g/kg) dan P (5,19 g/kg), sedangkan unsur mikro adalah Fe (193,4 mg/kg), Mn (51,4 mg/kg), Cu (18 mg/kg), Zn (178 mg/kg) dan Cr (5,9 mg/kg). Di sisi lain, molase gula merupakan hasil samping industri pengolahan gula, baik yang berasal dari tebu maupun bit. Hasil samping ini juga dimanfaatkan dalam aktivasi mikroba potensial seperti mikroorganisme efektif untuk kandungan nutrisi pakan hewan darat maupun hewan air melalui fermentasi. Komposisi mineral pada ampas tebu adalah sebagai berikut: Ca (9,1 g/kg), P (0,7 g/kg), Mg (4,3 g/kg), K (6,4 g/kg) dan Na (2,47 g/kg), serta mineral mikro seperti Zn (18 mg/kg), Cu (6 mg/kg) dan Fe (173 mg/kg) (de Souza et al., 2015 ). Sedangkan pada ampas bit, komposisi mineralnya adalah: Ca (1,1 g/kg), P (0,3 g/kg), Mg (0,3 g/kg), K (6,4 g/kg), Na (6,8 g/kg), sedangkan Zn (22 mg/kg), Cu (17 mg/kg) dan Fe (154 mg/kg) ( INRAE-CIRAD ; https://www.feedtables.com/content/molasses-sugarcane ). Pemanfaatan produk sampingan industri sebagai sumber mineral dalam akuakultur dapat membantu mengurangi biaya dibandingkan dengan premix mineral komersial dan meningkatkan keberlanjutan lingkungan dengan mengurangi limbah dari pabrik bir.
3.4 Produk Sampingan Fermentasi Menggunakan Mikroba
Produk sampingan yang dihasilkan selama proses fermentasi berfungsi sebagai sumber mineral penting bagi organisme akuatik. Selama fermentasi, bakteri dan enzim yang berguna memecah produk sampingan bahan organik, sehingga meningkatkan bioavailabilitas mineral esensial (Humer dan Schedle 2016 ). Hasilnya, ikan dapat dengan mudah menyerap dan memanfaatkan mineral esensial ini dari produk sampingan yang difermentasi, menyediakan sumber mineral alami dan berkelanjutan pada spesies ikan yang dibudidayakan. Beberapa penelitian telah melaporkan manfaat penggunaan produk sampingan yang difermentasi untuk meningkatkan kandungan mineral esensial dalam makanan ikan (Samaddar et al. 2015 ; Marti-Quijal et al. 2020 ; Cahya et al. 2022 ; Siddik et al. 2024 ). Menurut Dan et al. ( 2017 ) komposisi mineral bungkil kedelai nonfermentasi adalah sebagai berikut: Fe (78,6 ug/g), Cu (18,2 ug/g), Zn (48 ug/g), P (7,1 mg/g) dan Ca (3,1 mg/g), dibandingkan dengan bungkil kedelai fermentasi menggunakan Bacillus cereus telah melaporkan Fe sebesar 83 ug/g, Cu (20 ug/g), Zn (51 ug/g), P (9,5 mg/g) dan Ca (4,5 mg/g). Di sisi lain, komposisi mineral bungkil kedelai fermentasi menggunakan Staphylococcus caprae adalah sebagai berikut: Fe (80,5 ug/g), Cu (19,8 ug/g), Zn (49,5 ug/g), P (8,8 mg/g) dan Ca (3,8 mg/g) (Dan et al. 2017 ). Demikian pula, beberapa penelitian telah mengungkap potensi manfaat proses fermentasi terhadap peningkatan kandungan mineral bahan pakan lokal dengan menggunakan berbagai mikroba spp., seperti penggunaan Lactobacillus spp . pada fermentasi; dedak gandum dalam pakan ikan nila ( O. niloticus , Flefil et al. 2022 ), bungkil biji wijen dalam pakan benih ikan rohu, Labeo rohita (Mukhopadhyay dan Ray 1999 ; Roy et al. 2014 ); bungkil kedelai dalam pakan ikan karang Sebastes spp . (Lee et al. 2016 ), tepung sisa kepala udang pada pakan ikan lele dumbo C. gariepinus (Nwanna 2003 ), tepung kanola pada pakan ikan nila Nil ( O. niloticus , Plaipetch dan Yakupitiyage 2014), tepung bunga matahari pada pakan ikan nila Nil (Hassaan et al. 2018 ) dan bubuk sargassum (Ardiansyah et al. 2018 ).
3.5 Daun Tanaman
Daun tanaman seperti daun ubi jalar, daun singkong, daun kelor dan daun talas mengandung unsur mineral esensial tingkat tinggi yang penting dalam pakan ikan untuk meningkatkan pertumbuhan, meningkatkan kekebalan tubuh dan meningkatkan kesejahteraan ikan secara keseluruhan (Anjolin et al. 2010; Reverter et al. 2017 ; AEgwui et al. 2013 ). Selain itu, daun tanaman dalam makanan ikan mengurangi ketergantungan pada sumber pakan ikan tradisional yang mahal atau terbatas. Pencantuman ini memungkinkan petani ikan untuk menyediakan makanan yang lebih seimbang dan kaya mineral untuk spesies ikan yang dibudidayakan. Daun tanaman, seperti daun ubi jalar, daun singkong, daun pepaya, daun kelor dan daun talas, merupakan sumber mikronutrien yang berkelanjutan dan ramah lingkungan untuk budidaya ikan, menciptakan sistem pertanian yang lebih ramah lingkungan (Dorothy et al. 2018 ). Komposisi mineral dari daun tanaman terpilih ini disajikan dalam Tabel 3 . Namun, meskipun padat mineral, daun tanaman mengandung sejumlah besar faktor antinutrisi (ANF) yang dapat menghambat penyerapan nutrisi pada ikan dan memiliki daya cerna yang lebih rendah pada ikan karnivora. Beberapa penelitian telah melaporkan keberadaan ANF di daun tanaman yang berbeda (Fasuyi 2005 ; Anbuselvi dan Muthumani 2014 ; Jamil dan Bujang 2016 ; Temesgen et al. 2016 ; Dako et al. 2016 ; Olusola dan Olaifa 2018 ). Menurut Fasuyi ( 2005 ) dan Jamil dan Bujang ( 2016 ), daun singkong mengandung kadar tinggi glikosida sianogenik dan ANF seperti tanin, senyawa fenolik dan asam fitat. Di sisi lain, daun talas dilaporkan mengandung kadar oksalat, inhibitor proteinase, fitat, tanin, alkaloid, steroid, dan glukosida sianogenik yang tinggi (Lewu et al. 2010 ; Temesgen et al. 2016 ). Demikian pula, daun ubi jalar dilaporkan mengandung kadar alkaloid, saponin, tanin, steroid, antosianin, flavonoid, dan antrakuinon yang tinggi (Anbuselvi dan Muthumani 2014 ; Dako et al. 2016 ). Selain itu, daun pepaya mengandung kadar fitat dan oksalat yang tinggi (Olusola dan Olaifa 2018 ). Oleh karena itu, daun-daun ini harus diproses dengan benar sebelum dimasukkan dalam formulasi dan produksi makanan ikan untuk menghindari konsekuensi negatif apa pun.
| Tumbuhan air | Ca (g) | K (g) | Mg (gram) | Tidak (g) | P (g) | Besi (mg) | Timah hitam (mg) | Tembaga (mg) | Seng (mg) |
|---|---|---|---|---|---|---|---|---|---|
| Daun talas | 1.11 1 | Tidak ada jawaban | 0,45 1 | 0,03 1 | 0.6 1 | 23 1 | 7.1 1 | 2.7 1 | 4.1 1 |
| Daun ubi jalar | 2.30 2 | 4,80–42,8 2 | 2.20–9.11 2 | 0,08–8,82 2 | 1.31–26.4 2 | 19–218 2 | 17–109 2 | 7–19 2 | 12–32 2 |
| Daun singkong | 0,68–1,20 3 | 0,12–0,16 3 | 20–70 3 | 32,8–33,5 3 | Tidak ada jawaban | 321–458 3 | 77–153 3 | 17–23 3 | 36–69 3 |
| Daun pepaya (hijau) | 8.61 4 | 2.89 4 | 0,07 4 | 1.78 4 | Tidak ada jawaban | 90.5 4 | 9.5 4 | Tidak ada jawaban | Tidak ada jawaban |
| Daun pepaya (coklat) | 4.36 4 | 0,47 4 | 0,35 4 | 0,32 4 | Tidak ada jawaban | 79.8 4 | 4.5 4 | Tidak ada jawaban | Tidak ada jawaban |
| Daun Kelor | 0.20 | 0,07 | 0,06 | Tidak ada jawaban | 0.57 | 346.3 | 117 | 545 | 552 |
1 Mitharwal dkk. ( 2022 ); 2 Matahari dkk. ( 2014 ); 3 Oresegun dkk. ( 2016 ); 4 Ayoola dan Adeyeye ( 2010 ). Singkatan: NQ: Tidak dikuantifikasi.
3.6 Tumbuhan Akuatik
Tumbuhan air, seperti duckweed, azolla, ipomoea spp ., selada air, dan kubis air, merupakan sumber mineral yang kaya (Mandal dan Bera 2024 ). Tumbuhan ini dapat menyerap nutrisi seperti nitrogen, fosfor, dan kalium dari air di sekitarnya, sehingga mencegah eutrofikasi (Su 2021 ; Solovchenko et al. 2016 ; Mao et al. 2021 ; Beuckels et al. 2015 ). Ketika tumbuhan air ini ditambahkan ke sistem budidaya, mereka dapat menyerap nutrisi tersebut dan menyimpannya di dalam tubuh mereka. Ketika dikonsumsi oleh ikan budidaya, ikan dapat memperoleh nutrisi penting dari tumbuhan, meningkatkan kesehatan dan pertumbuhan mereka secara keseluruhan. Mineral dalam tumbuhan air seperti mikroalga tersedia dengan mudah dan mudah diserap oleh ikan dibandingkan dengan suplemen mineral sintetis (Fox dan Zimba 2018 ). Hal ini memastikan bahwa ikan memperoleh nutrisi yang diperlukan untuk pertumbuhan dan perkembangan optimal mereka. Tokuşoglu dan Üunal ( 2003 ) menganalisis profil nutrisi dari tiga jenis mikroalga: Spirulina platensis, Chlorella vulgaris , dan Isochrisis galbana . Penelitian ini menemukan bahwa sampel spirulina mengandung jumlah nutrisi rata-rata berikut: 1413 mg kalium, 929 mg natrium, 926 mg kalsium, 750 mg fosfor, 389 mg magnesium, 95 mg zat besi, 4,3 mg mangan, 2,7 mg seng, 0,3 mg tembaga, 0,12 mg selenium, dan 0,11 mg kromium. C. vulgaris ditemukan kaya akan fosfor (1762 mg), natrium (1346 mg), kalium (750 mg), kalsium (594 mg), magnesium (344 mg), zat besi (259 mg), mangan (2,1 mg), seng (1,2 mg), selenium (0,1 mg), tembaga (0,06 mg) dan kromium (0,02 mg). Selain itu, Tokuşoglu dan Üunal ( 2003 ) melaporkan bahwa I. galbana kaya akan fosfor (1252 mg), kalium (1193 mg), natrium (1109 mg), kalsium (1081 mg), magnesium (687 mg), zat besi (228 mg), mangan (5,7 mg), seng (2,7 mg), tembaga (1,5 mg), selenium (1,02 mg) dan kromium (0,6 mg). Dalam sebuah penelitian oleh Appenroth et al. ( 2017 ) tentang nilai gizi tanaman lemna ( Wolffia microscopica ), diketahui bahwa tanaman lemna mengandung mineral per kilogramnya yaitu kalsium (6 g/kg), kalium (83 g/kg), magnesium (3 g/kg), natrium (0,3 g/kg), fosfor (7 g/kg), serta mikronutrien seperti zat besi (240 mg/kg), mangan (755 mg/kg), tembaga (3,52 mg/kg), seng (31 mg/kg), yodium (0,75 mg/kg) dan selenium (0,06 mg/kg). Bungkil azolla juga dapat berfungsi sebagai pembawa mineral mikro pada pakan ternak. Penelitian yang dilakukan oleh Alalade dan Iyayi ( 2006)) pada komposisi kimia dan nilai gizi tepung azolla ditemukan kandungan mineral sebagai berikut yang dinyatakan dalam persentase bahan kering: kalsium (1,16%), fosfor (1,29%), kalium (1,25%) dan magnesium (0,35%), serta mineral-mineral jejak dalam miligram per kilogram seperti mangan (174,42 mg/kg), seng (87,59 mg/kg), tembaga (16,74 mg/kg), besi (755,73 mg/kg) dan natrium (23,79 mg/kg). Komposisi mineral dari tanaman air lainnya, seperti Ipomea aquatica , selada air dan teratai, yang merupakan sumber mineral penting bagi spesies ikan budidaya, telah diperoleh dari berbagai penelitian dan disajikan dalam Tabel 4 .
| Tumbuhan air | Ca (g) | K (g) | Mg (gram) | Tidak (g) | P (g) | Besi (mg) | Timah hitam (mg) | Tembaga (mg) | Seng (mg) | Se (mg) | Referensi |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mikroalga ( Spirulina platensi ) | 0,93 | 1.41 | 0.39 | 0,93 | 0,75 | 95 | jam 4.30 | 0.30 | 2.70 | 0.12 | 1 |
| Mikroalga ( Chlorella vulgaris ) | 0,59 | 0,75 | 0.34 | 1.35 | 1.76 | 259 | 2.10 | 0,06 | 1.20 | 0.10 | 1 |
| Mikroalga ( Isochrisis galbana ) | 1.08 | 1.19 | 0.69 | 1.11 | 1.25 | 228 | 5.70 | 1.50 | 2.70 | 1.02 | 1 |
| Rumput laut | Jam 6.00 | 83.0 | 3.00 | 0.30 | Jam 7.00 | 240 | 755 | 3.52 | 31.0 | 0,06 | 2 |
| Bunga Azolla | 11.6 | 12.5 | 3.5 | 23.79 | 12.9 | 756 | 174 | 16.7 | 87.6 | Tidak ada jawaban | 3 |
| Ipomea aquatica (daun) | 0,04 | jam 4.45 | Jam 2.30 | 0.40 | 226 | 155 | 8.20 | 36.1 | 25.0 | Tidak ada jawaban | 4 |
| Ipomea aquatica (batang) | 0,07 | 5.56 | 2.23 | 1.00 | 130 | 150 | Jam 7.30 | 15.4 | Jam 2.30 | Tidak ada jawaban | 4 |
| selada air | 2.97 | 9.73 | 4.12 | 3.17 | Tidak ada jawaban | 195 | 116 | 6.50 | 64.7 | Tidak ada jawaban | 5 |
| Eceng gondok | 3.25 | 8.75 | 3.97 | 2.97 | Tidak ada jawaban | 189 | 118 | 7.60 | 63.0 | Tidak ada jawaban | 5 |
| Bunga lili air | 3.25 | 8.67 | 3.13 | 3.88 | Tidak ada jawaban | 186 | 113 | 5.70 | 61.4 | Tidak ada jawaban | 5 |
Catatan: 1 Tokuşoglu dan Üunal ( 2003 ); 2 Appenroth dkk. ( 2017 ); 3 Alalade dan Iyayi ( 2006 ); 4 Ndamitso dkk. ( 2015 ); 5 Adelakun dkk. ( 2016 ). Singkatan: NQ: Tidak dikuantifikasi.
3.7 Produk Anorganik
Ahli gizi memanfaatkan produk anorganik seperti batu kapur, pupuk industri, dan premix mineral dalam operasi akuakultur sebagai sumber penting mineral esensial seperti kalsium, magnesium, dan karbonat, yang vital untuk pertumbuhan dan perkembangan organisme akuatik (Boyd 2017 ; Truong et al. 2023). Selain itu, batu kapur membantu meningkatkan kualitas air dengan membantu pembuangan nutrisi berlebih seperti fosfor dan nitrogen, yang jika hadir secara berlebihan, dapat menyebabkan eutrofikasi badan air dan kualitas air yang buruk (Frątczak et al. 2019 ; Jones 2014 ; Naeem et al. 2014 ). Pupuk anorganik yang umum digunakan seperti kalium nitrat, amonium nitrat, dan superfosfat menyediakan mineral esensial bagi tanaman air dan alga untuk pembangunan berkelanjutan industri akuakultur (Green 2022 ; Løes 2023 ). Garam mineral seperti kalsium klorida, magnesium sulfat, dan kalium klorida dimasukkan ke dalam sistem pertanian untuk memasok nutrisi penting seperti kalsium, magnesium, dan kalium ke organisme akuatik yang dibudidayakan. Dolomit adalah mineral alami lain yang biasanya digunakan sebagai sumber kalsium dan magnesium dalam sistem pertanian, membantu menjaga pH dan alkalinitas air (Sadooni dan Al Awadi 2009 ). Zeolit, mineral alami, berfungsi sebagai sumber elemen jejak penting seperti tembaga, seng, dan mangan dalam operasi akuakultur (Nicula et al. 2010 ; Abbas et al. 2021 ).
3.8 Sumber Mineral Lain bagi Organisme Akuatik
Hewan air, tidak seperti hewan darat, dapat menyerap mineral anorganik tertentu dari lingkungan mereka baik di lingkungan FW atau laut (Lall 2007 ; Lall dan Kaushik 2021 ). Komposisi mineral FW dan air laut dapat bervariasi tergantung pada kondisi yang berbeda. Menurut Cole ( 1983 ), komposisi rata-rata dalam hal kation adalah sebagai berikut: untuk FW, Ca 2+ (60,9%), Mg 2+ (19%), Na + (16,6%) dan K + (3,5%); sedangkan air laut mengandung Ca 2+ (3,3%), Mg 2+ (10,3%), Na + (83,5%) dan K + (3%). Karena variasi komposisi mineral air dalam kondisi dan lokasi geografis yang berbeda, pembudidaya ikan perlu menilai konsentrasi mineral dalam air sebelum memulai operasi budidaya ikan atau memulai program suplementasi mineral apa pun di tambak ikan.
Untuk air tawar, ikan FW berisiko tinggi mengalami overhidrasi dan kehilangan mineral dalam lingkungan hipotonik (Greenwell et al. 2003 ; Terech-Majewska et al. 2016 ). Air tawar berfungsi sebagai sumber alami mineral penting seperti magnesium, kalsium, natrium, dan kalium, yang vital untuk pertumbuhan dan kesejahteraan ikan (Terech-Majewska et al. 2016 ; Ullah et al. 2022 ). Ikan FW mengonsumsi sedikit air untuk mengimbangi mineral yang hilang melalui buang air kecil dan menerima mineral tersebut melalui insang dan kulit (Lall dan Tibbetts 2009 ; Webster dan Lim 2015 ; Lall 2022 ) dan mendistribusikannya ke seluruh tubuh mereka untuk mendukung berbagai proses fisiologis (Evans et al. 2005 ). Namun, meskipun menyerap sejumlah mineral dari lingkungan sekitar, mereka memerlukan suplementasi mineral makanan baik untuk zat gizi mikro maupun makro karena jumlah mineral yang diserap ikan dari air sulit diukur dan tidak dapat mencukupi kebutuhannya.
Untuk air laut, spesies ikan laut hidup dalam lingkungan hipertonik, yang membuat mereka berisiko terus-menerus mengalami dehidrasi karena kehilangan air melalui insangnya (Greenwell et al. 2003 ; Terech-Majewska et al. 2016 ). Untuk mengatasi situasi ini, mereka biasanya mengonsumsi sedikit air yang setara dengan 50% dari berat tubuh mereka setiap hari (Kültz 2015 ). Sebagian besar ikan laut memperoleh kebutuhan mineral harian mereka, seperti kalsium, zat besi, magnesium, kalium, natrium, selenium dan seng, dari air dan bukan dari pakan mereka. Namun, beberapa mineral seperti fosfor, seng, tembaga dan mangan harus dilengkapi melalui perawatan makanan mereka (Terech-Majewska et al. 2016 ; El-Said et al. 2021 ; Lilly et al. 2017 ). Berbagai macam mineral yang ada dalam air laut memungkinkannya untuk mengatur tingkat pH dan salinitas dalam sistem budidaya, sehingga menciptakan lingkungan yang stabil dan optimal bagi ikan yang dibudidayakan (Saraswathy et al. 2015 ). Hal ini penting untuk mengurangi stres dan meningkatkan pertumbuhan, produksi, dan produktivitas ikan serta kesejahteraan ikan.
4 Kebutuhan Mineral pada Beberapa Jenis Ikan yang Dibudidayakan
Berbeda dengan hewan darat, kebutuhan mineral makanan untuk sebagian besar spesies ikan budidaya tidak terdokumentasi dengan baik. Kesulitan ini muncul dari tantangan dalam melakukan penelitian pada spesies akuatik (Davis dan Gatlin 1996 ). Beberapa penelitian telah berupaya untuk mendokumentasikan kebutuhan mineral dari berbagai spesies ikan melalui berbagai percobaan dan uji lapangan, yang disajikan dalam Tabel 5 untuk nila, lele, ikan mas, pangasius dan ikan trout pelangi, dan Tabel 6 untuk ikan bandeng, salmon, kakap merah dan ikan cloaka besar. Meskipun ada variasi dalam kebutuhan mineral di antara spesies ikan budidaya berdasarkan penelitian yang berbeda, jelas bahwa melengkapi pakan akuakultur dengan suplemen mineral atau bahan-bahan yang tinggi kandungan mineral direkomendasikan untuk berbagai proses fisiologis dan metabolisme pada spesies ikan budidaya.
| Spesies ikan | Ca
(%) |
P
(%) |
Tuhan
(%) |
Bahasa Inggris: K
(%) |
Seng
(mg) |
Fe
(mg) |
Aku
(mg) |
M N
(mg) |
SAYA
(mg) |
Lihat
(mg) |
Kr
(mg) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ikan nila | 0,17–0,65 15 | 0,90 1 | 0,06–0,08 15 | 0,50 15 | 26—29, 5 105–115 7 | 150–160 3 | 4 3 | 7 5 | R | 0,57 6 | 0.4 10 |
| Ikan lele | ≤atfi 1 | Tidak ada | 0,40 8 | 0.26 15 | 150 1 | ≤HY 1 | 5 2 | 25 1 | R | 0,1–0,25 1 | 0.33 11 |
| Ikan mas | ≤arps 1 | 0,6–0,7 1 | 0,04–0,05 1 | 0,60–0,70 15 | 15–30 1 | 147 4 | 3 2 | 12–13 1 | R | R 8 | 0,31–3,64 12
2 13 |
| Ikan patin | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada | 2–4 9 |
| Ikan trout pelangi | 0.24 1 | 0,70 1 | 0,05 1 | 0,7– 0,8 15 | 150 1 | 270 14 | 3 2 | 12–13 1 | R | 0,07–0,38 1 | 0,15–0,38 8 |
1 Takon ( 1987 ); 2 Gatlin dan Wilson ( 1986 ); 3 Shiau dan Su ( 2003 ); 4 Ling dkk. ( 2010 ) 4 ; 5 Lin dkk. ( 2008 ); 6 Ning dkk. ( 2020 ); 7Li dan Huang ( 2016 ); 8De Silva ( 1991 ); 9 Akter dkk. ( 2021 ); 10 Mehrim ( 2014 ); 11 Kaiser dkk. ( 2023 ); 12 Cui dkk. ( 2018 ); 13 Cui dkk. ( 2022 ); 14 Evliyaoğlu dkk. ( 2022 ); 15 Davis dan Gatlin ( 1996 ).
Singkatan: NQ: Tidak dikuantifikasi.
| Spesies ikan | Tidak
(%) |
P
(%) |
Tuhan
(%) |
Bahasa Inggris: K | Seng
(mg) |
Fe
(mg) |
Aku
(mg) |
M N
(mg) |
Saya (mg) | Se (mg) | Kr
(mg) |
| Ikan Bandeng | Tidak ada | 0,86 3 | Tidak ada | Tidak ada | R 4 | Tidak ada | Tidak ada | R 4 | Tidak ada | Tidak ada | Tidak ada |
| Ikan salmon | 0,06 1 | 0.7 1 | 0,05 1 | 0.7 1 | 50 1 | 60 1 | 3 1 | 15 1 | 1 1 | 0.3 1 | Tidak ada |
| Drum merah | 2 2 | 0,86–2 2 | Tidak ada | Tidak ada | 20–25 2 | 330 4 | Tidak ada | Tidak ada | Tidak ada | Tidak ada | Tidak ada |
1 Lall dan Milley ( 2008 ); 2 Gatlin ( 2002 ); 3 Borlongan dan Satoh ( 2001 ); 4 Prabhu et al. ( 2016 ). Singkatan: N/Q: Tidak dikuantifikasi.
5 Implikasi Terkait Bioavailabilitas Mineral pada Ikan
Tidak seperti hewan, semua organisme akuatik memerlukan mineral untuk fungsi fisiologis dan biokimia mereka serta untuk mempertahankan proses kehidupan normal mereka. Hewan akuatik, khususnya ikan hidup dalam berbagai tingkat salinitas (<0,5 ppt) untuk air tawar, antara 0,5 dan 30 ppt untuk air payau (air payau), dan 33–37 mg L −1 untuk lingkungan air tawar (Evans dan Claiborne 2008). Berbeda dengan vertebrata lainnya, hewan akuatik menyerap mineral dari makanan mereka serta lingkungan sekitarnya. Namun, pertukaran ion dari insang dan kulit ikan di air sekitarnya mempersulit penentuan kebutuhan makanan kuantitatif (Evans dan Claiborne 2008). Insang dianggap sebagai rute utama penyerapan mineral yang terbawa air pada spesies ikan FW, sementara spesies laut menunjukkan perilaku minum wajib sebagai bagian dari keseluruhan mekanisme osmoregulasi fisiologis mereka untuk mempertahankan cairan tubuh internal yang secara substansial hipotonik terhadap salinitas eksternal SW (Evans dan Claiborne 2009). Oleh karena itu, spesies FW bergantung pada mineral makanan dari saluran pencernaan sebagai sumber mineral utama, sedangkan ikan laut bergantung pada mineral makanan dan mineral yang terbawa air. Namun, beberapa ikan seperti salmonid terdiri dari siklus hidup anadromus yang hidup di FW dan SW, di mana mereka secara bertahap beradaptasi dengan lingkungan laut dan memperoleh unsur-unsur anorganik dengan meminum air laut, mirip dengan ikan laut (Lall dan Kaushik 2021 ). Penyerapan mineral mungkin bervariasi di antara ikan karena perbedaan sekresi asam lambung pada ikan dengan lambung dan ikan agastrik atau tanpa lambung (Lall 2002 ), serta penyerapan mineral dari lingkungan air sekitarnya (Lall dan Kaushik 2021 ). Penelitian sebelumnya yang dilakukan pada ikan telah menunjukkan bahwa kebutuhan mineral secara signifikan dipengaruhi oleh bioavailabilitasnya, yang mencerminkan penyerapan nutrisi termasuk mineral dari berbagai bentuk suplemen pakan, bahan pakan, dan sumber lain seperti air. Namun, suplementasi mineral makanan yang dibutuhkan untuk ikan (baik mineral makro maupun mineral mikro) sulit ditentukan karena kemampuannya menyerap mineral dari lingkungan budidaya, sehingga sulit mengukur jumlah yang diserap dari pakan versus air (Terech-Majewska et al. 2016 ). Oleh karena itu, Ammerman (1995) telah menyarankan bahwa penekanan lebih besar harus diberikan pada tingkat di mana elemen yang dicerna dapat digunakan untuk metabolisme. Di sisi lain, diketahui bahwa mineral berinteraksi dengan nutrisi atau mineral lain karena kemampuan dan kecenderungannya untuk membentuk ikatan kimia (Lall dan Kaushik 2021 ).
Interaksi mineral didefinisikan sebagai ‘hubungan timbal balik antara unsur-unsur mineral sebagaimana terungkap melalui konsekuensi fisiologis atau biokimia’ (O’Dell 1997). Karena adanya interaksi timbal balik antara ion dan senyawa kimia, efek biologis suatu unsur ditentukan oleh keberadaan ion atau zat kimia lainnya. Interaksi ini dikategorikan sebagai positif atau sinergis, atau antagonis. Interaksi positif langsung telah dilaporkan antara unsur-unsur dalam proses struktural, seperti tembaga dan besi untuk pembentukan hemoglobin, kalsium, fosfor, dan magnesium untuk pembentukan hidroksiapatit tulang, dan interaksi mangan dengan seng untuk bentuk konformasi molekul RNA yang tepat di hati. Selain itu, hubungan antagonis telah dilaporkan terjadi ketika unsur-unsur jejak dengan konfigurasi elektronik dan radius ionik yang sama bersaing untuk tempat pengikatan, seperti seng dan kadmium dalam metalotionin, dan substitusi /mangan di tempat aktif enzim. Misalnya, hubungan antagonis kemungkinan besar terjadi di saluran pencernaan melalui mekanisme sederhana, yang melibatkan reaksi kimia yang membentuk senyawa kompleks tak larut antara mineral seperti tembaga dan sulfur untuk membentuk tembaga sulfida atau mineral dan komponen makanan lain seperti seng yang dikombinasikan dengan asam fitat untuk membentuk fitat (Lall dan Kaushik 2021 ). Selain itu, berbagai macam interaksi antara mineral potensial dengan mineral lain, dan mineral dengan vitamin juga telah dilaporkan pada ikan (Hilton 1989 ). Selain itu, hewan akuatik mengakumulasi mineral berlebihan dari air yang dapat berinteraksi dengan unsur mineral lain dan menghambat protein yang memfasilitasi pengangkutan ion esensial (Bury et al. 2003 ; Wood 2012 ; Brix et al. 2017 ; Lall dan Kaushik 2021 ). ( 2017 ) melaporkan reaksi bersaing yang mencakup persaingan antara ligan biotik dengan kation lain (misalnya Na + , H + , Ca2 + ) dan reaksi kompleksasi bersaing untuk logam oleh ligan lain dalam larutan termasuk anion anorganik (misalnya klorida, hidroksida, sulfida), serta ligan organik seperti karbon organik terlarut. Misalnya, akumulasi Cu pada insang ikan mengganggu penyerapan Na + , sehingga mengganggu keseimbangan ionik dalam organisme, dan menyebabkan toksisitas (Grosell 2012 ; Lall dan Kaushik 2021 ). Demikian pula, Cd dan Zn mengganggu penyerapan Ca pada insang ikan, yang menyebabkan hipokalsemia dan toksisitas (Hogstrand et al. 1996 ; Lall dan Kaushik 2021). Namun, kemampuan ikan untuk mengatur konsentrasi tinggi elemen jejak yang berasal dari air bervariasi di antara spesies ikan yang berbeda. Rute utama penyerapan beberapa mineral, seperti Se, merkuri (Hg) dan arsenik (As), adalah transfer trofik melalui rantai makanan. Menurut penelitian yang dilakukan oleh Handy ( 1996 ) dan Lall dan Kaushik ( 2021 ) telah melaporkan bahwa ikan tertentu dapat mengeluarkan proporsi tinggi dari asupan mineral yang berlebihan untuk mengatur konsentrasi dalam tubuh mereka pada tingkat yang relatif normal. Laporan oleh Lall dan Kaushik ( 2021 ) telah mengungkapkan bahwa elemen jejak yang larut dalam air dianggap lebih beracun dibandingkan dengan asupan mineral makanan yang lebih tinggi seperti Cu, Fe dan Zn.
6 Implikasi Terkait Komposisi Mineral pada Media Akuatik
Mineral adalah senyawa kimia anorganik (tidak berbasis karbon) yang terjadi secara alami di Bumi dengan komposisi kimia dan sifat fisik yang pasti dan dapat diprediksi (O’ Donoghue 1990 ). Dalam tabel periodik, 118 unsur telah ditemukan di Bumi, 90 di antaranya terjadi secara alami dalam jumlah yang cukup besar, yang hanya 29 yang penting untuk kehidupan ikan, termasuk hidrogen, karbon dan oksigen (Lide 2008 ). Proporsi yang lebih besar dari materi hidup terdiri dari enam elemen struktural dasar seperti karbon, hidrogen, oksigen, nitrogen, fosfor dan sulfur, dan unsur-unsur ini biasanya dalam proporsi yang lebih tinggi dan dibutuhkan dalam gram (Remick dan Helmann 2023 ). Selain itu, lima mineral makro seperti kalsium, magnesium, natrium, kalium dan klorin juga dibutuhkan dalam jumlah tinggi (Ali 2023 ; Lippert 2020 ). Unsur-unsur yang tersisa dibutuhkan dalam jumlah yang sangat kecil, seperti dalam miligram atau mikrogram per kilogram. Unsur-unsur ini dianggap penting ketika asupan yang kurang menyebabkan gangguan fungsi, ketika pemulihan kadar fisiologis unsur tersebut mencegah atau meringankan kekurangan. Organisme tidak dapat tumbuh atau menyelesaikan siklus hidupnya tanpa unsur yang dimaksud. Unsur tersebut harus memiliki pengaruh langsung pada organisme dan terlibat dalam metabolisme. Efek dari unsur penting tidak dapat sepenuhnya digantikan oleh unsur lain.
Gagasan ‘segala sesuatu dalam jumlah sedang’ memiliki relevansi signifikan dalam praktik akuakultur, khususnya mengenai keseimbangan unsur-unsur mineral dalam makanan ikan dan lingkungannya. Jika konsentrasi tinggi mineral-mineral ini dapat menyebabkan efek kesehatan yang merugikan dan toksisitas lingkungan, dan pasokan yang tidak memadai dapat menyebabkan kekurangan nutrisi, mengganggu pertumbuhan dan meningkatkan kerentanan terhadap penyakit (Lall dan Kaushik 2021 ). Misalnya, elemen-elemen jejak vital seperti seng dan selenium memainkan peran penting dalam proses metabolisme dan fungsi kekebalan tubuh; namun, kadar yang berlebihan dapat menyebabkan stres oksidatif dan ketidakseimbangan biokimia (Sumana et al. 2023 ; Xu et al. 2023b ; Uddin et al. 2024 ). Di sisi lain, asupan mineral-mineral ini yang tidak mencukupi dapat mengakibatkan pertumbuhan terhambat, kinerja reproduksi yang buruk dan peningkatan kerentanan terhadap infeksi. Oleh karena itu, menyeimbangkan kadar mineral sangat penting untuk mengoptimalkan kesehatan ikan, memastikan perkembangan yang kuat dan menjaga stabilitas ekosistem secara keseluruhan. Menerapkan formulasi diet yang tepat dan memantau tingkat mineral lingkungan merupakan strategi penting bagi praktisi akuakultur untuk menegakkan keseimbangan yang rapuh ini, sehingga mendorong praktik budidaya ikan berkelanjutan yang menghasilkan populasi ikan yang sehat dan tangguh (FAO 2022 ). Sebagian besar ikan laut menerima dosis harian makro/mikronutrien, seperti kalsium, tembaga, zat besi, magnesium, kalium, natrium, selenium, dan seng dari air, bukan dari makanan (Gatlin 1996). Mikromineral diserap dari air, yang ditelan melalui mulut dan masuk melalui insang, kulit, dan sirip (Terech-Majewska et al. 2016 ).
Ikan FW berada pada risiko konstan overhidrasi dan kehilangan garam di lingkungan hipotonik. Mereka minum air dalam jumlah yang sangat sedikit untuk mengimbangi mineral yang hilang bersama urin dan menerima nutrisi mineral dari air melalui insang (Terech-Majewska et al. 2016 ; Lall dan Kaushik 2021). Berbeda dengan ikan FW, ikan laut memiliki kebutuhan yang lebih rendah untuk mineral makanan karena mereka menyerap sebagian besar dari air sekitar (Cowey et al. 1977 ). Suplementasi makanan yang dibutuhkan dengan makronutrien dan mikronutrien sangat sulit ditentukan, dan jumlah nutrisi yang diserap oleh ikan dari air juga sulit diukur (Terech-Majewska et al. 2016 ).
7 Perspektif Masa Depan dalam Penelitian Mineral
Penelitian tentang mineral dalam nutrisi ikan merupakan bidang yang terus berkembang, dengan beberapa area penting yang kemungkinan akan menjadi fokus penelitian di masa mendatang. Para ilmuwan tengah menjajaki teknik dan metode baru untuk meningkatkan penelitian mineral melalui pendekatan inovatif. Berikut ini adalah beberapa studi penelitian mineral yang sedang berlangsung:
- Ketersediaan hayati mineral: Mengeksplorasi ketersediaan hayati berbagai sumber mineral (organik vs. anorganik) dalam makanan ikan sangatlah penting. Penelitian di masa mendatang perlu difokuskan pada pemahaman tentang bagaimana berbagai formulasi mineral memengaruhi penyerapan dan pemanfaatan pada berbagai spesies ikan.
- Kebutuhan mineral menurut spesies: Spesies ikan yang berbeda memiliki kebutuhan mineral yang berbeda pula. Para peneliti cenderung melakukan penelitian tentang kebutuhan mineral spesifik dari spesies ikan yang kurang diteliti dan penting secara ekonomi untuk mengoptimalkan formulasi diet dan memastikan populasi ikan yang sehat.
- Dampak faktor lingkungan: Peneliti dan ilmuwan diharuskan menyelidiki bagaimana faktor lingkungan seperti kualitas air, suhu dan kontaminan memengaruhi ketersediaan dan penyerapan mineral pada spesies ikan budidaya.
- Mineral dan akuakultur berkelanjutan: Para peneliti berkonsentrasi pada pengintegrasian sumber mineral alternatif, seperti produk sampingan dari pertanian, industri atau akuakultur, ke dalam pakan ikan untuk meningkatkan keberlanjutan sekaligus memenuhi kebutuhan nutrisi, termasuk mineral.
- Mineral berinteraksi dengan nutrisi lainnya: Penelitian di masa depan meneliti bagaimana mineral yang berbeda berinteraksi dengan vitamin, protein, dan asam lemak dalam makanan ikan dan bagaimana interaksi ini dapat memengaruhi kesehatan ikan secara keseluruhan dan efisiensi nutrisi.
- Pakan fungsional dan nutraseutika: Ada kebutuhan untuk melakukan penelitian tentang pengembangan pakan fungsional untuk meningkatkan profil mineral untuk manfaat kesehatan tertentu, seperti meningkatkan laju pertumbuhan, kinerja reproduksi dan ketahanan terhadap penyakit.
- Studi genomik dan proteomik: Kemajuan dalam biologi molekuler telah menghasilkan peningkatan penelitian yang bertujuan untuk memahami bagaimana ikan memetabolisme dan memanfaatkan mineral pada tingkat seluler, termasuk peran gen dan protein spesifik dalam penyerapan dan pengangkutan mineral.
- Mineral sebagai aditif pakan, dan suplemen, misalnya kalsium dan magnesium: Penggunaan mineral sebagai aditif pakan dalam nutrisi ikan merupakan bidang yang semakin diminati, terutama terkait unsur-unsur penting seperti kalsium dan magnesium. Mineral-mineral ini memainkan peran penting dalam kesehatan, pertumbuhan, dan proses metabolisme ikan secara keseluruhan dan sangat penting untuk berbagai fungsi fisiologis seperti pembentukan tulang, aktivitas neuromuskular, dan osmoregulasi.
8 Kesimpulan
Dengan terus meningkatnya produksi dan produktivitas akuakultur global, mineral telah terbukti memainkan peran penting dalam pencernaan makanan ikan dan penyerapan nutrisi, meningkatkan kesehatan dan kinerja pertumbuhan ikan, serta meningkatkan kualitas air, yang dibutuhkan untuk meningkatkan pertumbuhan dan hasil ikan. Penggunaan unsur mineral yang tepat dalam industri akuakultur telah dianggap sebagai salah satu strategi berharga untuk produksi ikan berkelanjutan, dan sangat direkomendasikan bagi petani ikan karena menawarkan keuntungan ekonomi dan keberlanjutan lingkungan.
Dalam tinjauan ini, kami telah menyusun dan mendokumentasikan secara komprehensif pentingnya mineral dan bioavailabilitasnya dalam makanan ikan budidaya, sumber utama mineral ini dalam ikan budidaya, kebutuhan mineral dalam spesies ikan budidaya, implikasi yang terkait dengan bioavailabilitas mineral dalam organisme akuatik atau komposisinya dalam media akuatik dan terakhir penelitian mineral dalam perspektif masa depan. Oleh karena itu, dokumentasi informasi tentang mineral dalam industri akuakultur ini akan meningkatkan daya cerna pakan ikan, meningkatkan kinerja pertumbuhan dan tingkat kelangsungan hidup, meningkatkan respons imun, merangsang pemanfaatan oksigen intraseluler dalam tubuh ikan, dan dengan demikian meningkatkan hasil dan keuntungan budidaya ikan skala kecil. Selain itu, informasi wawasan ini akan membantu mengurangi dampak negatif pada kualitas air di lingkungan budidaya.



