ABSTRAK
Percobaan pemberian pakan selama empat bulan dilakukan untuk mengevaluasi efek penggantian tepung ikan (FM) menggunakan larva lalat tentara hitam (BSFL) pada komposisi asam lemak ikan lele. Pakan yang mengandung 35% kandungan protein kasar (CP) diformulasikan dengan BSFL menggantikan FM pada D 1 (50:50), D 2 (25:75), dan D 3 (75:25) dan diuji menggunakan pakan komersial D 4 . Lima puluh benih ikan lele, masing-masing seberat (5,6±0,5) g, ditebar per tangki dalam 12 tangki berkapasitas 1000 L dan diberikan perlakuan pakan. Seluruh jaringan tubuh, hati, dan otot diperoleh dari ikan percobaan dan dianalisis untuk komposisi asam lemak menggunakan kromatografi gas di laboratorium. Hasil penelitian menunjukkan variasi yang signifikan (p< 0,05) dalam komposisi asam lemak antara perlakuan pakan dan jaringan ikan yang dianalisis. Tingkat penyertaan BSFL dalam pakan berdampak pada komposisi asam lemak jaringan ikan. Nilai yang diperoleh untuk asam lemak jenuh (SFA) dan asam lemak tak jenuh tunggal (MUFA) untuk jaringan ikan yang dianalisis lebih tinggi dibandingkan dengan nilai yang diperoleh untuk SFA dan MUFA dalam makanan. Nilai yang diperoleh untuk asam lemak tak jenuh ganda (PUFA) untuk jaringan ikan lebih rendah dibandingkan dengan nilai yang diperoleh untuk PUFA dalam makanan. Jaringan otot ikan yang diberi makan D 2 dan D 3 masing-masing memperoleh kadar SFA dan MUFA tertinggi, sementara seluruh jaringan tubuh ikan yang diberi makan D 1 memperoleh nilai tertinggi untuk PUFA. Jaringan hati untuk ikan yang diberi makan D 3 dan D 1 memperoleh kadar MUFA dan PUFA yang jauh lebih tinggi. Konsentrasi PUFA tertinggi dalam jaringan ikan diperoleh untuk D 1 dengan penggantian BSFL 50%; dengan demikian, D 1 direkomendasikan untuk formulasi makanan ikan lele.
1 Pendahuluan
Ikan menyumbang lebih dari 30% protein hewani yang dipasok ke 60% orang yang tinggal di negara-negara berkembang (Balami et al. 2019 ) dengan perusahaan akuakultur berkontribusi secara signifikan terhadap pasokan asam lemak esensial (EFA) (Maranga et al. 2022 ). Ikan mengandung semua EFA yang memberikan manfaat kesehatan ketika dikonsumsi dalam makanan manusia (Pal et al. 2018 ). Di Afrika, ikan telah diperoleh dari perikanan tangkap untuk waktu yang sangat lama. Namun, perikanan tangkap yang dieksploitasi secara berlebihan tidak dapat memenuhi permintaan ikan yang terus meningkat; dengan demikian, kekurangannya dapat dipenuhi melalui akuakultur (FAO 2018 ). Meskipun inisiatif akuakultur dipandang sebagai langkah sementara untuk menurunnya perikanan tangkap, ia menghadapi sejumlah tantangan yang mencegahnya mencapai potensi penuhnya (Bartley 2022 ). Salah satu tantangan utama yang dihadapi perusahaan akuakultur adalah tingginya biaya produksi yang dikeluarkan untuk pembelian pakan akuakultur yang menghabiskan hingga 60% dari total biaya produksi. Pakan ikan sebagian besar telah diformulasikan selama ini menggunakan tepung ikan. Ketergantungan yang berlebihan pada tepung ikan telah membuat pasokannya tidak berkelanjutan, karena sebagian besar digunakan dalam produksi pakan untuk berbagai hewan ternak yang dijinakkan (Chepkurui et al. 2011 ).
Tepung ikan lebih disukai untuk formulasi diet bagi hewan ternak karena keunggulannya dalam komposisi nutrisi, sehingga menjadikannya bahan yang paling dicari untuk produksi pakan komersial. Pembuatan pakan hewan komersial berkontribusi terhadap eksploitasi tepung ikan secara berlebihan, sehingga membatasi pasokan yang menciptakan kelangkaan dan akhirnya meningkatkan biaya pakan yang diformulasikan dari tepung ikan (Maranga et al. 2024 ). Oleh karena itu, diversifikasi bahan-bahan yang bersumber dari protein dalam produksi pakan akuakultur akan secara signifikan mengurangi biaya produksi yang dikeluarkan sambil mempertahankan komposisi nutrisi ikan yang dibudidayakan di bawah perusahaan akuakultur. Penggabungan bahan-bahan yang bersumber dari serangga seperti rayap, belalang, lalat tentara hitam, dll., dalam pakan akuakultur telah dipelajari secara ekstensif untuk mencari pengganti alternatif untuk tepung ikan. Namun, hasil dari sejumlah percobaan belum mencapai tingkat penyertaan bahan serangga yang optimal dalam pakan akuakultur yang diperlukan untuk mencapai pertumbuhan dan komposisi nutrisi yang diinginkan pada spesies ikan budidaya (Tilami et al. 2020 ).
Studi terkini telah menunjukkan larva lalat tentara hitam dapat berfungsi sebagai pengganti tepung ikan dalam formulasi pakan ikan (Matteo et al. 2020 ). Namun, uji coba yang melibatkan evaluasi profil asam lemak harus dilakukan, karena kinerja yang berkurang telah dilaporkan dengan penggantian FM secara lengkap dengan BSFL yang sebagian dihilangkan lemaknya pada pertumbuhan spesies ikan yang dibudidayakan (Herve et al. 2025 ; Okpoko et al. 2023 ; Barroso et al. 2017 ). Jenis substrat kultur dan metode pemrosesan memengaruhi komposisi nutrisi BSFL, yang pada akhirnya memengaruhi kualitas diet ikan yang diformulasikan (Lalander et al. 2019 ). Larva lalat tentara hitam adalah bahan pakan bernilai tinggi yang kaya akan protein, mengandung hingga 44% protein dan hingga 25% lemak (Shumo et al. 2019 ; Tran et al. 2015 ). Bahan kering lalat berkisar antara 38–42%, yang membuatnya mudah dan murah untuk dikeringkan dibandingkan dengan bahan-bahan lain yang bersumber dari hewan (Sprangers et al. 2017 ). Komposisi asam lemak larva lalat bergantung pada komposisi asam lemak dari makanan yang dimakannya. Dengan demikian, untuk memperkaya komposisi nutrisi ikan, BSFL yang digunakan dalam formulasi pakan ikan harus dicampur dengan substrat makanan yang kaya akan protein dan asam lemak omega-3 (Maranga et al. 2023 ; Xiao et al. 2018 ; Oguz dan Mahmut 2017 ).
EFA penting dalam kesehatan manusia, meskipun tidak dapat disintesis oleh tubuh manusia dan karenanya harus diperoleh melalui makanan (Omolo et al. 2017 ). Contoh organisme akuatik, bivalvia dan ikan merupakan sumber utama asam lemak tak jenuh ganda (PUFA) yang darinya manusia memperoleh EFA melalui konsumsi organisme tersebut (Prato et al. 2019 ). Berbagai organisme berkontribusi terhadap kebutuhan asam lemak omega-3 dalam makanan manusia, dengan variasi profil asam lemak tergantung pada jenis spesies (Mundida et al. 2023 ). Variasi komposisi asam lemak pada spesies ikan yang berbeda bergantung pada sejumlah faktor, termasuk spesies dan makanan, serta faktor lingkungan seperti oksigen terlarut (DO), suhu, pH dan apakah ikan tersebut dibudidayakan atau liar (Milena et al. 2020 ; Tasbozan dan Gokce 2017 ). Spektrum luas makanan yang diformulasikan menggunakan bahan dan formulasi yang berbeda memengaruhi profil asam lemak ikan budidaya secara berbeda. Selain itu, kemampuan BSFL untuk mengubah berbagai limbah organik untuk menghasilkan larva dengan komposisi nutrisi yang bervariasi (Matteo et al. 2020 ) menimbulkan tantangan bagi ahli gizi dalam merumuskan diet. Analisis asam lemak untuk mengidentifikasi dan mengukur komposisinya dalam ikan menggunakan kromatografi gas (GC) diperlukan (Helena et al. 2014 ), untuk mengatasi berbagai komposisi nutrisi yang ditunjukkan oleh BSFL yang disebabkan oleh kemampuan serangga untuk memproses berbagai limbah organik untuk menghasilkan larva dengan nilai nutrisi yang bervariasi. Dengan demikian, penelitian ini mengevaluasi efek diet yang diformulasikan dengan penggantian sebagian tepung ikan dengan larva lalat tentara hitam pada komposisi asam lemak ikan lele di bawah sistem akuaponik.
2 Bahan dan Metode
2.1 Pernyataan Etika
Para penulis mengonfirmasi bahwa kebijakan etika jurnal sebagaimana dinyatakan pada halaman pedoman penulis telah diikuti. Penelitian ini dilakukan sesuai dengan Universitas Pertanian dan Teknologi Jomo Kenyatta (JKUAT) dan pedoman etika nasional tentang penanganan hewan percobaan, termasuk ikan.
2.2 Lokasi Penelitian, Pengaturan Percobaan dan Pengambilan Sampel
Penelitian ini dilakukan di sebuah peternakan ikan milik pribadi yang terletak di Lembah Rift di Kabupaten Baringo, Kenya, pada 0°39′N, 36°05′E, pada ketinggian 970 m di atas permukaan laut. Eksperimen kinerja dilakukan menggunakan rancangan blok acak lengkap di bawah sistem akuaponik. Pengaturan tersebut terdiri dari 12 tangki pemeliharaan ikan (T1,2 X D1) m yang disusun dalam empat set (perlakuan) dengan tiga tangki (ulangan) masing-masing seperti yang ditunjukkan pada (Gambar 1 ).
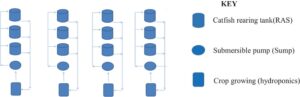
Enam ratus potong benih ikan Clarias gariepinus berumur dua bulan yang sebelumnya diberi pakan komersial dan bersumber dari Lembaga Penelitian Kelautan dan Perikanan Kenya (KMFRI), tempat penetasan ikan Sagana. Komposisi proksimat pakan percobaan dan komposisi asam lemak dari otot ikan, hati, dan ikan utuh dianalisis di laboratorium ilmu pangan JKUAT.
2.3 Formulasi Diet dan Analisis Proksimat Diet
Tiga diet uji berbeda dengan kandungan protein kasar (CP) 35% diformulasikan menggunakan metode Pearson Square dengan bahan-bahan berikut: dedak gandum (17,1%), bungkil biji kapas (38,1%), bungkil biji bunga matahari (26,83%), lalat tentara hitam (BSF) (25,3%) dan tepung ikan (53,3%). Dedak gandum, bungkil biji kapas dan bungkil biji bunga matahari bersumber dari tempat penjualan bahan baku pakan ternak di kota Nakuru. BSFL yang sebagian dihilangkan lemaknya yang dikultur menggunakan substrat limbah dapur bersumber dari Pusat Internasional Fisiologi dan Ekologi Serangga (ICIPE) di kota Nairobi, sedangkan tepung ikan diperoleh dari Teluk Kendu di Kabupaten Homa Bay. Setelah itu, bahan-bahan tersebut dijemur, digiling dan dicampur pada rasio yang diperlukan untuk tiga diet uji berbeda yang digunakan untuk percobaan.
Tepung ikan yang disubstitusi BSFL pada rasio (50-50, 25–75 dan 75-25)% untuk pakan (1, 2 dan 3) secara berurutan, seperti yang ditunjukkan pada (Tabel 1 ). Dengan menggunakan air, pakan yang diformulasikan dibuat menjadi adonan dan kemudian dipeletkan menggunakan mesin pelet improvisasi (penggiling daging) pada dadu berukuran 2 mm, kemudian dijemur dengan benar sebelum dikemas dan disimpan pada suhu ruangan dalam wadah plastik 10 kg. Pakan yang diformulasikan dengan BSFL diuji terhadap pakan komersial yang bersumber dari Perusahaan Unga Farm Care di Kota Nakuru yang memiliki 0% inklusi BSFL.
| Diet eksperimental | |||||
|---|---|---|---|---|---|
| Parameter | Satuan | Pola Makan 1 | Pola Makan 2 | Pola Makan 3 | Pola Makan 4 |
| Analisis protein | |||||
| Protein kasar | (gram 100 gram -1 ) | 35.0 | 35.0 | 35.0 | 35.0 |
| Bahan-bahan | |||||
| Bahasa Inggris: BSFL | (gram 100 gram -1 ) | 13.75 | 6.875 | 20.625 | angka 0 |
| FM | (gram 100 gram -1 ) | 13.75 | 20.625 | 6.875 | 24.8 |
| Kue biji kapas | (gram 100 gram -1 ) | 16.27 | 16.27 | 16.27 | 16.80 |
| Kue biji bunga matahari | (gram 100 gram -1 ) | 25.495 | 25.495 | 25.495 | Tanggal 26.20 |
| Dedak gandum | (gram 100 gram -1 ) | 30.735 | 30.735 | 30.735 | 32.20 |
| Asam amino esensial | |||||
| Metionina | (gram 100 gram -1 ) | 0.5 | 0.5 | 0.5 | 0.5 |
| Lisin | (gram 100 gram -1 ) | 0.2 | 0.2 | 0.2 | 0.2 |
| Kolin | (gram 100 gram -1 ) | 0.4 | 0.4 | 0.4 | 0.4 |
Singkatan: BSFL , Larva lalat tentara hitam; FM, Tepung ikan.
Analisis proksimat dilakukan pada sampel rangkap tiga untuk semua diet uji yang diformulasikan yang digunakan untuk formulasi pakan ikan (Tabel 2 ). Protein diukur dengan metode Kjeldahl sebagai berikut: 100 mg sampel ditimbang menggunakan mesin timbang WTC 2000 dan kemudian 3 mL asam sulfat pekat ditambahkan. Campuran direbus pada sekitar 180 ° C selama 2 jam dengan asam mengembun di tengah leher labu Kjeldahl. Campuran didinginkan, dan setelah itu labu ditempatkan ke dalam peralatan distilasi. 12 mL air suling ditambahkan perlahan ke dalam campuran. Campuran dipanaskan pada 100 ° C untuk membebaskan amonia, yang disuling dengan uap selama sekitar 10 menit melalui kondensor, dengan ujungnya terendam dalam labu. Setelah distilasi selesai, 25 mL campuran dititrasi, dan kandungan protein dihitung dengan menggunakan faktor Kjeldahl F; mg protein = mg N · F dan kandungan protein “c” dari sampel; c [%] = (mg protein) · 100 / berat sampel [mg] 1,0 mL 0,010 N HCl = 10 µMol N = 0,14 mg N
| Rata-rata Rata-rata ± SD | |||||
|---|---|---|---|---|---|
| Parameter | Satuan | Pola Makan 1 | Pola Makan 2 | Pola Makan 3 | Pola Makan 4 |
| Bahan kering | (gram 100 gram -1 ) | 91,41±0,81 satu | 91,56±0,35 satu | 91,57±0,09 satuan | 91,55±0,63 detik |
| Protein kasar | (gram 100 gram -1 ) | 35,38±0,07 satu | 35,28±0,10 per menit | 35,30±0,02 satu | 35,41±0,19 satuan |
| Ekstrak eter | (gram 100 gram -1 ) | 9,09±0,14 miliar | 10,28±0,10 detik | 11,47±0,93 hari | 7,25±0,32 satuan |
| Abu | (gram 100 gram -1 ) | 10,64± 0,05b | 10,05± 0,06b | 6,65±0,08 satuan | 10,31± 0,06b |
| Serat kasar | (gram 100 gram -1 ) | 5,35±0,39 satuan | 6,20±0,52 b | 6,54± 0,18b | 6,75± 0,25b |
| Kelembaban | (gram 100 gram -1 ) | 8,56±0,86 inci | 8,42±0,35 satuan | 8,57±0,02 inci | 8,45±0,07 satu |
| Pendidikan Nonformal | (gram 100 gram -1 ) | 36,27± 0,26b | 35,95±0,52 satuan | 38,00± 0,04c | 39,56±0,50 hari |
Catatan : Nilai-nilai mewakili mean ± SD, uji Tukey-Kramer, P < 0,05, n = 3: Huruf alfabet (superskrip) menunjukkan perbedaan yang signifikan di mana a>b>c>d. Singkatan: SD, Simpangan baku; NFE , Ekstrak bebas nitrogen.
Lipid kasar diukur sebagai penambahan berat labu beralas bulat setelah ekstraksi sampel dalam petroleum eter (40-60°C). Abu ditentukan dengan membakar sampel kering dalam tungku peredam pada suhu 550°C selama 4 jam, sedangkan serat kasar diukur dengan pencernaan alkali/asam yang diikuti dengan pengabuan residu kering pada suhu 550°C dalam tungku peredam selama 4 jam. Ekstrak bebas nitrogen (NFE) ditentukan dengan metode perbedaan (DM–CP–EE–CF–Ash). Diet yang diformulasikan diuji terhadap diet komersial (Unga Farm Care Limited) sebesar 35% CP, yang digunakan sebagai diet kontrol untuk percobaan.
2.4 Analisis Penebaran, Pemberian Pakan dan Kualitas Air Fisik
Lima puluh benih ikan lele dengan berat masing-masing 5±0,5 g ditebar di semua 12 tangki pemeliharaan ikan, yang masing-masing berisi 1000 liter air. Dalam penebaran ini, 1 ikan lele akan menempati 20 liter air. Pakan dialokasikan secara acak ke empat set tangki pertama dan diulang tiga kali yang diberi makan dua kali sehari kecuali pada hari pengambilan sampel di mana ikan tidak diberi makan. Pemberian pakan dilakukan dengan menggunakan masing-masing pakan yang diformulasikan selama empat bulan. Parameter fisik air terpilih, termasuk oksigen terlarut (DO), suhu dan pH, ditentukan menggunakan multiparameter analyzer (YSI) setiap minggu pada pukul 07:00.
2.5 Prosedur Ekstraksi Sampel Ikan (Seluruh Tubuh, Otot dan Hati)
Ember berkapasitas 20 liter diisi setengahnya dengan 10 liter air, di mana ikan ditempatkan setelah dikeluarkan dari tangki pemeliharaan ikan. Jaring lingkup dengan ukuran mata jaring 0,5 mm dan panjang 2 M digunakan untuk mengkaji tiga ikan dari masing-masing dari dua belas tangki pemeliharaan ikan dan ditempatkan dalam ember per perlakuan diet. Ikan yang diperoleh dibius menggunakan 5 mL minyak cengkeh yang dilarutkan dalam 2 liter air yang ditempatkan dalam wadah plastik berkapasitas 5 liter sampai ikan menjadi tidak sadar. Setelah itu, ikan tersebut dinonaktifkan dengan memotong sumsum tulang belakang tepat di belakang kepala dengan pisau dan kemudian dibedah menggunakan gunting untuk memeriksa hati di perut ikan.
2.6 Ekstraksi Total Lipid dalam Asam Lemak dan Analisis GC
Hati basah dan jaringan otot diekstraksi dari semua ikan yang diperoleh dari tangki percobaan per perlakuan diet. Jaringan basah dan ikan utuh diawetkan dalam 70% metanol dan dibawa ke laboratorium, di mana mereka dihomogenisasi dengan campuran 10 mL kloroform dan metanol dan kemudian disentrifugasi untuk memungkinkan pengenceran air dari jaringan dengan kloroform. Pengenceran memungkinkan homogenat terpisah menjadi dua lapisan, dengan kloroform mengandung semua lipid sedangkan lapisan metanol mengandung semua non-lipid. Lapisan lipid murni diperoleh dengan mengisolasi lapisan kloroform dari lapisan metanol. 100 mg lipid murni diperoleh dengan menggunakan mikro-syringe dan ditambahkan ke dalam tabung Falcon 15 mL. Kemudian, 3 mL kalium hidroksida 0,6% dalam metanol ditambahkan dan diaduk selama 10 detik. Larutan dipanaskan pada 70 derajat Celsius dan disentrifugasi pada 4000 rpm selama 10 menit saat fase organik dipindahkan ke vial 2 mL yang diencerkan dengan 4 mL heksana dan dicuci dengan 3 mL air suling. Lapisan heksana dikeringkan dalam rotary evaporator vakum, dan residu dilarutkan kembali dalam setetes kecil heksana. Kemudian 0,2 mikroliter disuntikkan ke dalam kromatografi gas (Chimadzu GC-9A) dengan kolom kapiler pada suhu injeksi 240°C dan suhu deteksi 260°C di bawah detektor ionisasi nyala. Laju programmer untuk dekoder dan GC ditetapkan pada 5 menit -1 dengan redaman 3. Semua sampel untuk analisis GC dilakukan dalam kondisi yang sama. Identifikasi metil ester asam lemak dilakukan dengan membandingkan waktu retensi dengan standar FAME dan dinyatakan sebagai persentase total metil ester.
2.7 Analisis Statistik
Data dianalisis secara statistik menggunakan SPSS versi 23 untuk Windows. Kenormalan distribusi data dilakukan menggunakan uji Turkey-Kramer. Rata-rata dan standar error asam lemak dalam makanan dan komposisi asam lemak sampel jaringan ikan dibandingkan menggunakan Analisis Varians (ANOVA). Variasi statistik untuk uji inferensi dilakukan menggunakan uji perbandingan berganda Tukey-HSD pada tingkat signifikansi (p < 0,05). Hasilnya disajikan dalam bentuk tabel dengan tabel yang diplot menggunakan spreadsheet Microsoft Excel Windows 2010. 3 Hasil 3.1 Parameter Kualitas Air Fisik Nilai yang diperoleh untuk parameter air yang dianalisis berada dalam kisaran yang dapat diterima untuk budidaya ikan lele; dengan demikian, kualitas air tidak memiliki efek apa pun pada komposisi asam lemak pada ikan percobaan. Nilai rata-rata untuk DO di antara empat perlakuan diet berkisar antara (3,03 ± 0,9 dan 3,96 ± 0,46) mgL −1 , nilai rata-rata untuk suhu berkisar antara (24,53 ± 1,1 dan 26,52 ± 1,65) °C sementara nilai pH rata-rata di antara perlakuan berkisar antara (7,69 ± 0,54 dan 7,72 ± 0,52). Parameter yang dianalisis tidak menunjukkan perbedaan yang signifikan (P > 0,05) di antara perlakuan diet. Nilai p yang diperoleh untuk parameter kualitas air fisik yang dianalisis adalah DO (0,100), suhu (0,350), sedangkan pH adalah 0,977.
3.2 Analisis Asam Lemak pada Makanan Eksperimental
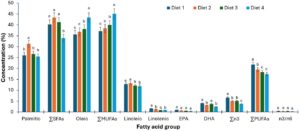
Jumlah asam lemak jenuh yang dianalisis bervariasi secara signifikan (p < 0,05) di antara diet yang digunakan untuk penelitian saat ini, seperti yang ditunjukkan pada Gambar 2. Nilai jumlah asam lemak jenuh tertinggi diperoleh oleh diet 3, yang mengandung persentase BSFL yang lebih tinggi (75%) yang digunakan dalam formulasi. Diet 1, yang memiliki 50% BSFL, berada di urutan kedua dalam jumlah asam lemak jenuh, sedangkan diet 2, dengan 25% BSFL, berada di urutan ketiga. Diet 4, yang merupakan diet kontrol dan komersial, mengandung nilai jumlah asam lemak jenuh terkecil yang terkandung dalam diet. Asam jenuh individual bervariasi secara signifikan (p < 0,05) di antara perlakuan diet. Semua asam lemak jenuh yang diekstraksi hadir dalam semua diet kecuali asam miristat, C 14:0, yang tidak ada dalam diet 2 dan diet kontrol 4 (diet komersial). Asam palmitat, C 16:0, merupakan asam jenuh dominan di antara diet uji yang diformulasikan, sementara asam behenat, C 21:0, mendominasi dalam diet komersial.
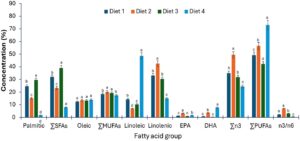
Asam oleat, C 18:1, asam lemak tak jenuh tunggal yang dominan, tidak menunjukkan variasi statistik (p > 0,05), sementara palmitoleat dan nervonat menunjukkan valuasi statistik (p < 0,05) di antara perlakuan diet. Ada variasi statistik (p < 0,05) dalam penjumlahan asam lemak tak jenuh tunggal di antara diet. Diet 2 (25% BSFL) mendominasi dalam penjumlahan asam lemak tak jenuh tunggal, kemudian diikuti oleh diet 3 (75% BSFL), kemudian diet 1 (50% BSFL), sementara diet kontrol 4 (komersial) memiliki nilai terkecil 17,38±0,18 dalam penjumlahan asam lemak tak jenuh tunggal untuk penelitian ini. Ada variasi statistik yang tinggi (p < 0,05) dalam penjumlahan PUFA untuk diet eksperimental (Gambar 2 ). Diet kontrol 4 (komersial) mendominasi dalam penjumlahan PUFA dengan (73,05±1,23) diikuti oleh diet 2 (25% BSFL) (56,47±0,27), kemudian diet 1 (50% BSFL) (49,17±0,26) dan terakhir diet 3 (25% BSFL) (42,05±0,12). Terdapat variasi statistik (p < 0,05) di antara semua PUFA untuk perlakuan diet dalam penelitian ini. Asam linoleat (C 18:2), merupakan PUFA yang dominan, sedangkan linolenat dominan di antara asam lemak omega-3 dalam penelitian ini.
3.3 Pengaruh Diet Eksperimental terhadap Profil Asam Lemak Seluruh Tubuh C. gariepinus
Jumlah asam lemak jenuh yang dianalisis untuk seluruh tubuh bervariasi secara signifikan (p < 0,05) di antara perlakuan diet, seperti yang ditunjukkan pada Gambar 3. Nilai jumlah tertinggi asam lemak untuk seluruh tubuh diperoleh oleh ikan yang diberi diet kontrol 4 (komersial), sedangkan jumlah terkecil diperoleh oleh ikan yang diberi diet 1. Seluruh tubuh ikan yang diberi diet 2 berada di urutan kedua dalam jumlah asam lemak jenuh yang ada, sedangkan seluruh tubuh ikan yang diberi diet 3 berada di urutan ketiga. Sebagian besar asam jenuh individual untuk seluruh tubuh bervariasi secara signifikan (p < 0,05) di antara perlakuan diet kecuali asam kaprat (C 10:0), asam pentadekanoat (C 15:0) dan behenat C 21:0 yang tidak menunjukkan variasi statistik (p > 0,05). Asam palmitat, C 16:0, adalah asam jenuh dominan yang diperoleh untuk seluruh tubuh di antara perlakuan diet, sementara asam heptadekanoat, C 17:0, mendominasi dalam diet komersial.
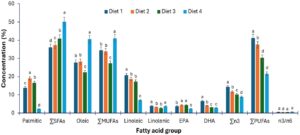
Ada variasi statistik (p < 0,05) dalam semua asam lemak tak jenuh tunggal untuk seluruh tubuh di antara perlakuan diet yang berbeda, dengan asam oleat, C 18:1, menjadi asam lemak tak jenuh tunggal yang dominan (Gambar 3 di atas). Ada variasi statistik (p < 0,05) dalam penjumlahan asam lemak tak jenuh tunggal untuk seluruh tubuh di antara perlakuan diet. Seluruh tubuh ikan yang diberi diet kontrol 4 (komersial) memperoleh nilai tertinggi dalam penjumlahan asam lemak tak jenuh tunggal, diikuti oleh seluruh tubuh ikan yang diberi diet 1, kemudian seluruh tubuh ikan yang diberi diet 2 sementara seluruh tubuh ikan yang diberi diet 3 adalah yang terakhir. Ada variasi statistik (p < 0,05) dalam penjumlahan PUFA untuk seluruh tubuh untuk penelitian saat ini. Seluruh tubuh ikan yang diberi diet 1 mendominasi dalam penjumlahan PUFA dengan (41,25±1,61), diikuti oleh diet 2 (37,54±0,94), kemudian diet 3 (30,42±0,49), dan terakhir diet 4 (komersial) (21,56±0,44). Variasi statistik (p < 0,05) diamati untuk seluruh tubuh di semua PUFA dalam penelitian ini. Asam linoleat C 18:2, merupakan PUFA yang dominan. Variasi statistik (p < 0,05) dalam penjumlahan asam lemak omega-3 untuk seluruh tubuh diamati dengan ikan yang diberi diet 1 mendominasi dengan (14,39±0,40).
3.4 Pengaruh Diet Eksperimental terhadap Profil Asam Lemak Hati C. gariepinus
Jumlah asam lemak jenuh yang dianalisis untuk hati bervariasi secara signifikan (p < 0,05) di antara perlakuan diet, seperti yang ditunjukkan dalam (Gambar 4 ). Nilai jumlah asam lemak tertinggi untuk hati diperoleh oleh ikan yang diberi diet 1, sedangkan jumlah terkecil diperoleh oleh ikan yang diberi diet kontrol 4 (komersial). Hati ikan yang diberi diet 3 berada di urutan kedua dalam jumlah asam lemak jenuh yang ada, sedangkan hati ikan yang diberi diet 2 berada di urutan ketiga. Sebagian besar asam jenuh individual untuk hati bervariasi secara signifikan (p < 0,05) di antara perlakuan diet kecuali asam palmitat C 16:0, dan stearat C 18:0 yang tidak bervariasi secara statistik (p > 0,05). Asam palmitat, C 16:0, adalah asam jenuh dominan yang diperoleh untuk hati diikuti oleh asam arakidik, C 20:0 di antara perlakuan diet, sementara asam lignoserat C 24:0, paling tidak didominasi di antara asam jenuh yang dianalisis untuk hati.
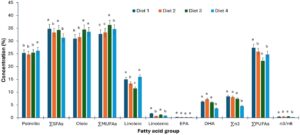
Ada variasi statistik (p < 0,05) dalam semua asam lemak tak jenuh tunggal untuk hati antara perlakuan diet dengan asam oleat, C 18:1, yang merupakan asam lemak tak jenuh tunggal yang dominan (Gambar 4 ). Ada variasi statistik (p < 0,05) dalam penjumlahan asam lemak tak jenuh tunggal untuk hati antara perlakuan diet. Hati ikan yang diberi diet 3 memperoleh nilai tertinggi dalam penjumlahan asam lemak tak jenuh tunggal, diikuti oleh hati ikan yang diberi diet kontrol 4 (komersial), kemudian hati ikan yang diberi diet 1, sedangkan hati ikan yang diberi diet 2 memiliki nilai penjumlahan tak jenuh tunggal paling rendah. Ada variasi statistik (p < 0,05) dalam penjumlahan PUFA untuk hati dalam penelitian saat ini. Hati ikan yang diberi diet 1 mendominasi dalam penjumlahan PUFA dengan (27,38±0,19), diikuti oleh diet 2 (25,85±0,28), kemudian diet kontrol 4 (24,8±0,49), dan terakhir diet 3 (22,25±0,31). Ada variasi statistik (p < 0,05) yang diamati untuk hati dalam PUFA yang diperoleh untuk penelitian saat ini. Asam linoleat C 18:2, yang merupakan perwakilan dari asam lemak omega-6 adalah yang dominan di antara PUFA dalam sampel hati. Asam docosahexaenoic mendominasi asam lemak omega-3 untuk sampel hati yang dianalisis untuk penelitian saat ini. Variasi statistik (p < 0,05) diamati dalam sampel hati untuk penjumlahan asam lemak omega-3.
3.5 Pengaruh Diet Eksperimental terhadap Profil Asam Lemak Otot C. gariepinus
Komposisi asam lemak dalam otot ikan percobaan disajikan dalam Gambar 5. Jumlah total asam lemak jenuh yang dianalisis untuk otot ikan bervariasi secara statistik (p < 0,05) di antara perlakuan diet. Nilai jumlah tertinggi asam lemak untuk otot diperoleh oleh ikan yang diberi diet 2, sedangkan jumlah terkecil diperoleh oleh ikan yang diberi diet kontrol 4 (komersial). Otot ikan yang diberi diet 3 berada di urutan kedua dalam jumlah total asam lemak jenuh yang ada, sedangkan otot ikan yang diberi diet 1 berada di urutan ketiga. Kecuali untuk asam pentadekanoat C 15:0, asam stearat C 18:0, asam behenat C 21:0 dan asam lignoserat yang tidak menunjukkan variasi statistik (p > 0,05), sisa asam jenuh yang dianalisis dari otot bervariasi secara statistik (p < 0,05). Asam palmitat, C 16:0, merupakan asam lemak jenuh dominan yang diperoleh dari jaringan otot, sama seperti semua sampel lain yang dianalisis komposisi asam lemaknya untuk penelitian ini.
Untuk enam asam lemak tak jenuh tunggal yang diperoleh dari jaringan otot, hanya tiga yang bervariasi secara statistik (p < 0,05), sementara tiga tidak, dengan asam oleat, C 18:1, menjadi asam lemak tak jenuh tunggal dominan yang dianalisis. Jumlah total asam lemak tak jenuh tunggal menunjukkan variasi statistik (p < 0,05) untuk jaringan otot antara perlakuan diet. Jaringan otot ikan yang diberi diet kontrol 4 (komersial) memperoleh jumlah total asam lemak tak jenuh tunggal tertinggi, diikuti oleh jaringan otot ikan yang diberi diet 3, kemudian jaringan otot ikan yang diberi diet 2; nilai total terkecil diperoleh oleh ikan yang diberi diet 1.
Jumlah total PUFA untuk jaringan otot dalam penelitian ini menunjukkan variasi statistik (p < 0,05). Jaringan otot ikan yang diberi diet 1 mendominasi dalam jumlah PUFA (21,77±0,26), diikuti oleh diet 2 (19,49±0,42), kemudian diet 3 (18,31±0,09), dan terakhir diet kontrol 4 (17,4±0,26). Kecuali untuk asam linoleat C 18:2 yang dominan, di antara PUFA, PUFA lainnya menunjukkan variasi statistik (p < 0,05) untuk sampel jaringan otot yang dianalisis. Asam docosahexaenoic mendominasi asam lemak omega-3 untuk sampel otot. Variasi statistik yang tinggi (p < 0,05) diamati dalam sampel otot untuk asam lemak omega-3 yang meliputi asam linolenat, C 18:3, asam eikosapentaenoat, C 20:5 dan asam dokosaheksaenoat, C 22:6.
4 Diskusi
BSFL telah terbukti memiliki potensi mengubah substrat limbah organik menjadi protein larva berkualitas tinggi yang cocok untuk formulasi pakan ikan (Huis et al. 2013 ). Namun, kemampuan serangga untuk mengubah berbagai limbah organik untuk menghasilkan larva dengan komposisi nutrisi yang bervariasi (Matteo et al. 2020 ) menimbulkan tantangan bagi ahli gizi dalam memformulasikan diet. Tingkat persentase penyertaan bahan yang bervariasi memengaruhi komposisi nutrisi dari diet yang diformulasikan (Weiss dan St-Pierre 2009 ), sehingga diperlukan analisis diet untuk memastikan kebutuhan nutrisi ikan terpenuhi. Komposisi asam lemak dari diet eksperimental menunjukkan variasi statistik di antara perlakuan diet meskipun diet memiliki nilai kandungan protein kasar yang seragam sebesar 35%. Dengan demikian, pengamatan yang dilakukan untuk kandungan protein kasar dan komposisi asam lemak dikaitkan dengan tingkat penyertaan bahan saat mengganti tepung ikan dengan BSFL dalam diet. Studi oleh Lin et al. ( 2016 ) dan Omolo et al. ( 2017 ), menggunakan berbagai persentase minyak biji rami untuk menggantikan minyak ikan dan (Chepkurui et al. 2021 ), menggunakan berbagai persentase bayam air dalam makanan; dengan kandungan protein kasar yang sama melaporkan variasi statistik dalam komposisi asam lemak makanan, yang memengaruhi komposisi asam lemak dalam jaringan ikan. Pencantuman BSFL pada berbagai tingkat dalam makanan berkontribusi terhadap variasi komposisi asam lemak dalam makanan dan jaringan. Studi oleh Zhou et al. ( 2017 ) melaporkan bahwa asam lemak jenuh dalam ikan mas meningkat sementara konsentrasi asam lemak tak jenuh menurun dengan meningkatnya penggantian BSFL. Dalam studi saat ini, konsentrasi asam jenuh tertinggi diamati untuk pencantuman BSFL 75%, sementara konsentrasi terendah diperoleh untuk pencantuman BSFL 25%.
Asam palmitat C 16:0 adalah asam lemak jenuh yang paling dominan dalam kedua diet yang diformulasikan dan jaringan ikan dalam penelitian ini. Asam palmitat dapat disuplemen atau disintesis secara endogen melalui de novo lipogenesis (DNL) dalam diet (Carta et al. 2017 ), sehingga menjelaskan variasi yang diamati antara diet dan jaringan untuk asam dalam penelitian ini. Retensi asam palmitat yang lebih tinggi diamati pada otot dan hati dikaitkan dengan pembangkitan energi melalui proses oksidasi (Lim et al. 2013 ) karena kedua jaringan tersebut diketahui menyimpan energi dan memfasilitasi fungsi metabolisme dalam tubuh. Selama proses β-oksidasi, asam palmitat menjalani serangkaian langkah berurutan dalam mitokondria untuk menghasilkan energi yang dapat digunakan yang dikeluarkan oleh organisme untuk melakukan berbagai fungsi fisiologis. Ketika berlebihan, asam lemak jenuh dapat menyebabkan kondisi fisio-patologis yang dihasilkan dari ketidakseimbangan antara asam lemak jenuh dan tak jenuh. Dalam penelitian ini, asam lemak tak jenuh lebih terkonsentrasi daripada asam lemak jenuh dalam makanan dan jaringan sehingga menciptakan keseimbangan yang diperlukan untuk mencegah masalah kesehatan negatif yang terkait dengan asam lemak jenuh berlebih. Konsentrasi asam tak jenuh tunggal dan tak jenuh ganda dalam jaringan menurun dengan meningkatnya konsentrasi asam jenuh sesuai dengan hasil yang dilaporkan oleh St-Hilaire et al. ( 2007 ) pada ikan trout pelangi yang diberi makanan yang mengandung BSFL dan larva lalat rumah. Dalam asam lemak tak jenuh tunggal, asam oleat mendominasi dalam makanan percobaan dan jaringan ikan. Konsentrasi asam oleat dalam jaringan lebih tinggi daripada dalam makanan, sejajar dengan hasil yang dilaporkan oleh Omolo et al. ( 2017 ) dan Mwanja et al. ( 2010 ). Asam oleat merupakan turunan dari proses desaturasi oksidatif asam stearat pada hewan sehingga menjelaskan korelasi antara asam stearat jaringan dan komposisi asam oleat dalam penelitian ini. Konsentrasi asam oleat tinggi yang diamati dalam jaringan ikan dalam penelitian ini mungkin disebabkan oleh peningkatan kadar asam lemak dalam makanan. Sebuah penelitian oleh Nina et al. ( 2020 ) melaporkan bahwa diet mempengaruhi komposisi asam lemak dalam jaringan ikan.
Dalam penelitian ini, konsentrasi PUFA yang diperoleh dari jaringan ikan meningkat seiring dengan penurunan kadar BSFL dalam makanan, yang sesuai dengan penelitian pada ikan mas Jian (Zhou et al., 2017 ) dan pada ikan trout pelangi (St-Hilaire et al. 2007 ). Sebaliknya, penelitian oleh Lin et al. ( 2016 ) melaporkan peningkatan PUFA yang signifikan seiring dengan peningkatan penyertaan minyak biji rami dalam jaringan ikan. Konsentrasi umum asam lemak omega-3 lebih rendah di semua jaringan dibandingkan dengan konsentrasi asam lemak omega-3 dalam makanan. Namun, retensi dan deposisi asam dokosaheksaenoat C 22:6 dalam jaringan ikan lebih tinggi daripada makanan. Dengan demikian, tren yang diamati untuk retensi asam dokosaheksaenoat untuk penelitian ini sesuai dengan laporan oleh Babalola et al. ( 2011 ) pada ikan lele Afrika yang memiliki retensi asam dokosaheksaenoat yang lebih tinggi dalam jaringan ikan dibandingkan dengan makanan. Retensi asam docosahexaenoic yang lebih tinggi dikaitkan dengan spesifisitas tinggi asiltransferase untuk asam docosahexaenoic dan resistensi relatif asam docosahexaenoic terhadap beta-oksidasi karena jalur metaboliknya yang kompleks (Mustapha et al. 2014 ). Penelitian telah menunjukkan spesies ikan budidaya seperti ikan lele dan nila mampu melakukan desaturasi dan pemanjangan asam lemak linoleat dan linolenat prekursor yang lebih pendek menjadi omega 6 dan 3 LC-PUFA yang lebih panjang secara endogen melalui lipogenesis de novo (Li et al. 2019 ). Kadar konsentrasi PUFA total lebih tinggi di jaringan hati dibandingkan dengan seluruh jaringan tubuh dan otot karena peran hati dalam metabolisme lemak, struktur membran sel, dan fungsi hati lainnya. Perbedaan yang diamati dalam kadar konsentrasi asam lemak antara hati dan jaringan ikan lele lain yang dianalisis juga dikaitkan dengan kemampuan hati yang memiliki kapasitas penyimpanan lipid yang tinggi dibandingkan dengan otot dan seluruh jaringan tubuh (Gorgun dan Akpmar 2019 ).
Dalam penelitian saat ini, jumlah EPA yang diperoleh lebih sedikit daripada DHA dalam tiga jaringan ikan yang dianalisis. Nilai EPA rendah yang diamati dalam jaringan disebabkan oleh kemampuan EPA untuk dioksidasi secara tinggi dibandingkan dengan DHA, yang memerlukan proses katabolisme yang kompleks (Omolo et al. 2017 ). Selain itu, EPA merupakan zat antara dalam jalur biosintesis DHA yang mempertahankan LC-PUFA dalam jaringan (Chepkurui et al. 2021 ) sehingga menjelaskan perbedaan tingkat konsentrasi antara EPA dan DHA dalam jaringan ikan. Nilai n3 yang diperoleh untuk diet dalam penelitian saat ini lebih tinggi dibandingkan dengan nilai n6 dan menunjukkan variasi statistik (p < 0,05) antara perlakuan diet. Sebaliknya, nilai n3 untuk jaringan ikan lebih rendah dibandingkan dengan nilai n6 dan tidak menunjukkan variasi statistik. Ketimpangan yang diamati untuk rasio n3/n6 untuk diet disebabkan oleh tidak tersedianya asam lemak arakidonat, salah satu dari dua asam lemak omega-6 paling umum yang dibutuhkan dalam diet ikan. Asam lemak arakidonat diperoleh dalam jumlah yang cukup dalam bahan-bahan berbasis tanaman yang tersedia sebagai minyak sayur, termasuk jagung, kedelai, biji rami, dll., (Prato et al. 2019 ; Lin et al. 2016 ). Rasio n3/n6 tertinggi diperoleh oleh diet 2, yang memiliki rasio penggantian (25:75) %; (BSFL: FM), sehingga menunjukkan keunggulan FM dalam asam lemak n3 dibandingkan dengan BSFL. Oleh karena itu, penting untuk melengkapi diet yang kekurangan atau memiliki asam arakidonat yang tidak mencukupi dengan minyak sayur (Fountoulaki et al. 2009 ) untuk menghindari ketimpangan dalam rasio n3/n6 yang diamati untuk diet yang digunakan dalam penelitian ini. Nilai yang diperoleh untuk rasio n3/n6 pada jaringan ikan tidak menunjukkan perbedaan yang diamati pada diet eksperimental. Konsistensi rasio n3/n6 pada jaringan ikan disebabkan oleh kemampuan ikan untuk mengubah asam linoleat yang diperoleh dari diet menjadi asam arakidonat dalam tubuh ikan, sehingga menciptakan keseimbangan antara kadar asam lemak n3 dan n6 dalam tubuh ikan.
5 Kesimpulan
Penggantian FM oleh BSFL dalam diet ikan lele dengan berbagai tingkat inklusi memengaruhi kadar komposisi asam lemak dalam diet eksperimental. Dengan demikian, diet eksperimental juga memengaruhi kadar komposisi asam lemak dalam jaringan ikan lele yang dianalisis dalam penelitian ini. Jaringan yang diperoleh dari ikan lele yang diberi diet dengan rasio penggantian BSFL 50% memiliki konsentrasi PUFA tertinggi dibandingkan dengan jaringan yang diberi diet dengan rasio penggantian BSFL 25% dan 75%. Oleh karena itu, penelitian ini merekomendasikan penggunaan rasio penggantian BSFL terhadap FM (50:50) dalam memformulasi diet ikan lele saat menggunakan BSFL yang dihilangkan lemaknya sebagian.



