Abstrak
- Metamorfosis, proses perkembangan yang umum dan spektakuler, melibatkan perubahan fenotipe besar yang sering dikaitkan dengan transisi lingkungan. Memahami bagaimana perubahan ini memengaruhi evolusi morfologi sangat penting untuk meneliti dampak evolusi metamorfosis.
- Dalam penelitian ini, kami menganalisis peran metamorfosis dan variasi siklus hidup pada evolusi morfologi mandibula di Caudata (salamander dan kadal air), klade yang menunjukkan keragaman besar siklus hidup dan ekologi. Kami berfokus pada mandibula, komponen utama dari alat pengunyahan, untuk menyelidiki bagaimana variasi siklus hidup dapat memengaruhi diversifikasi cara makan.
- Dengan menggunakan morfometrik geometri 3D pada 317 spesies Caudata yang masih ada, kami menemukan bahwa siklus hidup dan ukuran memengaruhi bentuk mandibula, dengan interaksi kompleks antara faktor-faktor ini. Morfologi tulang mandibula berevolusi lebih independen pada spesies yang mengalami metamorfosis lengkap dibandingkan dengan yang mengalami metamorfosis parsial, yang kemungkinan memfasilitasi diversifikasi makanan pada orang dewasa terestrial. Di sisi lain, integrasi morfologi yang tinggi pada spesies yang mengalami metamorfosis parsial dapat mendorong evolusi sifat yang cepat, yang menghasilkan diferensiasi morfologi yang lebih berbeda, yang berpotensi membantu spesies paedomorfik dalam beradaptasi dengan lingkungan yang menantang.
- Studi ini menyoroti interaksi antara metamorfosis dan lingkungan dalam membentuk evolusi morfologi di antara spesies dan memberikan wawasan baru tentang peran heterokroni dalam diversifikasi morfologi organisme.
Baca Ringkasan Bahasa Sederhana gratis untuk artikel ini di blog Jurnal.
1. PENDAHULUAN
Metamorfosis adalah salah satu proses perkembangan paling spektakuler dalam kingdom hewan (Laudet, 2011 ; Rainford et al., 2014 ; Rolff et al., 2019 ). Fenomena ini sering dikaitkan dengan perubahan drastis dalam morfologi, fisiologi, pola makan, dan penggunaan habitat (Laudet, 2011 ; Rolff et al., 2019 ). Perubahan yang terjadi selama metamorfosis dianggap memfasilitasi dinamika evolusi yang berbeda antara spesies dan kolonisasi habitat baru (Bonner, 1965 ; Werner, 1988 ). Meskipun siklus hidup yang kompleks ada di mana-mana pada metazoa, hanya sedikit penelitian yang menyelidiki interaksi antara metamorfosis, keanekaragaman morfologi, dan transisi habitat pada tingkat interspesifik (Bonett & Blair, 2017 ; Fabre et al., 2020 ; Goedert & Calsbeek, 2019 ; Rainford et al., 2014 ; Sherratt et al., 2017 ).
Di antara vertebrata yang mengalami metamorfosis, Caudata (salamander dan kadal air) menonjol karena menjadi kelompok amfibi yang beragam dengan keragaman siklus hidup yang luar biasa. Mereka menunjukkan berbagai tingkat kelengkapan metamorfosis dan transisi ekologis. Hal ini menjadikan Caudata model yang sangat baik untuk mempelajari dampak proses perkembangan dan heterokronik (yaitu perubahan dalam waktu, laju atau durasi perkembangan) pada evolusi fenotipik (Bonett et al., 2022 ; Wake & Koo, 2018 ). Siklus hidup ini dapat diklasifikasikan menjadi metamorfosis lengkap, yang mencakup gaya hidup bifasik, perkembangan langsung dan viviparitas, dan metamorfosis parsial atau diferensial, seperti yang terlihat pada spesies paedomorfik. Siklus hidup bifasik melibatkan metamorfosis lengkap dari tahap larva akuatik ke tahap dewasa yang mungkin akuatik, terestrial atau hidup di antarmuka kedua habitat ini. Baik estimasi leluhur (Bonett et al., 2022 ; Fabre et al., 2020 ; Johnson & Voss, 2013 ; Schoch & Werneburg, 2023 ) dan catatan fosil (Jia et al., 2022 ) menunjukkan bahwa salamander pertama adalah bifasik, tetapi juga menunjukkan beberapa evolusi independen dari siklus hidup lain dalam kelompok tersebut. Oleh karena itu, banyak spesies terestrial sepenuhnya merupakan pengembang langsung, dengan metamorfosis lengkap terjadi di dalam telur setelah oviposisi, menghasilkan juvenil yang menetas dengan sifat dewasa. Pada spesies vivipar, metamorfosis lengkap dapat terjadi di dalam rahim, melahirkan juvenil dengan sifat dewasa (pueriparitas) atau setelah tahap larva akuatik (larviparitas). Dengan demikian, spesies pueripar tidak mengalami transisi habitat selama perkembangan, sementara spesies larvipar bertransisi dari ekologi akuatik ke ekologi terestrial (Buckley, 2012 ; Buckley et al., 2007 ; Velo-Antón et al., 2014 ). Terakhir, pada spesies paedomorfik, metamorfosis bersifat parsial dan spesies dewasa akuatik mempertahankan ciri larva.
Variasi dalam siklus hidup Caudata telah terbukti memengaruhi evolusi struktur morfologi dan keanekaragamannya. Studi terbaru telah menyoroti pengaruh signifikan kelengkapan metamorfosis diferensial pada berbagai bagian kerangka yang terlibat dalam penggerak, menunjukkan tingkat evolusi yang lebih tinggi dalam bentuk tubuh (Bonett & Blair, 2017 ), tulang belakang (Bonett & Blair, 2017 ) dan anggota badan (Ledbetter & Bonett, 2019 ) pada spesies paedomorfik dibandingkan dengan spesies bifasik dan berkembang langsung. Demikian pula, Fabre dan rekannya (Fabre et al., 2020 ) mengungkapkan tingkat evolusi bentuk tengkorak yang lebih tinggi, serta disparitas bentuk tengkorak yang lebih besar pada spesies paedomorfik dibandingkan dengan spesies yang mengalami metamorfosis lengkap. Hasil-hasil ini juga menyoroti modularitas yang lebih besar (yaitu, peningkatan independensi morfologi di antara struktur-struktur kranial) pada spesies bifasik dan yang berkembang langsung, yang menunjukkan bahwa metamorfosis lengkap dapat memfasilitasi perombakan sebagian struktur kranial, yang dapat memainkan peran dalam diversifikasi pola makan pada spesies terestrial dan semi-akuatik. Meskipun Fabre dan rekannya (Fabre et al., 2020 ) memberikan studi tentang variasi bentuk kranial, menangani interaksi antara metamorfosis dan transisi lingkungan melalui faktor ekologi utama seperti pola makan memerlukan fokus yang lebih spesifik pada aparatus pengunyahan. Sementara kranial dan mandibula dapat terintegrasi dengan kuat (misalnya Goswami, 2006 ), sifat multifungsi kranial (Hanken & Hall, 1993 ) membatasi interpretasi langsung dalam kaitannya dengan pola makan. Dalam konteks ini, eksplorasi mandibula yang spesifik merupakan pendekatan yang sangat melengkapi untuk studi kranial (Fabre et al., 2020 ).
Di sini, kami menyelidiki bagaimana metamorfosis dan transisi ekologi terkait mendorong evolusi morfologi mandibula di Caudata. Untuk tujuan ini, kami membuat kumpulan data baru pada mandibula dari 317 spesies Caudata, yang mencakup seluruh rentang variasi siklus hidup yang masih ada, filogeni generik (>99%) dan keanekaragaman ekologi klade. Kami mengeksplorasi tiga pertanyaan utama: Pertama, bagaimana variasi siklus hidup memengaruhi keanekaragaman morfologi mandibula di Caudata? Karena ukuran telah terbukti memengaruhi bentuk tengkorak (Fabre et al., 2020 ), kami juga menyelidiki tren alometrik di seluruh siklus hidup. Kami berharap bahwa siklus hidup dan ukuran akan memiliki pengaruh yang signifikan terhadap keanekaragaman morfologi mandibula, yang menghasilkan perbedaan morfologi antara spesies dengan siklus hidup yang berbeda. Kedua, apakah metamorfosis lengkap memfasilitasi evolusi diferensial struktur mandibula, sehingga memungkinkan diversifikasi pola makan dan adaptasi terhadap habitat terestrial? Kami memperkirakan bahwa spesies yang mengalami metamorfosis lengkap akan menunjukkan modularitas mandibula yang lebih tinggi, seperti yang terdeteksi di tengkorak (Fabre et al., 2020 ). Ketiga, apakah metamorfosis parsial mendorong evolusi cepat sifat-sifat dan dengan demikian mendorong diversifikasi morfologi pada spesies paedomorfik yang sepenuhnya akuatik? Konsisten dengan penelitian sebelumnya (Fabre et al., 2020 ; Ledbetter & Bonett, 2019 ), kami berhipotesis bahwa pergeseran ke arah metamorfosis parsial dapat mendorong evolusi cepat tulang mandibula dan perkembangan morfologi yang lebih berbeda.
2 METODE
2.1 Sampel dan akuisisi data 3D
Bahasa Indonesia: Kami menyusun satu set data model 3D untuk 184 spesimen yang tersedia dari repositori daring, bersama dengan 181 pemindaian CT baru (lihat Tabel S1 untuk rincian akuisisi), untuk mencakup rentang siklus hidup dan keanekaragaman ekologi di seluruh klade Caudata. Set data akhir kami mencakup 364 spesimen dewasa yang termasuk dalam 317 spesies, yang mewakili semua 10 famili Caudata (Gambar 1c ; Tabel 1 ; Gambar S1 ; Tabel S1 dan S2 ). Avizo 9.0 (FEI Visualisation Sciences Group) digunakan untuk melakukan segmentasi dan mengekspor rekonstruksi mandibula setiap spesimen sebagai file PLY. Semua model 3D diimpor ke Geomagic Wrap v.2013.0.1 (Sistem 3D) untuk membersihkan, memperbaiki, dan memusnahkan jerat sebelum penandaan.

| Skala inferensi | Skala penerapan faktor minat | Jumlah replikasi pada skala yang sesuai |
|---|---|---|
| Jenis | Spesies ( n = 317) | Pengukuran morfometri geometri dilakukan pada satu hingga tiga individu per spesies. |
2.2 Pengumpulan data tentang siklus hidup dan habitat makan
Data tentang siklus hidup dan habitat makan dikumpulkan dari literatur untuk setiap spesies (Tabel S2 ). Mengikuti (Fabre et al., 2020 ), kami mendefinisikan spesies sebagai bifasik ketika mereka memiliki siklus hidup multifasik (sebagian besar dengan siklus hidup dua bagian), yang menampilkan tahap larva akuatik diikuti oleh metamorfosis menjadi dewasa akuatik atau lebih terestrial (Bonett & Blair, 2017 ; Hanken, 1992 ); sebagai pengembang langsung ketika mereka sepenuhnya berubah dalam telur setelah oviposisi, menetas langsung sebagai versi miniatur terestrial dari orang dewasa; sebagai vivipar ketika telur menetas di dalam rahim, dengan beberapa spesies vivipar mengalami metamorfosis sebelum akhir kehamilan—betina melahirkan juvenil darat yang sudah berkembang sepenuhnya (pueriparitas)—dan spesies vivipar lainnya mengalami metamorfosis setelah akhir kehamilan, di mana betina melahirkan larva akuatik kecil di dalam air (larviparitas) (Dinis & Velo-Antón, 2017 ) dan sebagai paedomorfik ketika mereka mempertahankan ciri larva akuatik setelah mencapai kematangan reproduksi. Di sini, kami menganggap spesies bifasik, yang berkembang secara langsung, dan vivipar sebagai metamorfosis yang lengkap.
Klasifikasi ini merupakan penyederhanaan berlebihan dari siklus hidup. Beberapa spesies yang termasuk dalam kumpulan data kami bersifat bifasik fakultatif, di mana beberapa populasi dapat berupa pedomorfik atau bifasik, yang sering dikaitkan dengan perubahan habitat (Tabel S2 ). Dalam kasus seperti itu, kami menggunakan klasifikasi siklus hidup yang sesuai dengan spesimen yang digunakan dalam penelitian ini, dan kami membuat cabang-cabang baru pada filogeni ketika kedua siklus hidup terwakili. Cabang-cabang baru ini dicangkokkan ke simpul-simpul spesies yang sesuai. Misalnya, spesies Ambystoma altamirani terwakili dalam bentuk bifasik dan pedomorfik dalam kumpulan data kami. Dengan demikian, kami menambahkan cabang baru berlabel A. altamirani (pedomorfik) ke pohon filogenetik pada simpul yang sama dengan A. altamirani (bifasik) untuk mempertimbangkan variasi ini. Variasi juga hadir di antara spesies bifasik, dengan beberapa yang trifasik, seperti Notophthalmus viridescens , yang memiliki larva akuatik, juvenil terestrial, dan dewasa akuatik (Kraemer & Adams, 2014 ), atau Ichthyosaura alpestris dan Lissotriton vulgaris , yang trifasik dan berubah secara musiman antara kehidupan akuatik dan terestrial pada tahap dewasa (Heiss & Grell, 2019 ). Kami mengintegrasikan variasi yang lebih kompleks ini ke dalam kategori bifasik.
Kategori paedomorfik bahkan lebih kompleks, termasuk beberapa spesies yang menjalani metamorfosis diferensial atau parsial, dengan variasi dalam komposisi sifat larva yang dipertahankan hingga dewasa. Dengan demikian, tingkat pengkodean yang lebih halus dirancang untuk spesies paedomorfik untuk mewakili berbagai tingkat kelengkapan metamorfosis. Tingkat-tingkat tersebut didefinisikan sebagai berikut, dalam urutan kelengkapan menaik: « pd1 » menunjukkan spesies paedomorfik dengan insang eksternal dengan celah, sirip ekor, tidak ada kelopak mata, tidak ada tulang rahang atas, tidak ada septomaxilla dan tidak ada prefrontal; « pd2 » menunjukkan spesies paedomorfik yang berbeda dari « pd1 » oleh tulang rahang atas yang berkembang sebelum dewasa; « pd3 » menunjukkan spesies paedomorfik yang berbeda dari « pd1 » dengan menyajikan tulang rahang atas dan prefrontal yang berkembang sebelum dewasa; « pd4 » menunjukkan spesies pedomorfik yang berbeda dari « pd1 » karena tidak memiliki insang eksternal dan tulang maksila dan prefrontal berkembang sebelum dewasa (Tabel S2 ).
Tingkat klasifikasi yang lebih rinci tidak dapat digunakan dalam sebagian besar analisis kami, karena hal ini akan menonjolkan perbedaan statistik dan mencegah perhitungan tertentu.
Untuk menilai dampak variasi siklus hidup pada diversifikasi morfologi dan fungsional mandibula di Caudata, kami menggunakan klasifikasi berdasarkan habitat makan. Kategori habitat makan meliputi lingkungan akuatik, semi-akuatik dan terestrial (Tabel S2 ). Kategori akuatik mencakup semua spesies yang menghabiskan seluruh kehidupan dewasanya di bawah air. Kategori terestrial mengelompokkan semua spesies yang hidup di permukaan yang menjalani seluruh kehidupan dewasanya di tanah, di bawah batu atau batang kayu, di vegetasi atau di pohon. Kategori semi-akuatik mencakup spesies yang hidup di permukaan yang hidup di antarmuka antara habitat akuatik dan terestrial, sering kali beralih di antara lingkungan ini sepanjang hidup mereka. Klasifikasi ini membantu mendefinisikan ekologi umum spesies pada tahap dewasa (yaitu akuatik dan semi-akuatik atau terestrial) sambil juga menangkap keragaman pola makan. Klasifikasi pola makan yang lebih tepat dibatasi oleh data yang tersedia dalam literatur.
2.3 Kuantifikasi bentuk mandibula
Sebanyak sembilan landmark dan sembilan kurva (semi-landmark geser) ditempatkan pada permukaan mandibula untuk mengukur morfologi setiap tulang mandibula Caudata: dentary, prearticular-angular dan coronoid (Gambar 1a,b ; Gambar S2 ; lihat Tabel S3 untuk deskripsi anatomi dan jumlah landmark per kurva). Semua landmark dicatat secara manual menggunakan perangkat lunak Stratovan Checkpoint (Stratovan Corporation v2022.07.21.1321). Semi-landmark yang dihasilkan dari Stratovan Checkpoint diambil sampelnya kembali dan digeser sepanjang kurva sambil meminimalkan energi tekukan menggunakan paket Morpho v2.7 (Schlager et al., 2019 ) yang diimplementasikan dalam perangkat lunak R v4.3.2 (Tim Inti Pengembangan R, 2019 ).
Semua spesies Caudata memiliki dua daerah mandibula yang selalu ada: dentary dan kompleks tulang preartikular-angular (Gambar S2 ). Artikular mungkin tampak mengeras pada beberapa spesies, tetapi umumnya tulang rawan pada sebagian besar salamander. Selain itu, daerah keempat, yang diwakili oleh tulang koronoid, hadir di hampir semua spesies pedomorfik dan beberapa spesies bifasik. Untuk mewakili seluruh bentuk mandibula dan membandingkan bentuk tengkorak di seluruh kumpulan data, kami hanya mempertimbangkan daerah yang secara konsisten mengeras. Koronoid, ketika tidak ada, diwakili oleh satu posisi landmark (ditempatkan pada bagian anterior preartikular-angular untuk mewakili daerah yang hilang dengan lebih baik). Ini dicapai dengan mereplikasi landmark tunggal ini dan membentuk larik dengan dimensi yang sama dengan landmark tunggal dan kumpulan data kurva dari spesimen dengan koronoid yang ada (Bardua et al., 2019 ; Klingenberg, 2008 ). Dengan demikian, wilayah yang tidak ada direpresentasikan dalam himpunan data ini sebagai permukaan yang sangat kecil, yang bersesuaian dengan dimensi yang sama dengan wilayah yang terdapat pada spesies lain.
Penyelarasan Procrustes umum dilakukan pada seluruh mandibula menggunakan fungsi ‘ gpagen ‘ dari paket R geomorph v.4.0.5 (Adams & Otárola-Castillo, 2013 ), dan daerah yang hilang diberi ukuran bukan nol (tetapi dapat diabaikan) (Bardua et al., 2019 ). Bentuk rata-rata dihitung untuk semua spesimen yang termasuk dalam spesies yang sama dengan siklus hidup yang sama menggunakan koordinat Procrustes, dan bentuk rata-rata ini digunakan dalam semua analisis hilir.
Ukuran centroid untuk semua spesies diperkirakan menggunakan paket R geomorph v.4.0.5 (Adams & Otárola-Castillo, 2013 ). Nilai ukuran centroid yang ditransformasikan ke Log10 (selanjutnya disebut sebagai ‘ukuran centroid’) digunakan untuk memenuhi asumsi linearitas dalam semua analisis hilir.
2.4 Pohon filogenetik
Analisis komparatif dilakukan pada pohon kalibrasi waktu kredibilitas klade maksimum (MCC) yang diperkirakan dari sampel 1000 pohon yang diterbitkan oleh (Jetz & Pyron, 2018 ) (Gambar 1c ). MCC dihitung menggunakan fungsi ‘ maxCladeCred ‘ dari paket R phangorn v2.11.1 (Schliep, 2011 ). Pohon MCC ini dipangkas ke spesies yang ada dalam kumpulan data kami untuk analisis komparatif hilir. Beberapa spesies dalam kumpulan data kami tidak ada dalam filogeni. Untuk spesies ini, kami membuat cabang baru dalam filogeni dan mencangkokkannya ke simpul spesies yang paling dekat hubungannya berdasarkan literatur. Thorius tlaxiacus , Thorius pinicola , Thorius longicaudaus , Tylototriton himalayanus , Eurycea hillisi , dan Lissotriton kosswigi dari kumpulan data kami dicangkokkan sebagai taksa saudara dalam filogeni dengan Thorius macdougalli (Parra-Olea et al., 2016 ), Thorius grandis (Parra-Olea et al., 2016 ), Thorius pinicola (Parra-Olea et al., 2016 ), Tylototriton yangi (Wang et al., 2018 ), Eurycea chamberlaini (Wray et al., 2017 ), dan Lissotriton vulgaris (Wielstra et al., 2015 ), masing-masing. Selain itu, Siren reticulata diposisikan sebagai takson saudara dari klade yang dibentuk oleh Siren intermedia dan S. lacertina (Graham et al., 2018 ).
2.5 Konstruksi model regresi
Untuk mengeksplorasi pengaruh siklus hidup dan ukuran centroid pada bentuk mandibula, sambil memperhitungkan korelasi filogenetik, kami memasang model linear multivariat pada data menggunakan fungsi ‘ mvgls ‘ di mvMORPH v1.1.9 (Clavel et al., 2015 ). Bentuk (yaitu, koordinat Procrustes yang ditumpangkan) adalah variabel dependen, dengan siklus hidup (dikodekan sebagai variabel faktorial) dan ukuran centroid disertakan sebagai kovariat dalam model. Korelasi filogenetik dimodelkan menggunakan empat model evolusi yang berbeda: gerak Brown, Early Burst, Ornstein-Uhlenbeck dan lambda Pagel. Karena data bentuk berdimensi tinggi (yaitu, lebih banyak dimensi daripada spesies), model dipasang dengan kemungkinan penalti dan diberi peringkat menggunakan Kriteria Informasi Umum (GIC) (Clavel et al., 2019 ). Model dengan nilai GIC terendah, lambda Pagel, dipertahankan untuk analisis hilir.
2.6 Menyelidiki variasi bentuk dengan perbedaan ukuran dan siklus hidup
Bahasa Indonesia: Untuk menilai dampak siklus hidup dan ukuran centroid pada bentuk mandibula, kami melakukan uji tipe II (analisis kovarians multivariat filogenetik—MANCOVA) pada model regresi yang paling sesuai dari tiga set penanda untuk data bentuk: (1) seluruh set, termasuk dentary, preartikular-angular, dan koronoid; (2) dentary saja dan (3) kompleks tulang preartikular-angular yang terisolasi. Analisis ini dilakukan dengan menggunakan statistik lambda Wilks dan dinilai dengan 1000 permutasi, menggunakan fungsi ‘ manova.gls ‘ dari paket R mvMORPH v1.1.9 (Clavel & Morlon, 2020 ). Kami kemudian menguji pengaruh ukuran centroid pada bentuk mandibula untuk setiap siklus hidup secara terpisah menggunakan parameter pengodean kontras yang diimplementasikan dalam fungsi ‘manova.gls’. Ukuran multivariat yang disesuaikan dari asosiasi atau ukuran efek (multivariat eta square) dihitung dari statistik lambda Wilks (Kim & Olejnik, 2005 ) untuk setiap prediktor menggunakan fungsi ‘ effectsize ‘ di mvMORPH .
Untuk menghitung morfospasial mandibula, kami menggunakan analisis komponen utama filogenetik (Gambar S3 ) dengan fungsi ‘ mvgls.pca ‘ dari paket R mvMORPH v1.1.9 (Clavel & Morlon, 2020 ). Selain itu, untuk memvisualisasikan perbedaan bentuk antara siklus hidup dengan lebih baik, kami menggunakan Analisis Fungsi Diskriminan (Gambar S4 ) dengan fungsi ‘ mvgls.dfa ‘ dari paket R mvMORPH v1.1.9 (Clavel & Morlon, 2020 ). Kedua analisis dilakukan pada estimasi model regresi, termasuk siklus hidup dan ukuran centroid sebagai kovariat.
Untuk meneliti interaksi antara ukuran centroid, bentuk, siklus hidup dan kelengkapan metamorfosis pada spesies paedomorfik, kami menyelidiki tren allometrik menggunakan skor multivariat sebagai data bentuk (‘ mvscores ‘ yang diperoleh menggunakan fungsi ‘ plot ‘ dalam paket R mvMORPH v1.1.9). Skor multivariat sesuai dengan proyeksi data bentuk ke vektor regresi untuk setiap variabel independen yang termasuk dalam model (Drake & Klingenberg, 2008 ). Kami juga memproyeksikan ke bidang yang sama prediksi multivariat dari model regresi untuk memvisualisasikan tren allometrik.
2.7 Menyelidiki dampak siklus hidup pada integrasi morfologi dan modularitas
Bahasa Indonesia : Untuk menguji apakah mandibula lebih modular (yaitu, apakah bagian-bagian mandibula bervariasi lebih independen dari bagian-bagian lain; Wagner, 1996 ) pada spesies yang mengalami metamorfosis lengkap dibandingkan dengan spesies yang mengalami metamorfosis diferensial, kami melakukan analisis integrasi dan modularitas yang diinformasikan secara filogenetik untuk setiap kategori siklus hidup. Kami menggunakan fungsi ‘ phylo.integration ‘ dan ‘ phylo.modularity ‘ dari paket R geomorph v4.0.5 (Adams et al., 2022 ; Adams & Otárola-Castillo, 2013 ). Fungsi-fungsi ini memperkirakan rasio kovariansi dalam dan di antara modul-modul yang dihipotesiskan dan membandingkan rasio-rasio ini dengan hipotesis nol dari penugasan acak variabel bentuk pada partisi (Adams & Felice, 2014 ; Adams & Peres-Neto, 2016 ). Dua modul yang dipertimbangkan di sini untuk mandibula adalah dentary dan kompleks tulang preartikular-angular, karena mereka memiliki asal dan fungsi perkembangan yang berbeda. Tidak seperti kompleks tulang preartikular-angular, dentary mengalami perombakan sebagian selama metamorfosis pada tingkat gigi (Parker & Dunn, 1964 ; Rose, 2003 ). Selain itu, dentary berfungsi sebagai modul penyangga gigi selama makan, sedangkan kompleks tulang preartikular-angular berfungsi sebagai tempat perlekatan otot dan berartikulasi dengan kranium. Baik hipotesis integrasi maupun modularitas diuji menggunakan 1000 permutasi.
2.8 Menilai dampak siklus hidup terhadap laju evolusi morfologi
Untuk menilai apakah laju evolusi morfologi dibatasi oleh metamorfosis lengkap, seperti yang diamati pada struktur kranial dan apendikular (Fabre et al., 2020 ; Ledbetter & Bonett, 2019 ), kami menghitung laju evolusi untuk setiap tulang mandibula di berbagai siklus kehidupan.
Pertama, kami melakukan estimasi status leluhur dari siklus hidup untuk membandingkan pergeseran dalam laju evolusi morfologi dengan perolehan siklus hidup yang berbeda. Kami menggunakan model Markov (Lewis, 2001 ) untuk memperkirakan transisi masa lalu antara siklus hidup pada simpul internal dalam filogeni kami. Enam pola laju transisi antara status karakter diuji: (1) semua transisi sama (ER); (2) transisi berbeda untuk setiap status tetapi simetris (SYM); (3) semua transisi berbeda (ARD); (4) transisi berbeda tetapi tanpa transisi yang diizinkan setelah viviparitas diperoleh (terbatas Vi); (5) transisi berbeda tetapi tanpa transisi yang diizinkan setelah pedomorfosis diperoleh (terbatas Pd) dan (6) transisi berbeda tetapi tanpa transisi yang diizinkan setelah viviparitas atau pedomorfosis diperoleh (terbatas Vi dan Pd). Model dipasang 1000 kali untuk setiap pola transisi menggunakan fungsi ‘ fitMk ‘ dari paket R phytools v.2.2-3 (Revell, 2024 ). Kesesuaian terbaik untuk setiap pola transisi ditentukan menggunakan log-likelihood maksimum, dan enam kesesuaian terbaik dibandingkan menggunakan ANOVA, dengan pemilihan model berdasarkan AIC.
Kedua, kami mensimulasikan 1000 pemetaan karakter stokastik dari status siklus hidup ke pohon filogenetik kami menggunakan model yang paling sesuai. Simulasi ini dilakukan dengan fungsi ‘ make.simmap ‘ dari phytools v.2.2-3 (Revell, 2024 ). Untuk setiap pohon yang disimulasikan, kami memasangkan model linier (menggunakan metode kemungkinan yang diberi penalti) yang menyertakan siklus hidup dan ukuran centroid sebagai variabel prediktif untuk morfologi mandibula, berdasarkan model evolusi gerak Brown multi-laju (model ‘BMM’) menggunakan fungsi ‘ mvgls ‘ di mvMORPH . Laju evolusi untuk setiap siklus hidup diperoleh dari estimasi parameter rata-rata dari 1000 model yang dipasangkan. Perbedaan berpasangan dalam laju evolusi antara siklus hidup diuji menggunakan uji Wilcoxon dengan koreksi Bonferroni.
2.9 Menilai dampak siklus hidup terhadap perbedaan morfologi
Bahasa Indonesia: Untuk menguji apakah metamorfosis parsial mendorong disparitas morfologis, seperti yang diamati pada tengkorak Caudata (Fabre et al., 2020 ), kami mengevaluasi disparitas bentuk di berbagai jenis siklus hidup. Untuk memperhitungkan korelasi filogenetik dalam analisis disparitas, kami menghasilkan koordinat bentuk baru dari model linier yang disesuaikan (sebelumnya dijelaskan di bagian ‘Konstruksi model regresi’). Data bentuk baru ini diperoleh dengan menjumlahkan nilai yang disesuaikan dengan residual yang dinormalisasi dari model. Kami menilai disparitas morfologis mandibula sebagai jumlah varians untuk setiap kelompok siklus hidup, menggunakan fungsi ‘ disparity.per.group ‘ dari paket R dispRity v1.3.5 (Guillerme, 2018 ). Perbedaan berpasangan dalam perbedaan morfologi antara siklus kehidupan dievaluasi menggunakan uji signifikansi Wilcoxon dengan koreksi Bonferroni, menggunakan fungsi ‘test.dispRity’ dalam dispRity .
2.10 Memisahkan dampak siklus hidup dan habitat makan pada evolusi morfologi
Dalam contoh kami, spesies yang berkembang secara langsung dan vivipar secara eksklusif bersifat terestrial, sementara semua spesies paedomorfik bersifat akuatik. Hal ini menciptakan efek pengganggu yang potensial yang dapat memengaruhi interpretasi analisis. Namun, di antara spesies dengan siklus hidup bifasik, kita dapat membedakan spesies yang terutama terkait dengan lingkungan akuatik atau terestrial, serta spesies yang tumbuh subur di persimpangan keduanya. Untuk mengurai efek siklus hidup dan habitat makan pada integrasi morfologi, modularitas, laju evolusi, dan disparitas, kami membandingkan hasil antara spesies paedomorfik yang sepenuhnya akuatik dan spesies yang berkembang secara langsung dan vivipar yang sepenuhnya terestrial, di samping tren yang diamati di antara spesies bifasik akuatik, semi-akuatik, dan terestrial.
3 HASIL
3.1 Siklus hidup mempengaruhi bentuk mandibula di Caudata
Uji MANCOVA mengungkapkan perbedaan signifikan ( p < 0,05) dalam bentuk mandibula (semua tulang), dentary dan preartikular-angular, tergantung pada jenis siklus hidup dan ukuran centroid, serta interaksi signifikan antara kedua prediktor (Tabel 2 ).
| Statistik Wilks | Ukuran efek | nilai p | |
|---|---|---|---|
| Semua tulang | |||
| Siklus hidup | 0,03 | 0.48 | <0,001 |
| Ukuran | 0.27 | 0.54 | <0,001 |
| Siklus hidup:ukuran | 0,07 | 0.27 | <0,001 |
| Dokter Gigi | |||
| Siklus hidup | 0.11 | 0.28 | <0,001 |
| Ukuran | 0,45 | 0.33 | <0,001 |
| Siklus hidup:ukuran | 0.18 | 0.16 | <0,001 |
| Preartikular-sudut | |||
| Siklus hidup | 0.24 | 0.29 | <0,001 |
| Ukuran | 0.63 | 0.26 | <0,001 |
| Siklus hidup:ukuran | 0.52 | 0,05 | 0,03 |
Catatan : Semua nilai- p signifikan pada tingkat signifikansi 5%.
Analisis Fungsi Diskriminan lebih lanjut menekankan perbedaan bentuk ini. Sumbu diskriminan pertama (85%) membedakan spesies paedomorfik dari spesies yang mengalami metamorfosis sempurna (termasuk spesies bifasik, berkembang langsung, dan vivipar). Sumbu ini dengan demikian mewakili gradien metamorfosis, mulai dari spesies dengan metamorfosis sempurna (berkembang langsung, bifasik, dan vivipar) hingga spesies dengan metamorfosis tidak sempurna (spesies paedomorfik), dengan spesies paedomorfik yang menunjukkan metamorfosis hampir sempurna sebagai perantara (misalnya, Cryptobranchidae dan Amphiumidae). Bentuk yang terkait dengan sumbu ini mengungkapkan bahwa spesies paedomorfik memiliki rahang bawah yang dicirikan oleh tulang dentary yang memanjang dan lebih lurus, kompleks tulang preartikular-sudut yang lebih kuat dengan ujung posteroventral sudut yang berkembang dengan baik dan adanya tulang koronoid dibandingkan dengan spesies yang mengalami metamorfosis sempurna (Gambar 2 ).
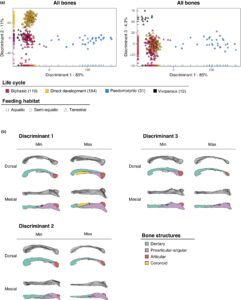
Sumbu diskriminan kedua (11%) membedakan spesies bifasik dari spesies yang berkembang langsung (Gambar 2 ). Bentuk yang terkait dengan sumbu ini menunjukkan bahwa spesies yang berkembang langsung menunjukkan dentary ramping, preartikular yang berkembang dengan baik dan ekstremitas angular yang memanjang ke posterior, berbeda dengan spesies bifasik. Sumbu ini juga menyoroti perbedaan antara spesies bifasik dalam famili Plethodontidae (diwakili oleh Desmognathus bifasik pada ujung negatif DFA) dan plethodontida yang berkembang langsung. Plethodontida bifasik ini menunjukkan prosesus koronoid yang berkembang ke arah dorsal pada preartikular, dengan ekstremitas posterior tulang angular yang menonjol ke arah ventral.
Sumbu diskriminan ketiga (4,3%) memisahkan spesies vivipar dari spesies bifasik (Gambar 2 ). Bentuk mandibula yang diasosiasikan dengan spesies vivipar menunjukkan dentary dengan daerah simfisis anterior yang relatif lebih besar, ramus yang ramping, prosesus posterior yang lebih tipis, kompleks tulang preartikular-angular yang diratakan secara mesio-lateral, preartikular yang relatif lebih sempit dan memanjang ke anterior, dan prosesus koronoid yang relatif lebih kecil dibandingkan dengan spesies bifasik (Gambar 2 ).
3.2 Ukuran mempengaruhi bentuk mandibula pada spesies bifasik, berkembang langsung dan pedomorfik
Regresi multivariat filogenetik bentuk kompleks tulang mandibula, dentary, dan preartikular-angular pada ukuran centroid menunjukkan alometri yang signifikan pada spesies bifasik, perkembangan langsung, dan paedomorfik, kecuali untuk kompleks tulang preartikular-angular pada spesies perkembangan langsung. Sebaliknya, alometri tidak signifikan pada spesies vivipar di semua elemen tulang (Tabel 3 ).
| Statistik Wilks | Ukuran efek | nilai p | |
|---|---|---|---|
| Semua tulang | |||
| Bifasik | 0.30 | 0.46 | 0,001 |
| Pengembangan langsung | 0,45 | 0.19 | 0,002 |
| Pedomorfik | 0.26 | 0,55 | 0,001 |
| Yg melahirkan anak hidup | 0.66 | -0,17* | 0.941 |
| Dokter Gigi | |||
| Bifasik | 0,45 | 0.32 | 0,001 |
| Pengembangan langsung | 0,59 | 0.12 | 0,019 |
| Pedomorfik | 0.41 | 0.38 | 0,001 |
| Yg melahirkan anak hidup | 0.73 | -0,10* | 0.906 |
| Preartikular-sudut | |||
| Bifasik | 0.68 | 0.20 | 0,001 |
| Pengembangan langsung | 0.81 | 0,05 | 0.109 |
| Pedomorfik | 0.74 | 0.12 | 0,004 tahun |
| Yg melahirkan anak hidup | 0,90 | -0,06* | 0.932 |
Catatan : Nilai- p yang signifikan (pada level 5%) ditampilkan dalam huruf tebal. Ukuran efek yang dikoreksi bias negatif, ditunjukkan dengan tanda bintang, ditafsirkan sebagai efek yang tidak terlihat.
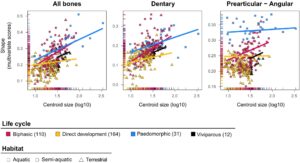
Regresi data bentuk pada ukuran centroid (Gambar 3 ) menyoroti lintasan alometrik yang berbeda untuk setiap tulang di seluruh siklus hidup. Khususnya, kompleks tulang preartikular-sudut pada spesies pedomorfik menunjukkan kemiringan rendah yang unik dengan intersep yang berbeda. Lebih jauh, pada pedomorfik, tingkat kelengkapan metamorfosis berkorelasi dengan ukuran, dengan spesies yang lebih besar mengalami metamorfosis yang lebih lengkap daripada yang lebih kecil (Gambar S5 ).
3.3 Metamorfosis mendorong modularitas mandibula
Integrasi morfologi filogenetik mandibula lebih tinggi pada spesies paedomorfik (dengan nilai r-PLS mendekati 1) dibandingkan dengan spesies bifasik dan berkembang langsung (Gambar 4a ; Tabel S4 ). Prosedur resampling tidak memberikan dukungan statistik untuk estimasi integrasi morfologi filogenetik pada spesies vivipar (Tabel S4 ). Di antara spesies bifasik, spesies terestrial menunjukkan integrasi morfologi filogenetik yang lebih tinggi daripada spesies akuatik dan semi-akuatik (Gambar 4a ; Tabel S4 ).
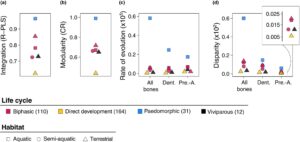
Demikian pula, modularitas morfologi filogenetik mandibula lebih rendah pada spesies paedomorfik (dengan nilai CR mendekati 1) dibandingkan pada spesies bifasik, berkembang langsung, dan vivipar (Gambar 4b ; Tabel S4 ). Dalam spesies bifasik, spesies terestrial menunjukkan modularitas morfologi filogenetik yang lebih rendah dibandingkan dengan spesies akuatik dan semi-akuatik (Gambar 4b ; Tabel S4 ).
3.4 Pengaruh kelengkapan metamorfosis dan habitat makan terhadap laju evolusi morfologi
Model SYM merupakan model yang paling baik didukung untuk estimasi siklus hidup leluhur (Gambar S6 dan S7 ). Model ini memperkirakan leluhur umum terbaru dari Caudata sebagai spesies bifasik. Siklus hidup bifasik berevolusi ulang beberapa kali secara independen di Ambystomatidae dan Plethodontidae. Transisi ke siklus hidup paedomorfik terjadi 12 kali di seluruh filogeni kami, yang mencakup total enam famili (Cryptobranchidae, Sirenidae, Ambystomatidae, Proteidae, Amphiumidae, dan Plethodontidae). Perkembangan langsung muncul sekali dan mewakili status leluhur Plethodontidae. Viviparitas muncul sekali di Salamandridae.
Berdasarkan analisis ini, perkiraan laju evolusi morfologi untuk seluruh mandibula, dentary dan kompleks preartikular-angular menunjukkan bahwa spesies paedomorfik menunjukkan laju tertinggi (Gambar 4c ; Tabel S5 dan S6 ). Sebaliknya, spesies yang berkembang langsung menunjukkan laju evolusi morfologi terendah di seluruh unit mandibula. Di antara spesies bifasik, laju evolusi morfologi seluruh mandibula dan kompleks preartikular-angular pada spesies akuatik sedikit tetapi signifikan lebih tinggi dibandingkan dengan spesies terestrial (Gambar 4c ; Tabel S5 dan S6 ). Sebaliknya, tidak ada perbedaan dalam laju evolusi dentary antara spesies akuatik dan terestrial.
3.5 Metamorfosis parsial mendorong terjadinya disparitas morfologi
Dibandingkan dengan spesies lain, spesies paedomorfik menunjukkan disparitas yang lebih tinggi di seluruh mandibula, serta dalam bentuk dentary dan prearticular-angular ketika dipertimbangkan secara terpisah (Gambar 4d ; Tabel S7 dan S8 ). Sebaliknya, spesies yang berkembang secara langsung menunjukkan disparitas terendah di semua struktur anatomi. Di antara spesies bifasik, spesies akuatik dan terestrial menunjukkan tingkat disparitas yang sama, keduanya lebih tinggi daripada spesies semi-akuatik (Gambar 4d ; Tabel S7 dan S8 ).
3.6 Habitat makan memberikan wawasan tentang keragaman cara makan
Klasifikasi berdasarkan habitat makan memungkinkan untuk memperhitungkan perbedaan dalam keanekaragaman cara makan, dengan gradien keanekaragaman cara makan yang meningkat dari spesies akuatik ke terestrial. Di lingkungan akuatik, makan sebagian besar dicapai melalui makan dengan isapan. Makan dengan isapan memanfaatkan perluasan rongga bukal yang cepat untuk menangkap mangsa. Pola ini digunakan oleh semua spesies pedomorfik dan sebagian besar spesies bifasik akuatik dan semi-akuatik, kecuali beberapa plethodontida, rhyacotritonida, dan hynobiida, yang dapat menggunakan lingual dan rahang yang mencengkeram (Deban & Wake, 2000 ; Schwenk & Wake, 1993 ). Di lingkungan terestrial, pola makan lebih beragam, termasuk rahang yang mencengkeram (misalnya, di Dicamptodon ), protraksi lidah (misalnya, di Tylototriton ), dan proyeksi lidah balistik (misalnya, di Hydromantes ) (Wake & Deban, 2000 ).
4 DISKUSI
4.1 Bentuk mandibula pada Caudata dipengaruhi oleh siklus hidup dan ukuran
Siklus hidup yang kompleks, yang melibatkan transisi ekologi dan/atau transformasi morfologi melalui metamorfosis, tersebar luas di kingdom animalia (Laudet, 2011 ; McMahon & Hayward, 2016 ; Rainford et al., 2014 ; Rolff et al., 2019 ; Truman, 2019 ). Penelitian terbaru tentang pengaruh tingkat kelengkapan metamorfosis pada evolusi morfologi di Caudata telah memberikan wawasan baru ke dalam proses yang mendorong diversifikasi morfologi dalam klade ini dan telah menunjukkan bahwa heterokroni dan variasi dalam siklus hidup mengarah pada pola evolusi yang berbeda (Bonett & Blair, 2017 ; Fabre et al., 2020 ; Ledbetter & Bonett, 2019 ). Analisis kami terhadap morfologi mandibula menunjukkan bahwa siklus hidup dan ukuran centroid memengaruhi bentuk mandibula secara signifikan, dengan interaksi yang kompleks antara faktor-faktor ini, kecuali pada spesies vivipar (Tabel 3 ; Gambar 3 ). Namun, mengingat viviparitas pada Caudata diwakili oleh sejumlah spesies yang terbatas, kami mungkin tidak memiliki kekuatan statistik yang cukup untuk mendeteksi efek serupa.
Baik siklus hidup maupun tingkat kelengkapan metamorfosis memengaruhi morfologi mandibula pada Caudata dewasa. Konsisten dengan temuan untuk kranium (Fabre et al., 2020 ), hasil kami membedakan spesies paedomorfik dengan metamorfosis parsial dari spesies yang mengalami metamorfosis sempurna. Mirip dengan hasil untuk kranium, bentuk mandibula spesies paedomorfik cenderung lebih ramping, memanjang, dan meruncing. Namun, sebaliknya, mandibula spesies paedomorfik mengandung lebih banyak tulang, karena koronoid dipertahankan pada orang dewasa tetapi hilang pada spesies yang mengalami metamorfosis sempurna. Cryptobranchids dan amphiumids menunjukkan bentuk mandibula intermediet, dengan rahang bawah yang lebih kuat dan bulat. Morfologi ini, seperti yang dijelaskan oleh Deban dan Wake ( 2000 ), mungkin terkait dengan fakta bahwa baik cryptobranchids maupun amphiumids mengalami metamorfosis yang lebih sempurna dan menampilkan fitur dewasa dan larva dibandingkan dengan sebagian besar spesies paedomorfik lainnya.
Di antara spesies yang mengalami metamorfosis lengkap, hasil kami membedakan bentuk mandibula antara spesies yang berkembang langsung dan bifasik, dan di antara spesies bifasik, yang termasuk dalam genus Desmognathus (Plethodontidae). Bentuk mandibula yang khas dari Desmognathus mungkin terkait dengan mekanisme rahang khusus mereka, yang beradaptasi untuk menggigit dan mencari makan di antara bebatuan dan substrat di dasar sungai (misalnya Deban & Richardson, 2017 ; Hinderstein, 1971 ; Wake, 1966 ). Perilaku mencari makan ini dikaitkan dengan fleksi kepala ventral unik yang meningkatkan kekuatan gigitan selama penutupan rahang. Prosesus koronoid yang kuat dan berkembang dengan baik di bagian dorsal preartikular pada spesies Desmognathus kemungkinan memfasilitasi perlekatan otot-otot khusus dan ligamen atlanto-mandibular, yang memungkinkan mereka untuk melakukan gerakan ini. Sebaliknya, sebagian besar plethodontida yang berkembang secara langsung tidak memiliki kekuatan gigitan yang kuat, melainkan memperlihatkan mekanisme pembukaan mulut yang normal di mana tengkorak tetap kaku saat mandibula diturunkan (Wake, 1966 ). Hal ini mungkin menjelaskan mandibula berbentuk C yang lebih anggun yang diamati pada spesies ini. Bentuk mandibula juga bervariasi dengan siklus hidup di antara Salamandridae: spesies vivipar memperlihatkan ramus dentary yang relatif lebih anggun dan tulang preartikular yang pipih secara mesio-lateral dibandingkan dengan spesies bifasik, termasuk salamandrid bifasik.
Bentuk kompleks tulang preartikular-angular lebih khas antara kategori siklus hidup daripada unit mandibula lainnya, terutama pada spesies paedomorfik (Gambar 3 ; Gambar S5 ). Metamorfosis parsial pada spesies paedomorfik—di mana ciri larva dipertahankan hingga dewasa, berlawanan dengan metamorfosis lengkap yang diamati pada spesies bifasik, berkembang langsung, dan vivipar—dapat berkontribusi pada bentuk preartikular-angular yang unik ini. Hasil ini juga menekankan bahwa bentuk preartikular-angular pada spesies yang berkembang langsung tidak dipengaruhi oleh ukuran (Gambar 3 ; Tabel 3 ). Ini mungkin mencerminkan diferensiasi fenotipik rendah yang mencirikan radiasi non-adaptif yang menyebabkan diversifikasi plethodontida, yang mewakili setengah dari keragaman Caudata yang masih ada dan mencakup semua pengembang langsung. Penelitian masa depan tentang dampak ukuran pada bentuk sepanjang ontogeni akan sangat penting untuk menyelidiki lebih lanjut komponen alometrik metamorfosis.
4.2 Metamorfosis dapat meningkatkan keragaman fungsional
Organisme yang mengalami metamorfosis sering mengalami perubahan lingkungan dan ekologi yang signifikan selama perkembangan (Collet & Fellous, 2019 ). Namun, karena tahap perkembangan berbagi genom yang sama, tekanan seleksi yang bekerja pada perkembangan awal dapat memiliki efek berjenjang pada tahap ontogenetik selanjutnya (Alberch, 1980 ; Cheverud et al., 1983 ; Moran, 1994 ). Korelasi genetik ini mungkin tidak menguntungkan ketika sifat yang dipilih selama perkembangan awal menjadi merugikan pada tahap selanjutnya, sebuah konsep yang dikenal sebagai ‘pleiotropi ontogenetik antagonis’ (Albecker et al., 2021 ). Sebaliknya, hipotesis ‘pemisahan ontogenetik’, juga disebut sebagai ‘hipotesis pemisahan adaptif’, menunjukkan bahwa metamorfosis berevolusi sebagai mekanisme untuk memutus hubungan perkembangan dan genetik (Albecker et al., 2021 ). Akibatnya, metamorfosis akan mendorong evolusi independen dari sifat atau struktur anatomi—yang didefinisikan sebagai modularitas (Olson & Miller, 1951 ; Wagner, 1996 )—dan memfasilitasi perombakan fenotipik untuk mengatasi tekanan seleksi yang berlawanan yang dialami selama berbagai tahap kehidupan.
Fabre et al. ( 2020 ) menunjukkan bahwa spesies bifasik dan berkembang langsung menunjukkan modularitas yang lebih tinggi pada tulang tengkorak yang terkait dengan fungsi makan (misalnya sendi rahang, kuadratus, skuamosa, dan pterigoid). Sejalan dengan temuan ini, analisis kami mengungkapkan bahwa spesies yang mengalami metamorfosis lengkap (bifasik, berkembang langsung, dan vivipar) juga menunjukkan modularitas yang lebih besar pada mandibula mereka dibandingkan dengan spesies paedomorfik (Gambar 3b dan 4a ). Spesies yang mengalami metamorfosis lengkap dan menunjukkan modularitas yang lebih tinggi pada struktur kepala yang terlibat dalam makan juga menunjukkan keragaman mode makan yang lebih besar, termasuk prehension rahang (misalnya pada Dicamptodon), protraksi lidah (misalnya pada Tylototriton), dan proyeksi lidah balistik (misalnya pada Hydromantes) (Wake & Deban, 2000 ).
Sebaliknya, spesies yang mengalami metamorfosis parsial (yaitu spesies paedomorfik) bergantung secara eksklusif pada makan dengan isapan (Deban & Wake, 2000 ; Heiss et al., 2013 ; Heiss & Grell, 2019 ). Makan dengan isapan, strategi umum pada vertebrata akuatik, memanfaatkan perluasan rongga bukal yang cepat untuk menangkap mangsa. Pada Caudata, kompleks tulang preartikular-angular memainkan peran penting dalam membuka dan menutup mulut melalui perlekatan otot (Deban & Wake, 2000 ). Sementara makan dengan isapan mendominasi di antara salamander akuatik, beberapa spesies bifasik akuatik dan semi-akuatik—seperti beberapa plethodontida, rhyacotritonida, dan hynobiida—dapat menggunakan strategi alternatif seperti lingual dan prehension rahang (Deban & Wake, 2000 ; Schwenk & Wake, 1993 ).
Temuan-temuan ini menunjukkan bahwa, dengan mendorong modularitas kranium (Fabre et al., 2020 ) dan mandibula, metamorfosis lengkap mungkin telah mendorong lintasan evolusi yang berbeda dan adaptasi makan, yang memfasilitasi evolusi relung terestrial dan semi-akuatik pada Caudata bifasik, yang berkembang secara langsung, dan vivipar. Akibatnya, hasil kami selaras dengan hipotesis ‘pemisahan ontogenetik’ (Albecker et al., 2021 ).
Di antara spesies yang mengalami metamorfosis lengkap, pengembang langsung menunjukkan modularitas tertinggi, sementara spesies paedomorfik menunjukkan yang terendah. Mengingat bahwa semua pengembang langsung adalah terestrial dan semua spesies paedomorfik adalah akuatik, hasil ini menunjukkan bahwa habitat makan juga dapat memengaruhi modularitas mandibula, yang berpotensi membingungkan analisis kami. Namun, ketika memeriksa spesies bifasik, yang mencakup ekologi terestrial sepenuhnya, akuatik sepenuhnya, dan semi-akuatik, kami mengamati tren yang berlawanan. Spesies bifasik akuatik menunjukkan modularitas tertinggi, sementara rekan terestrial mereka menunjukkan yang terendah. Selain itu, perbedaan dalam integrasi dan modularitas antara spesies bifasik terestrial dan akuatik kurang menonjol dibandingkan dengan perbedaan antara spesies paedomorfik yang sepenuhnya berkembang secara langsung dan spesies paedomorfik yang sepenuhnya akuatik. Sementara efek habitat makan tidak dapat sepenuhnya dikesampingkan, temuan ini menggarisbawahi peran penting metamorfosis dalam membentuk modularitas mandibula di Caudata.
4.3 Metamorfosis parsial mendorong laju evolusi morfologi dan disparitas
Salamander menunjukkan keragaman siklus hidup yang luar biasa dan sejarah evolusi yang kompleks yang ditandai oleh banyak transisi independen. Misalnya, paedomorfosis telah berevolusi beberapa kali secara independen dari siklus hidup bifasik leluhur, yang dianggap sebagai keadaan leluhur (plesiomorfik) pada salamander (Johnson & Voss, 2013 ; Bonett & Blair, 2017 ; Fabre et al., 2020 ; Bonett et al., 2022 ; Schoch & Werneburg, 2023 dan penelitian ini). Sebaliknya, perkembangan langsung dan viviparitas hanya berevolusi satu kali, masing-masing dalam famili Plethodontidae dan Salamandridae, dan siklus hidup bifasik telah berevolusi kembali beberapa kali dari spesies yang berkembang langsung (Bonett et al., 2014 ; Bonett et al., 2022 ; Bonett & Blair, 2017 ; Fabre et al., 2020 ) (Gambar S7 ).
Penelitian sebelumnya menunjukkan bahwa transisi menuju siklus hidup yang melibatkan pengurangan durasi atau laju perkembangan (misalnya, dari bifasik ke paedomorfik atau dari perkembangan langsung ke bifasik) dikaitkan dengan percepatan laju evolusi dalam morfologi tengkorak dan anggota tubuh (Fabre et al., 2020 ; Ledbetter & Bonett, 2019 ), serta peningkatan disparitas bentuk tengkorak (Fabre et al., 2020 ). Temuan kami menguatkan pola ini, menunjukkan bahwa spesies paedomorfik menunjukkan tingkat evolusi mandibula yang lebih tinggi dan disparitas morfologi yang lebih besar dibandingkan dengan spesies yang mengalami metamorfosis sempurna. Sebaliknya, spesies yang berkembang langsung menunjukkan tingkat evolusi terendah dan disparitas morfologi paling kecil pada mandibula (Gambar 3d dan 4c ).
Karena semua spesies paedomorfik bersifat akuatik dan semua spesies yang berkembang langsung bersifat terestrial, kebiasaan makan dan ekologi juga dapat berperan dalam evolusi morfologi mandibula. Jika demikian halnya, kita juga akan mengharapkan perbedaan yang signifikan dalam laju evolusi morfologi dan disparitas antara spesies bifasik akuatik dan terestrial. Namun, analisis kami menunjukkan hasil yang kontras. Spesies bifasik terestrial menunjukkan laju evolusi yang lebih tinggi dan disparitas yang lebih besar dalam bentuk seluruh mandibula dibandingkan dengan spesies bifasik akuatik. Di sisi lain, tidak ada perbedaan dalam laju evolusi atau disparitas dalam bentuk dentary yang diamati antara kedua kelompok ini. Untuk kompleks tulang preartikular-angular, spesies bifasik akuatik menunjukkan laju evolusi morfologi yang lebih tinggi, sedangkan spesies bifasik terestrial menunjukkan disparitas bentuk yang lebih besar. Meskipun pengaruh perancu dari habitat makan pada laju evolusi dan kesenjangan tidak dapat dikesampingkan, tren yang kontras dan amplitudo perbedaan yang rendah antara spesies bifasik darat dan air menyoroti pengaruh siklus hidup pada perbedaan morfologi mandibula di Caudata.
Secara keseluruhan, hasil-hasil ini menunjukkan bahwa proses heterokronik memengaruhi laju evolusi morfologi di Caudata. Pergeseran ke arah metamorfosis parsial (yaitu paedomorfosis) mungkin telah memfasilitasi evolusi cepat sifat-sifat dan pengembangan morfologi yang lebih berbeda menuju optima adaptif, yang memungkinkan spesies paedomorfik berevolusi dalam kondisi lingkungan yang ekstrem, seperti habitat gua akuatik dan lumpur organik. Di sisi lain, metamorfosis lengkap, yang menginduksi perombakan morfologi utama selama ontogeni, dapat melepaskan kendala integrasi dan mendorong pengembangan morfologi yang beradaptasi dengan berbagai strategi makan. Oleh karena itu, proses heterokronik yang mendukung kelengkapan metamorfosis akan berdampak berbeda pada keragaman morfologi dan keragaman fungsional di Caudata.
5 KESIMPULAN
Proses perkembangan memainkan peran mendasar dalam menyusun keragaman morfologi. Hasil kami menggambarkan bagaimana metamorfosis dapat memfasilitasi diversifikasi pola makan pada spesies Caudata yang terkait dengan lingkungan terestrial dengan mendorong modularitas mandibula. Di sisi lain, metamorfosis parsial dan pergeseran ke arah ekologi yang lebih akuatik mungkin telah melonggarkan kendala evolusi dan memfasilitasi diversifikasi bentuk pada spesies paedomorfik. Dengan demikian, penelitian ini menyoroti interaksi kompleks antara metamorfosis dan lingkungan pada evolusi morfologi di antara spesies, dan memberikan wawasan baru tentang peran heterokroni dalam diversifikasi morfologi organisme.



