Abstrak
Dalam studi ini, uji coba 60 hari dilakukan untuk menentukan efek ekstrak tanaman kari ( Helichrysum italicum ) dalam diet ikan trout pelangi ( Oncorhynchus mykiss ) dengan berat hidup rata-rata awal 15,84 ± 0,05 g pada kinerja pertumbuhan dan ekspresi gen yang terkait dengan pencernaan, kapasitas antioksidan, dan respons imun. Empat diet eksperimental diformulasikan sebagai diet basal (Kontrol; C) dan diet yang disuplemen dengan berbagai tingkat ekstrak tanaman kari (CP05; 0,5 g kg −1 , CP1; 1 g kg −1 , dan CP2; 2 g kg −1 ). Indeks pertumbuhan menunjukkan peningkatan yang signifikan di semua kelompok ekstrak tanaman kari dibandingkan dengan kelompok C ( p < 0,05). Demikian pula, tingkat ekspresi tripsin, lipase, dan amilase yang lebih tinggi diamati pada kelompok ekstrak tanaman kari dibandingkan dengan kelompok C ( p < 0,05). Tingkat ekspresi gen superoksida dismutase (SOD), katalase (CAT), dan glutathione peroksidase (GPx) meningkat pada kelompok ekstrak CP ( p < 0,05). Tingkat ekspresi interleukin-1β (IL-1β), faktor nekrosis tumor (TNF-α), dan interleukin-8 (IL-8) juga dipengaruhi oleh penambahan ekstrak CP ke dalam makanan, yang menunjukkan perubahan signifikan ( p < 0,05). Sebagai kesimpulan, penelitian ini secara eksperimental menunjukkan bahwa suplementasi makanan ikan trout pelangi dengan ekstrak CP dapat memengaruhi parameter pertumbuhan yang sehat secara positif.
1. PENDAHULUAN
Sebagai sektor produksi pangan yang tumbuh paling cepat, akuakultur berpotensi memenuhi permintaan pangan yang terus meningkat (Ahmad et al., 2021 ; FAO, 2022 ). Ikan trout pelangi ( Oncorhynchus mykiss ) merupakan salah satu spesies yang berperan penting dalam pertumbuhan ini. Namun, tantangan seperti tingkat stok yang tinggi, masalah pengelolaan penyakit, dan resistensi penyakit akibat stres semakin meningkat (Payne et al., 2022 ). Dengan adanya pembatasan antibiotik, minat terhadap strategi peningkatan kekebalan alternatif semakin meningkat (Bondad-Reantaso et al., 2023 ), sementara keterbatasan bahan pakan menjadi lebih jelas (Aas et al., 2022 ).
Pemberian bahan-bahan fungsional dalam pakan merupakan pilihan yang menjanjikan yang dapat meningkatkan pemanfaatan pakan dan meminimalkan masalah penyakit (Goda et al., 2018 ). Bahan-bahan fungsional yang ramah lingkungan, tidak beracun, dan bioaktif telah mendapatkan popularitas dalam budidaya ikan bersirip selama dekade terakhir (Vijayaram et al., 2022 ). Di antara aditif ini, tanaman aromatik obat meningkatkan pemanfaatan pakan, mendorong pertumbuhan yang sehat, mendukung sistem kekebalan tubuh, dan meningkatkan sifat antioksidan, sehingga meningkatkan produktivitas selama periode budidaya (Awad & Awaad, 2017 ). Penggunaan ekstrak bunga dari tanaman aromatik obat dalam pakan telah dilaporkan memiliki efek positif pada pertumbuhan, sistem kekebalan tubuh, dan aktivitas antioksidan pada berbagai ikan budidaya (Rashidian et al., 2020 ; Shekarabi et al., 2021 ; Sun et al., 2019 ).
Tanaman kari (CP) ( Helichrysum italicum ) dari famili Asteraceae, tanaman aromatik obat yang dibudidayakan, digunakan secara luas tidak hanya sebagai tanaman hias tetapi juga dalam pengobatan alternatif dan industri makanan karena berbagai aktivitas farmakologisnya (Kramberger et al., 2021 ; Viegas et al., 2014 ). Efek antioksidan, antimikroba, dan regeneratif dari CP telah diselidiki dalam berbagai penelitian in vitro dan in vivo. Penggunaan internalnya telah dilaporkan menunjukkan efek antiinflamasi pada tikus dan efek penurun gula darah pada tikus (Kramberger et al., 2021 ). Tinjauan sistematis oleh Šovljanski et al. ( 2024 ) menunjukkan bahwa minyak esensial CP menunjukkan aktivitas antimikroba yang kuat terhadap berbagai spesies bakteri dan jamur, yang dikonfirmasi melalui metode in vitro seperti difusi agar dan mikrodilusi. ( 2020 ) menunjukkan bahwa minyak atsiri tanaman ini menghambat pertumbuhan sel pada sel melanoma tikus B16F10. Demikian pula, Cebi et al. ( 2024 ) melaporkan bahwa minyak CP menekan pertumbuhan sel kanker Caco-2 hingga 48% sementara tidak menunjukkan efek toksik pada sel fibroblas L929 yang sehat. Selain itu, studi in vitro oleh Serra et al. ( 2024 ) menemukan bahwa bentuk hidrosol tanaman meningkatkan penyembuhan luka dengan meningkatkan produksi kolagen pada sel induk kulit manusia dan fibroblas. Selain itu, penelitian terbaru menunjukkan bahwa CP juga dapat mendukung pertumbuhan melalui mekanisme tidak langsung. Misalnya, Kenig et al. ( 2021 ) menunjukkan bahwa infus tanaman ini meningkatkan metabolisme lemak dan pengeluaran energi dalam sel hati. Studi lain pada tikus diabetes menemukan bahwa minyak atsiri yang dioleskan mempercepat penyembuhan luka dan mendukung regenerasi jaringan (Andjić et al., 2022 ). Furlan dan Bren ( 2023 ) melaporkan bahwa tanaman tersebut juga dapat berkontribusi terhadap pertumbuhan secara tidak langsung dengan menjaga fungsi mitokondria dan mendukung produksi energi seluler. Berdasarkan latar belakang tersebut, penggunaan CP sebagai aditif pakan dalam diet dapat mendukung pertumbuhan ikan yang sehat. Namun, belum ada penelitian sebelumnya yang berfokus pada efek menguntungkan dari CP diet pada organisme akuatik. Oleh karena itu, dalam lingkup penelitian ini, yang bertujuan untuk meningkatkan efisiensi kultur dengan cara yang sehat, ekstrak CP diuji untuk pertama kalinya sebagai aditif pakan fungsional dalam akuakultur selama uji coba pemberian pakan selama 60 hari. Pada akhir uji coba, kinerja pertumbuhan dan ekspresi gen yang terkait dengan aktivitas antioksidan, parameter imun, dan enzim pencernaan ikan trout pelangi yang diberi makan dengan jumlah ekstrak CP yang berbeda dalam makanan ditentukan.
2 BAHAN DAN METODE
2.1 Persiapan dan komposisi fenolik ekstrak CP
Persiapan ekstrak dari CP (diperoleh dari Kebun Tanaman Obat dan Aromatik Van YYÜ) dilakukan dengan beberapa modifikasi pada metode yang dijelaskan oleh Karataş et al. ( 2020 ) dan Ghafarifarsani et al. ( 2022 ). Tanaman segar (bagian bunga) dicuci dengan air suling, dikeringkan di tempat teduh pada suhu 24°C selama 10 hari, lalu dihaluskan dengan penggiling. 100 g tanaman dicampur dengan 300 mL etanol (96%) dan dijaga pada 200 rpm pada pengocok orbital (24 jam). Campuran dilewatkan melalui kain kasa steril untuk memisahkan padatan, disentrifugasi selama 5 menit, dan disaring melalui kertas saring Whatman (Kertas Whatman, No. 1). Pelarut organik dihilangkan dengan evaporator, dan ekstrak murni disimpan pada suhu 4°C hingga digunakan. Ekstrak tersebut dikeringkan beku sebelum dimasukkan ke dalam makanan menggunakan liofilizer skala laboratorium (Christ Alpha 2–4 LD Plus) dengan program standar.
Konsentrasi senyawa fenolik dari ekstrak CP dianalisis di Universitas Atatürk (Pusat Penelitian dan Aplikasi Teknologi Tinggi Anatolia Timur, DAYTAM, Erzurum, Turki). Analisis dilakukan menggunakan sistem Agilent 6460 Triple Quad LC–MS/MS yang dipasangkan dengan UPLC Infinity 1290 dan kolom C18 fase terbalik. Suhu kolom dipertahankan pada 30°C selama proses berlangsung. Fase mobil terdiri dari air ultramurni dengan asam format (fase A) dan asetonitril dengan asam format (fase B). Laju alir pelarut yang konsisten sebesar 0,4 mL min -1 diterapkan, dan volume injeksi ditetapkan pada 5 μL. Ekstrak CP dianalisis menurut protokol jaminan kualitas/kontrol kualitas (QA/QC) (Can et al., 2024 ). Senyawa fenolik yang ditemukan dalam ekstrak CP ditunjukkan pada Tabel 1 .
| Menggabungkan | Konsentrasi akhir (ng mL −1 ) |
|---|---|
| Asam klorogenat | 49331.11 |
| Asam quinat | 12392.32 |
| Kuersetin | Nomor telepon 9039.10 |
| Asam fumarat | 2496.05 |
| Asam kafeat | 1062.88 |
| Asam vanili | 732.04 |
| Asam 4-OH-benzoat | 628.18 |
| Asam siringat | 537.90 |
| Asam galat | 224.59 |
| asam ferulat | 75.04 |
| Isorhamnetin | 72.28 |
| Asam p-Kumarat | 39.60 |
| Asam rosmarinat | 20.52 |
| Peonidin-3-o-glukosa | tanggal 18.19 |
| Sianidin-3-o-glukosa | 8.18 |
2.2 Persiapan dan komposisi diet
Bahan-bahan tersebut dilewatkan melalui penggilingan untuk membuat tepung halus (<100–150 μm) dan dicampur dengan mixer tipe laboratorium untuk membentuk adonan. Ekstrak CP dimasukkan ke dalam diet basal yang diformulasikan pada 0,5, 1, dan 2 g kg −1 . Pelet dengan diameter 2 dan 3 mm diperoleh dengan mesin pelet ekstrusi dingin. Kemudian, untuk gelatinisasi, pelet dimasak dengan pengukus bertekanan (tekanan 1 atmosfer, 20 menit) dan dikeringkan pada suhu 40°C untuk memastikan kadar air yang konstan. Kadar protein kasar, lipid kasar, abu kasar, dan serat kasar untuk bahan baku dan diet ditentukan menurut AOAC ( 2000 ). Protein kasar dianalisis menggunakan metode Kjeldahl, dan kadar lipid kasar ditentukan menggunakan metode ekstraksi otomatis ANKOM XT-15 (Macedon, NY). Abu kasar ditentukan dengan pembakaran sampel dalam tungku muffle pada suhu 525°C selama 12 jam. Serat kasar ditentukan dengan hidrolisis asam/alkali dari residu yang disaring dan pembakaran sampel yang dikeringkan selama 3 jam. Formulasi diet diberikan dalam Tabel 2 .
| Bahan-bahan (%) | C | CP05 | CP1 | CP2 |
|---|---|---|---|---|
| Tepung ikan | 30 | 30 | 30 | 30 |
| Konsentrat protein kedelai | 11 | 11 | 11 | 11 |
| Bungkil kedelai | 23 | 23 | 23 | 23 |
| Kolagen | 1.5 | 1.5 | 1.5 | 1.5 |
| Gluten jagung | 4 | 4 | 4 | 4 |
| Konsentrat protein beras | 5 | 5 | 5 | 5 |
| Tepung terigu | 10 | 9.95 | 9.9 | 9.8 |
| Minyak ikan | 14.4 | 14.4 | 14.4 | 14.4 |
| Premix vitamin dan mineral | 1 | 1 | 1 | 1 |
| Vitamin C | 0.1 | 0.1 | 0.1 | 0.1 |
| Ekstrak tanaman kari | angka 0 | 0,05 | 0.1 | 0.2 |
| Total | 100 | 100 | 100 | 100 |
| Protein kasar | 48,16 ± 0,01 | 48,22 ± 0,02 | 48,09 ± 0,02 | 48,14 ± 0,01 |
| Lipid kasar | 18,17 ± 0,02 | 18,10 ± 0,01 | 18,09 ± 0,01 | 18,11 ± 0,02 |
| Abu mentah | 7,82 ± 0,02 | 7,78 ± 0,03 | 7,86 ± 0,01 | 7,89 ± 0,01 |
| Selulosa | 2,14 ± 0,01 | 2,19 ± 0,01 | 2,21 ± 0,01 | 2,34 ± 0,01 |
Catatan : Data disajikan sebagai rata-rata ± kesalahan standar (SE).
Singkatan: C, diet basal; CP05, diet yang dilengkapi dengan 0,05% ekstrak tanaman kari; CP1, diet yang dilengkapi dengan 0,1% ekstrak tanaman kari; CP2, diet yang dilengkapi dengan 0,2% ekstrak tanaman kari.
2.3 Ikan percobaan, desain, dan kondisi kultur
Ikan trout pelangi diperoleh dari peternakan ikan lokal dan dipelihara selama 15 hari di Universitas Tokat Gaziosmanpasa, Tokat, Turki, tempat percobaan dilakukan, untuk menyesuaikan diri dengan kondisi percobaan. Selama aklimatisasi, ikan diberi makan makanan dasar tiga kali sehari sampai kenyang. Sebanyak 240 ikan trout pelangi yang sehat (15,84 ± 0,05 g) dibagi secara acak ke dalam 12 tangki dengan volume 200 L, dengan 20 ikan di setiap tangki dalam rangkap tiga. Makanan yang diformulasikan disiapkan untuk mengandung 0, 0,5, 1, dan 2 g kg −1 ekstrak CP dan diberi label C, CP05, CP1, dan CP2, masing-masing. Protokol pemberian makanan diberikan ad libitum tiga kali sehari (08.00 pagi, 1.00 dan 6.00 sore) dengan makanan yang diformulasikan sampai ikan mencapai rasa kenyang (semua pakan dikonsumsi) selama 60 hari. Aliran air mata air alami yang berkelanjutan sebesar 4 L min −1 diberikan ke setiap tangki selama percobaan. Setiap hari, suhu air (°C), pH, dan oksigen terlarut (mg L −1 ) dicatat, menghasilkan pengukuran masing-masing sebesar 15,4 ± 0,3°C, 7,3 ± 0,2, dan 7,4 ± 0,3 mg L −1 .
2.4 Indeks pertumbuhan dan pengambilan sampel
Pada akhir percobaan, parameter pertumbuhan dihitung menggunakan rumus standar berikut:

Ikan dipuasakan selama 24 jam sebelum pengambilan sampel. Tiga ekor ikan dari setiap tangki, sembilan ekor per kelompok, diambil sampelnya dan ditempatkan dalam bak eugenol (200 mg L −1 , 60 detik). Untuk analisis ekspresi gen, jaringan hati (enzim antioksidan dan parameter imun) dan usus (enzim pencernaan) segera dikeluarkan dari ikan yang diambil sampelnya dan disimpan dalam larutan RNAlater hingga isolasi RNA (disimpan pada suhu 4°C selama 24 jam dan kemudian pada suhu −18°C hingga analisis molekuler).
2.5 Isolasi RNA
Total RNA diekstraksi dari sampel jaringan menggunakan DiaRex® Total RNA Extraction Kit (TR-0877-100, Diagen, Ankara, Turki), mengikuti petunjuk pabrik pembuatnya. Singkatnya, 600 μL larutan LBD ditambahkan ke 25 mg jaringan, yang kemudian dihomogenkan menggunakan Tissuelyser LT (Qiagen). Setelah dihomogenkan, campuran disentrifugasi dua kali pada 3000 rpm selama 30 detik setiap kali dan dibiarkan menginkubasi pada suhu kamar selama 5 menit. Supernatan yang dihasilkan dipindahkan ke tabung Eppendorf 2 mL, dicampur dengan 600 μL etanol 99%, dan disentrifugasi pada 8000 g (10.000 rpm) selama 1 menit. Supernatan kemudian dilewatkan melalui kolom putar dan disentrifugasi lagi pada 8000 g (10.000 rpm) selama 1 menit. Setelah ini, 500 μL larutan WBD-1 dan WBD-2 ditambahkan secara berurutan, dengan sentrifugasi pada 8000 g (10.000 rpm) selama 1 menit setelah setiap penambahan untuk menyelesaikan proses pencucian. Terakhir, 30 μL larutan EBD ditambahkan, dan RNA dielusi dengan sentrifugasi pada 8000 g selama 2 menit. Kuantitas dan kemurnian RNA yang diisolasi dinilai menggunakan nanospektrofotometer (QIAxpert), yang mengukur absorbansi pada 260 dan 280 nm. Kemurnian RNA dievaluasi berdasarkan rasio RNA (260/280) untuk setiap sampel.
2.6 Sintesis cDNA
Semua langkah sintesis cDNA dilakukan di atas es menggunakan SuScript cDNA Synthesis Kit (RT01A026, Sugenomics, Ankara, Turki). Sampel RNA distandarisasi hingga mencapai konsentrasi 100 ng per mikroliter. Untuk reaksinya, 6 μL RNA, 4 μL campuran 5× RT, dan 10 μL air bebas DNase/RNase dicampur hingga mencapai volume total 20 μL. Campuran ini kemudian diinkubasi dalam thermal cycler (Rotor Gene Q 9000) pada suhu 42°C selama 60 menit, diikuti oleh suhu 80°C selama 10 menit.
2.7 Analisis ekspresi gen
Produk cDNA dianalisis menggunakan PCR real-time pada RotorGene Q 9000 (Qiagen) dengan 2× SuYBRGreen qPCR Master Mix (PCR01C0253, Sugenomics, Ankara, Turki). β-aktin digunakan sebagai gen referensi untuk analisis ekspresi gen, sedangkan gen target meliputi superoksida dismutase (SOD), katalase (CAT), glutathione peroksidase (GPx), interleukin-1β (IL-1β), faktor nekrosis tumor (TNF-α) dan interleukin 8 (IL-8), tripsin, lipase, dan amilase. Primer yang digunakan dalam penelitian ini tercantum dalam Tabel 3 .
| Gen target | Urutan primer (5′–3′) | Ukuran amplikon (bp) | Anil Tm (°C) | Nomor akses. |
|---|---|---|---|---|
| β-Aktin (Beta-Aktin) | F: GGAGGGCTCCATCTTGGCTTC
R: GAAGTGGTAGTCGGGTGTGG |
158 | 61 | AJ438158.1 |
| Tripsin | F: TATGTGAAGCCCATCCCGTT
R: TCTGCCTCCGTCCATGTATC |
219 | 59 | XM_021591477 |
| Lipase | F: ATGGCAGCTTTCTCCTTCCT
R: ATGGTCAGGGTGAGGTTCAG |
197 | 58 | Nomor NM_001197210 |
| Amilase | F: ACAAGGAGCATGTGAGGGAA
R: CAGGTGGTTTGAGGTTGTG |
151 | 58 | XM_036935172 |
| CAT (Katalase) | F: TGATGTCACACAGGTGCGTA
R: GTGGGCTCAGTGTTGTTGAG |
195 | 58 | XM_021557350.2 |
| GPx (Glutathione peroksidase) | F: CGAGCTCCATGAACGGTACG
R: TGCTCCCGTTCACATCCAC |
183 | 60 | HE687022.1 |
| SOD (Superoksida dismutase) | F: TGGTCCTGTGAAGCTGATTG
R: TTGTCAGCTCCTGCAGTCAC |
tahun 201 | 58 | AF469663.1 |
| IL-1β (Interleukin-1 beta) | F: AGCAGGACTACACCAAACCG
R: TCCTGATCGTAGAGGCCCAA |
184 | 59 | AJ004821.1 |
| TNF-α (Faktor nekrosis tumor-alfa) | F: GGCTGTGGGCGTTCTCTTA
R: AAATGGATGGCTTGCTTTCGC |
190 | 58 | Nomor NM_001124374.1 |
| IL-8 (Interleukin-8) | F: KACANG-KACANG-KACANG-KACANG-KACANG-KACANG
R: TGCTCATCTTGGGGTTACAGA |
162 | 60 | Nomor NM_001124279.1 |
Campuran PCR terdiri dari 12 μL 2× SuYBRGreen qPCR Master Mix, masing-masing 2,5 μL primer forward dan reverse, dan 4 μL H 2 O, sehingga volumenya menjadi 21 μL. Tambahan 4 μL cDNA ditambahkan untuk mencapai volume akhir 25 μL. Parameter siklus amplifikasi PCR ditetapkan sebagai berikut: pra-denaturasi awal pada 95 °C selama 10 menit, diikuti oleh 45 siklus 95 °C selama 45 detik dan 60 °C selama 45 detik untuk annealing. Untuk meminimalkan kesalahan eksperimen, reaksi PCR dilakukan dalam duplikat untuk semua sampel. Gen referensi β-aktin, yang menunjukkan ekspresi konsisten antara kelompok perlakuan dalam jaringan tertentu, digunakan untuk menormalkan nilai Ct yang diperoleh setelah PCR waktu nyata menggunakan kriteria koefisien variasi. Tingkat ekspresi gen target diukur menggunakan metode ambang siklus komparatif (Ct) (2^-ΔΔCt) (Livak & Schmittgen, 2001 ).
2.8 Statistik
Pada akhir percobaan, data yang terkumpul dianalisis menggunakan ANOVA satu arah. Untuk mengidentifikasi perbedaan signifikan antar kelompok, uji Tukey, analisis post hoc, digunakan. Pengujian dilakukan dengan ambang signifikansi α = 0,05, dan hasilnya dinyatakan sebagai mean ± standar error. Sebelum pengujian, statistik skewness dan kurtosis mengenai asumsi normalitas diperiksa, dan uji Levene digunakan untuk menentukan homogenitas varians. Analisis statistik dilakukan menggunakan perangkat lunak SPSS 12 (Colman & Pulford, 2006 ). Kontras polinomial linear dan kuadrat diterapkan untuk menilai efek linear dan kuadrat dari berbagai ekstrak CP makanan pada parameter pertumbuhan, dengan tingkat signifikansi p < 0,10, menggunakan prosedur GLM dalam perangkat lunak JMP (versi 8, SAS Institute Inc., Cary, NC). Model regresi tersegmentasi dengan titik henti digunakan untuk memprediksi tingkat optimum ekstrak CP makanan pada ikan berdasarkan FW, SGR, dan PER (Oosterbaan, 1994 ).
3 HASIL
Parameter pertumbuhan ikan trout pelangi yang dievaluasi pada akhir percobaan 60 hari dengan berbagai tingkat ekstrak CP makanan disajikan dalam Tabel 4. Metrik kinerja pertumbuhan, termasuk berat akhir (FW), pertambahan berat (WG), pertambahan berat harian (DWG), laju pertumbuhan spesifik (SGR), dan rasio efisiensi protein (PER) ikan, menunjukkan peningkatan kuadrat dengan dosis ekstrak CP makanan. Selain itu, tingkat FCR ditingkatkan secara kuadrat dengan ekstrak CP makanan. Nilai FW lebih unggul dan berbeda secara statistik ( p < 0,05) dalam kelompok ekstrak CP dibandingkan dengan kelompok C. Hasil yang diperoleh untuk FW dalam kelompok serupa dalam hal WG dan DWG ( p < 0,05). Tingkat SGR terendah ditemukan pada kelompok C ( p < 0,05), sedangkan kelompok ekstrak CP serupa di antara mereka sendiri. Nilai PER mencapai tingkat tertinggi dalam kelompok ekstrak CP dan berbeda dari kelompok C ( p < 0,05). Nilai FCR pada kelompok ekstrak CP adalah yang terendah, yang menunjukkan hasil terbaik, dan berbeda secara signifikan dari kelompok C ( p < 0,05). Tidak ada kematian di tangki selama percobaan, dan tingkat kelangsungan hidup tercatat sebesar 100% di semua kelompok.
| Parameter | C | CP05 | CP1 | CP2 | Nilai P | |
|---|---|---|---|---|---|---|
| Linier | Kuadrat | |||||
| saya | 15,82 ± 0,02 | 15,83 ± 0,04 | 15,90 ± 0,02 | 15,84 ± 0,03 | – | – |
| FW | 71,27 ± 0,70 miliar | 89,37 ± 0,50 per menit | 88,58 ± 0,20 per menit | 87,30 ± 0,27 per menit | 0,0001 | 0,0001 |
| Kelompok Kerja | 55,46 ± 0,71 miliar | 73,54 ± 0,53 satu | 72,69 ± 0,22 jam | 71,47 ± 0,23 satuan | 0,0001 | 0,0001 |
| Bahasa Indonesia: DWG | 0,93 ± 0,01b | 1,22 ± 0,01 satu | 1,21 ± 0,00 per menit | 1,19 ± 0,01 satu | 0,0001 | 0,0001 |
| SGR | 2,51 ± 0,02 miliar | 2,88 ± 0,02 satuan | 2,86 ± 0,01 satuan | 2,85 ± 0,00 per menit | 0,0001 | 0,0001 |
| PER | 2,32 ± 0,03 detik | 2,72 ± 0,02 satuan | 2,70 ± 0,01 pon | 2,63 ± 0,01 miliar | 0,0001 | 0,0001 |
| FCR | 0,90 ± 0,01 satu | 0,76 ± 0,01 miliar | 0,77 ± 0,00 b | 0,79 ± 0,00 b | 0,0001 | 0,0002 |
| Bahasa Indonesia: SR | 100 | 100 | 100 | 100 | – | – |
Catatan : Data disajikan sebagai rata-rata ± standar error (SE). Huruf kecil yang berbeda pada setiap baris menunjukkan perbedaan yang signifikan ( p < 0,05).
Singkatan: C, diet basal; CP05, diet yang disuplemen dengan 0,05% ekstrak tanaman kari; CP1, diet yang disuplemen dengan 0,1% ekstrak tanaman kari; CP2, diet yang disuplemen dengan 0,2% ekstrak CP; DWG, pertambahan berat badan harian rata-rata (g); FCR, rasio konversi pakan; FW, berat akhir (g); IW, berat awal (g); PER, rasio efisiensi protein (%); SGR, laju pertumbuhan spesifik (% hari -1 ); SR, tingkat kelangsungan hidup (%); WG, pertambahan berat badan (g).
Analisis garis putus-putus FW memperkirakan bahwa 0,52 g kg −1 ekstrak CP dalam pakan memiliki efek optimal pada berat akhir ikan. Selain itu, SGR dan PER menunjukkan bahwa 0,54 g kg −1 ekstrak CP dalam pakan memberikan hasil terbaik untuk laju pertumbuhan spesifik dan rasio efisiensi protein ikan (Gambar 1 ). Di luar ambang batas ini, hasil menurun (titik putus, simpul).

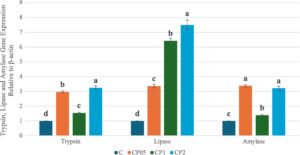
Ikan trout pelangi yang diberi diet yang disuplemen dengan berbagai tingkat ekstrak CP dievaluasi secara komparatif di antara kelompok-kelompok terkait ekspresi gen. Tingkat ekspresi gen yang terkait dengan pencernaan dalam usus ikan trout pelangi disajikan dalam Gambar 2. Tingkat ekspresi tripsin meningkat dalam kelompok CP05, CP1, dan CP2 dibandingkan dengan kelompok C ( p < 0,05). Dalam hal ekspresi gen lipase, sementara peningkatan regulasi tercatat dalam semua kelompok eksperimen dibandingkan dengan kelompok C, nilai-nilai ini adalah 3,5 kali lipat dalam kelompok CP05, 6,5 kali lipat dalam kelompok CP1, dan 7,5 kali lipat dalam kelompok CP2 ( p < 0,05). Ketika tingkat ekspresi gen amilase dibandingkan, peningkatan regulasi terjadi pada kelompok CP05, CP1, dan CP2 dibandingkan dengan kelompok C ( p < 0,05).
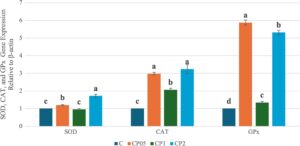
Ekspresi gen terkait SOD, CAT, dan GPx di hati ikan trout pelangi dibandingkan di antara kelompok-kelompok, dan perbedaan dalam tingkat ekspresi diberikan dalam Gambar 3. Tingkat ekspresi SOD meningkat pada kelompok CP05 dan CP2 dibandingkan dengan kelompok C ( p < 0,05), sedangkan kelompok CP1 mirip dengan kelompok C ( p > 0,05). Tingkat CAT meningkat pada semua kelompok eksperimen dibandingkan dengan kelompok C ( p < 0,05). Dalam tingkat ekspresi gen terkait GPx, kelompok CP05, CP1, dan CP2 menunjukkan perbedaan yang signifikan dibandingkan dengan kelompok C ( p < 0,05).
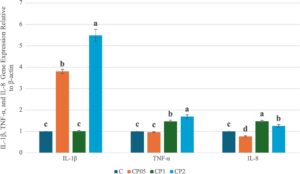
Tingkat ekspresi gen IL-1β, TNF-α, dan IL-8 dalam hati ikan trout pelangi diberikan dalam Gambar 4. Tingkat ekspresi gen IL-1β meningkat pada kelompok CP05 dan CP2 dibandingkan dengan kelompok C, dan tingkat ini adalah 3,8 kali lipat pada kelompok CP05 dan 5,5 kali lipat pada kelompok CP2 ( p < 0,05). Pada kelompok CP1, peningkatan regulasi yang signifikan ditemukan dibandingkan dengan kelompok C ( p < 0,05). Mengenai tingkat ekspresi gen TNF-α, peningkatan regulasi diamati pada kelompok CP1 dan CP2 dibandingkan dengan kelompok C ( p < 0,05), sedangkan kelompok CP05 mirip dengan kelompok kontrol ( p > 0,05). Ekspresi gen IL-8 meningkat secara signifikan pada kelompok CP1 dan CP2 dibandingkan dengan kelompok C ( p < 0,05). Pada kelompok CP05, penurunan regulasi yang signifikan terdeteksi dibandingkan dengan kelompok C ( p < 0,05).
4 DISKUSI
Dalam studi ini, kami berfokus pada tingkat ekspresi gen selain parameter pertumbuhan, karena hal tersebut memberikan informasi tentang mekanisme molekuler yang mendasari respons fisiologis yang diamati. Tingkat ekspresi gen yang terlibat dalam jalur antioksidan dan pencernaan dapat menunjukkan bagaimana suplementasi makanan memengaruhi regulasi transkripsi (Habte-Tsion et al., 2016 ). Pendekatan ini juga memudahkan pemahaman gen spesifik yang merespons intervensi makanan, yang dapat berkontribusi pada studi masa depan tentang aktivitas enzim dan pengujian fungsional. Data ini bertujuan untuk menjelaskan mekanisme yang dilalui ekstrak tanaman untuk memberikan efeknya.
Meskipun tanaman aromatik obat, yang merupakan aditif pakan fungsional dalam budidaya ikan, tidak dianggap sebagai perencanaan utama untuk pertumbuhan, penelitian sebelumnya telah melaporkan peningkatan yang signifikan dalam pertumbuhan ikan yang diberi pakan bahan-bahan ini (Gholamhosseini et al., 2021 ; Salomón et al., 2020 ; Shaluei et al., 2017 ). Ekstrak tanaman aromatik obat diketahui dapat meningkatkan sekresi enzim pencernaan dan berdampak positif pada nafsu makan (Immanuel et al., 2009 ; Rashidian et al., 2020 ). Selain itu, ekstrak tanaman ini kaya akan senyawa fenolik yang dapat meningkatkan pertumbuhan dan meningkatkan metabolisme ikan (Ghafarifarsani et al., 2022 ; Wangkahart et al., 2022 ). Dalam penelitian ini, menurut analisis komponen fenolik yang dilakukan untuk ekstrak CP, keberadaan 15 komponen berbeda ditentukan, dan fenolik penting seperti asam klorogenat, asam quinat, dan quercetin terwakili pada tingkat tinggi. Asam klorogenat memiliki berbagai sifat biologis, seperti efek imunogenik, antibakteri, antioksidan, dan anti-inflamasi (Kabir et al., 2014 ; Naveed et al., 2018 ; Xu et al., 2012 ). Asam klorogenat, sebagai aditif pakan, telah dilaporkan meningkatkan kinerja pertumbuhan pada berbagai hewan, termasuk ikan (Jin et al., 2023 ; Liu et al., 2022 ). Dilaporkan bahwa suplementasi diet asam klorogenat 600–800 mg kg −1 pada ikan trout pelangi meningkatkan parameter FW, WG, SGR, dan FCR (Ghafarifarsani et al., 2023 ). Berbagai studi farmakologis telah menunjukkan sifat antioksidan, antimikroba, dan antivirus dari asam quinat (Bai et al., 2022 ; Pero et al., 2009 ; Zanello et al., 2015 ). Quercetin adalah salah satu fenolik signifikan yang umum ditemukan dalam ekstrak tanaman. Quercetin diketahui memiliki berbagai efek biologis, seperti antioksidan, penangkal radikal bebas, antikanker, dan aktivitas antivirus (Ross & Kasum, 2002 ). Diet yang disuplemenkan quercetin meningkatkan kinerja pertumbuhan pada ikan nila (Zhai & Liu, 2013 ) dan ikan mas rumput (Xu et al., 2019 ). Studi sebelumnya juga mengamati hasil positif di mana berbagai ekstrak tanaman aromatik obat dengan sifat bioaktif yang diketahui diuji sebagai aditif pakan. Dalam sebuah penelitian yang menguji ekstrak yarrow ( Achillea millefolium L.) dengan kadar 0,1%, 0,5%, dan 1% dalam pakan ikan trout pelangi, dilaporkan bahwa nilai WG dan SGR meningkat. Nilai FCR meningkat pada ikan yang diberi ekstrak yarrow 1% pada akhir uji coba 30 hari (Bahabadi et al., 2014 ). Dalam sebuah studi yang menyelidiki aditif ekstrak Artemisia dracunculus pada dosis 0 (kontrol), 1%, 2%, dan 3% dalam pakan pada ikan trout pelangi selama 8 minggu, disarankan bahwa parameter pertumbuhan dan tingkat kelangsungan hidup meningkat pada semua kelompok aditif, terutama pada level 2%, dibandingkan dengan kelompok kontrol (Gholamhosseini et al., 2021 ). Nilai FW, WG, dan SGR ikan trout pelangi yang diberi ekstrak serai ( Melissa officinalis ) sebagai aditif pakan pada dosis 0 (kontrol), 0,1, 0,5, dan 1 g kg −1 selama 75 hari meningkat pada aditif 0,5 dan 1 g kg −1 dibandingkan dengan kontrol (Bilen et al., 2020 ). Konsisten dengan data sebelumnya, studi saat ini menemukan bahwa ekstrak CP diet secara positif memengaruhi kinerja pertumbuhan ikan trout pelangi. Ikan dalam kelompok ekstrak CP menunjukkan peningkatan pertumbuhan dan parameter pemanfaatan pakan dibandingkan dengan kelompok kontrol. Seperti yang dapat dipahami dari sebagian besar penelitian yang menguji ekstrak herbal dan komponen fenoliknya, efek pemacu pertumbuhan dari diet yang dilengkapi dengan ekstrak CP dalam uji coba pada ikan trout pelangi dapat dikaitkan dengan fungsi penting seperti pencernaan, pemanfaatan pakan, metabolisme, kapasitas antioksidan, dan respons imun. Senyawa dalam CP mungkin telah meningkatkan penyerapan nutrisi dengan mengatur ekspresi gen pencernaan, sementara kandungan karbohidrat mungkin telah memberikan sifat prebiotik yang mendukung pertumbuhan. Dapat disimpulkan bahwa mencapai keseimbangan dalam fungsi fisiologis ikan berdampak positif terhadap pertumbuhan.
Dalam penelitian ini, ekspresi gen yang terkait dengan pencernaan mengungkapkan bahwa ekstrak CP makanan memberikan kadar tripsin, lipase, dan amilase yang lebih tinggi pada ikan untuk semua kelompok ekstrak CP. Di antara parameter pertumbuhan, nilai FW, WG, DWG, SGR, dan FCR serupa di antara kelompok ekstrak CP. Dalam ekspresi gen mengenai enzim pencernaan, nilai tertinggi untuk tripsin tercatat dalam CP2, CP05, dan CP1; untuk lipase dalam CP2, CP1, dan CP05; dan untuk amilase dalam kelompok CP05, CP2, dan CP1, berturut-turut. Hal ini mendukung bahwa peningkatan ekspresi gen pencernaan dalam kelompok ekstrak CP meningkatkan kinerja pertumbuhan, tetapi juga menunjukkan bahwa perbedaan yang bergantung pada dosis untuk setiap ekspresi gen pencernaan tidak memiliki efek langsung pada pertumbuhan. Bahasa Indonesia: Dalam sebuah studi di mana berbagai ekstrak tanaman ( Quercus brantii , Coriandrum sativum dan Malva sylvestris ) dalam pakan diselidiki dalam kultur ikan mas ( Cyprinus carpio ), dilaporkan bahwa aktivitas enzim pencernaan lebih tinggi dalam kelompok aditif pakan dibandingkan dengan kelompok kontrol, tetapi ada perbedaan dalam parameter pertumbuhan di antara kelompok eksperimen (Raissy et al., 2022 ). Perbedaan ini mungkin karena sekresi pencernaan dapat bervariasi dalam menanggapi ekstrak yang diterapkan pada dosis yang berbeda dalam makanan. Namun, dalam penelitian saat ini, tingkat FCR yang meningkat secara signifikan dalam kelompok ekstrak CP juga menunjukkan bahwa pemanfaatan pakan pada ikan dipengaruhi secara positif oleh peningkatan tingkat ekspresi pencernaan dibandingkan dengan kelompok C. Ekstrak herbal dapat meningkatkan aktivitas enzim pencernaan dengan mengatur sekresi empedu, yang memiliki fungsi penting dalam pencernaan dan penyerapan pakan (Adel et al., 2021 ; Bilen et al., 2020 ; Wangkahart et al., 2022 ). Peningkatan aktivitas enzim pencernaan pada ikan dengan cara ini terkait dengan keberadaan fenolik dan antioksidan alami dalam ekstrak tumbuhan yang merangsang enzim pencernaan. Ada penelitian yang menunjukkan bahwa ekstrak herbal dalam makanan meningkatkan aktivitas enzim pencernaan pada ikan trout pelangi dengan mekanisme aksi yang serupa (Adel et al., 2021 ; Bilen et al., 2020 ; Karataş et al., 2020 ; Wang et al., 2020)). Sesuai dengan data aktivitas enzim pencernaan yang ditingkatkan dari penelitian sebelumnya, ekspresi ikan trout pelangi yang terkait dengan pencernaan dapat ditingkatkan dengan menerapkan ekstrak CP ke dalam makanan. Namun, ekspresi gen yang meningkat mungkin tidak secara inheren menunjukkan peningkatan aktivitas enzimatik, daya cerna, atau penyerapan nutrisi. Perbedaan ini, yang dapat memisahkan perubahan transkripsi dari konsekuensi fungsional, sangat penting, karena transkripsi gen dapat dipengaruhi oleh faktor-faktor seperti modifikasi pasca-transkripsi, regulasi translasi, atau stabilitas protein (Vogel & Marcotte, 2012 ). Dengan demikian, meskipun peningkatan ekspresi gen yang diamati dapat menunjukkan tren potensial, penelitian di masa mendatang harus mencakup penilaian langsung aktivitas enzim pencernaan, daya cerna pakan, dan penyerapan nutrisi untuk memvalidasi hasil molekuler ini.
Hasil kami pada ekspresi gen antioksidan menunjukkan bahwa penggunaan ekstrak CP makanan meningkatkan kadar parameter CAT dan GPx di semua kelompok dibandingkan dengan kelompok C, kecuali kadar SOD pada kelompok CP1. Enzim antioksidan seperti SOD, CAT, dan GPx berperan dalam melindungi jaringan tubuh dari potensi kerusakan akibat stres oksidatif (Ghafarifarsani et al., 2022 ). Tanaman aromatik obat memiliki sifat antioksidan yang tinggi karena senyawa fenolik yang dikandungnya. Węglarz et al. ( 2022 ) menyarankan bahwa aktivitas antioksidan ekstrak CP mungkin disebabkan oleh kandungan fenoliknya, yang terutama terkait dengan rutoside dan asam klorogenat, yang diketahui sebagai antioksidan kuat. Sato et al. ( 2011 ) mengidentifikasi asam klorogenat sebagai polifenol dengan sifat antioksidan yang tinggi. Selain itu, pentingnya quercetin, yang digunakan sebagai senyawa referensi untuk mencegah proses oksidasi dalam industri makanan, telah ditekankan terkait dengan potensi antioksidan ekstrak CP (Kladar et al., 2015 ). Analisis yang dilakukan dalam lingkup studi saat ini menunjukkan bahwa senyawa fenolik yang disebutkan di atas terwakili pada tingkat tinggi dalam ekstrak CP. Ini dapat menjelaskan peningkatan yang diamati dalam ekspresi gen yang terkait dengan parameter antioksidan dalam kelompok ekstrak CP. Hasil serupa diperoleh oleh Elbesthi et al. ( 2020 ), yang menunjukkan bahwa penerapan ekstrak ribwort plantain ( Plantago lanceolata ), yang memiliki kandungan asam klorogenat yang tinggi, dapat meningkatkan enzim antioksidan pada ikan trout pelangi. Penelitian sebelumnya tentang ekstrak tanaman dengan kandungan fenolik tinggi yang digunakan sebagai suplemen pakan juga melaporkan efek positif pada enzim antioksidan pada ikan trout pelangi (Bilen et al., 2020 ; Elbesthi et al., 2020 ; Karataş et al., 2020 ; Salem et al., 2021 ; Yousefi et al., 2021 ).
Tingkat ekspresi gen lebih tinggi pada kelompok CP05 dan CP2 untuk parameter IL-1β dan pada kelompok CP1 dan CP2 untuk TNF-α dan IL-8, dibandingkan dengan kelompok C. Pertumbuhan dan ketahanan terhadap penyakit pada ikan diketahui terkait langsung dengan fungsi imun. Pencegahan penyakit juga dapat dicapai dengan meningkatkan respons imun. Imunitas pada ikan terkait erat dengan peradangan dan diatur oleh sitokin inflamasi (Shekarabi et al., 2021 ). Peradangan merupakan bagian integral dari respons imun bawaan, dan oleh karena itu, sitokin inflamasi dikenal luas sebagai biomarker penting dari status imun (Secombes et al., 2011 ). Sebagai sitokin pro-inflamasi, IL-1β terutama diproduksi oleh monosit dan makrofag, memfasilitasi proliferasi leukosit dan sekresi sitokin lainnya (Low et al., 2003 ). IL-8 adalah sitokin pro-inflamasi poten lain yang diproduksi sebagai respons terhadap stres oksidatif dan infeksi (Seppola et al., 2008 ). TNF-α, yang disintesis oleh berbagai sel, adalah sitokin multifungsi yang terlibat dalam apoptosis, aktivitas fagositosis, dan ekspresi sitokin pro-inflamasi lainnya (Krakauer et al., 1999 ). Interleukin seperti IL-1β dan IL-8 mengatur respons imun dan meningkatkan fagositosis dan proliferasi limfosit pada ikan dengan mendorong pelepasan sitokin lain seperti TNF-α (Baba et al., 2018 ). Ekstrak tanaman dapat memiliki efek imunostimulasi dengan meningkatkan ekspresi sitokin pro-inflamasi (IL-1β, TNF-α, dan IL-8). Beberapa penelitian telah melaporkan bahwa ekstrak tanaman makanan dapat meningkatkan tingkat ekspresi gen sitokin pro-inflamasi utama, TNF-α, IL-1β, dan IL-8 pada ikan (Ahmadifar et al., 2021 ). Dalam sebuah penelitian di mana ekstrak bunga dandelion ( Taraxacum officinale ) diuji pada dosis yang berbeda (1, 2, 3, dan 4 g kg −1 ) sebagai aditif pakan untuk ikan trout pelangi selama 56 hari, tingkat ekspresi gen IL-1β dan IL-8 meningkat pada semua kelompok eksperimen dibandingkan dengan kelompok kontrol (Shekarabi et al., 2021 ). Demikian pula, peningkatan tingkat ekspresi gen IL-1β dan IL-8 diamati pada ikan trout pelangi yang diberi makan makanan yang disuplemenkan dengan teh hijau ( Camellia sinensis ) (Nootash et al., 2013 ). Efek ekstrak tanaman ini diduga terjadi melalui komponen bioaktifnya (Reverter et al., 2017 ). Namun, penelitian sebelumnya telah menyoroti bahwa ekstrak tanaman dapat menghasilkan respons yang berbeda pada tingkat ekspresi gen tergantung pada dosis yang diberikan dalam makanan. Misalnya, meskipun memberi makan ikan trout pelangi dengan 0,1 g kg −1 caper bush ( Spinosa Capparis) selama 30 hari meningkatkan ekspresi gen IL-1β dan IL-8 dibandingkan dengan kelompok kontrol, hal itu tidak mempengaruhi ekspresi gen TNF-α (Bilen et al., 2016 ). Mirghaed et al. ( 2020 ) melaporkan bahwa peningkatan dosis ekstrak timi ( Zataria multiflora ) (1, 2, dan 3 g kg −1 ) dalam diet selama 60 hari menyebabkan peningkatan kadar ekspresi TNF-α pada ikan trout pelangi. Sebuah studi tentang efek ekstrak mint ( Mentha longifolia ) (1, 2, dan 3 g kg −1 ) sebagai aditif pakan untuk ikan trout pelangi selama 30 hari juga melaporkan efek positif dari peningkatan dosis pada ekspresi TNF-α dalam kelompok eksperimen (Heydari et al., 2020 ). Temuan dari studi-studi ini mendukung hasil dalam studi kami bahwa tidak ada perbedaan dalam kadar TNF-α pada kelompok CP05 dibandingkan dengan kontrol, tetapi kadar ekspresi yang lebih tinggi dicapai pada kelompok CP1 dan CP2. Temuan sebelumnya menunjukkan bahwa ekstrak tumbuhan menghasilkan efek paralel pada ekspresi gen imun dengan peningkatan dosis dalam pakan. Namun, dilaporkan juga bahwa peningkatan dosis ekstrak tumbuhan dalam makanan dapat memiliki efek supresif pada ekspresi gen imun. Misalnya, sebuah studi tentang efek ekstrak daun zaitun ( Olea europea L.) sebagai aditif pakan untuk ikan trout pelangi pada tingkat yang berbeda (0,1%, 0,25%, 0,50%, dan 1,0%) menemukan bahwa ekspresi gen TNF-α, IL-1β, dan IL-8 lebih tinggi pada kelompok 0,1% dibandingkan dengan kontrol, tetapi lebih rendah pada kelompok eksperimen lainnya (Baba et al., 2018 ). Studi sebelumnya menunjukkan bahwa komponen bioaktif dan dosis aplikasi ekstrak tumbuhan sebagai aditif pakan secara signifikan mempengaruhi respons imun pada ikan. Perlu dicatat bahwa hasil kami juga menunjukkan respons yang berbeda tergantung pada dosis yang diberikan antara ekstrak CP dan diet kontrol. Namun, ekspresi sitokin pro-inflamasi yang umumnya meningkat dalam kelompok suplemen pakan dapat dianggap sebagai hasil dari mekanisme respons imun yang disebabkan oleh aplikasi ekstrak CP sebagai aditif. Hasil ini kemungkinan menunjukkan efek stimulasi senyawa fenolik dalam ekstrak CP pada ekspresi gen sitokin pro-inflamasi dalam sel imun. Oleh karena itu, secara keseluruhan, hasil kami menunjukkan bahwa ekstrak CP diet telah meningkatkan ekspresi gen imun pro-inflamasi pada ikan trout pelangi, yang berkontribusi pada proliferasi sel yang terstimulasi imun.
5 KESIMPULAN
Kesimpulannya, ekstrak CP dalam makanan memiliki efek potensial pada kinerja pertumbuhan dan ekspresi gen yang terkait dengan enzim pencernaan, imunitas, dan faktor antioksidan pada ikan trout pelangi. Berdasarkan data tersebut, diet ikan trout pelangi dapat dioptimalkan untuk pertumbuhan yang sehat, yang menunjukkan penggunaan ekstrak CP dalam makanan (0,5 g kg −1 ). Namun, penelitian lebih lanjut diperlukan mengenai mekanisme spesifik yang digunakan komponen CP untuk meningkatkan kinerja budidaya ikan.



