ABSTRAK
Tuna mata besar ( Thunnus obesus ) adalah salah satu spesies tuna paling berharga yang menopang perikanan di seluruh dunia. Namun, informasi tentang kebiasaan makan untuk spesies ini sebagian besar terbatas pada kisaran ukuran yang dipanen oleh perikanan komersial. Dalam studi ini, kami melaporkan komposisi makanan tuna mata besar muda yang berkelompok di dekat permukaan pada malam hari di wilayah samudra Samudra Atlantik barat daya. Kami menggabungkan informasi makanan jangka pendek yang diperoleh dari analisis isi perut ( n = 14) dengan informasi makanan terintegrasi waktu dari analisis isotop stabil karbon (δ 13 C) dan nitrogen (δ 15 N) ( n = 8) untuk mengkarakterisasi komposisi makanan dan memperkirakan posisi trofik (TP bulk ) individu. Indeks kepentingan relatif spesifik mangsa (%PSIRI) menunjukkan bahwa Teleostei (79,1%) adalah takson yang paling penting, diikuti oleh Cephalopoda (7,6%) dan Crustacea (3,9%). Myctophidae adalah Teleostei yang paling sering dalam makanan (frekuensi kemunculan: 85,7%). Nilai δ 13 C pada jaringan otot tuna muda berkisar antara -18,6‰ hingga -17,4‰ (rata-rata ± SD: -18,1 ± 0,5‰) dan nilai δ 15 N berkisar antara 7,2‰ hingga 8,4‰ (rata-rata ± SD: 7,8 ± 0,3‰). Hasil TP massal (4,15 ± 0,47) menguatkan pola makan yang didasarkan pada ikan lentera dan pemangsaan terhadap cumi-cumi laut berukuran relatif kecil. Hasil kami mengatasi kesenjangan pengetahuan dengan menyoroti hubungan trofik penting untuk tuna mata besar sebelum mereka mencapai ukuran yang sesuai untuk dieksploitasi.
1 Pendahuluan
Tuna mata besar ( Thunnus obesus ) tersebar luas di perairan tropis dan subtropis di Samudra Atlantik, Hindia, dan Pasifik (Colette dan Nauen 1983 ; ICCAT 2006 ). Di Samudra Atlantik, ikan ini membentuk stok unik untuk tujuan pengelolaan (Duarte-Neto et al. 2012 ). Di Brasil, ikan ini menjadi objek eksploitasi oleh longline dan apa yang disebut perikanan “associated school” ( sensu Schroeder dan Castello 2007 ), dengan total tangkapan yang diizinkan sebesar 5639 ton per tahun. Spesies ini mendiami perairan terbuka di lapisan epipelagik dan mesopelagik dan hidup pada suhu optimum antara 17°C dan 22°C (Colette dan Nauen 1983 ). Ikan ini mampu bertahan pada konsentrasi oksigen rendah dibandingkan dengan tuna lainnya (Bernal et al. 2017 ). Distribusi vertikal dipengaruhi oleh kedalaman lapisan hamburan dalam dan suhu (Maury 2005 ), tetap berada dalam lapisan permukaan pada malam hari, dan menyelam hingga kedalaman 500 m pada siang hari (Brill et al. 2005 ; Dagorn et al. 2000 ; Gunn dan Block 2001 ).
Tuna adalah predator yang lincah dan oportunistik yang memakan berbagai jenis ikan, cumi-cumi, dan krustasea berukuran sesuai untuk makanannya (Colette dan Nauen 1983 ; Olson et al. 2016 ; Duffy et al. 2017 ). Sebagian besar mangsa yang dikonsumsi oleh tuna mata besar melakukan migrasi harian dan dapat dimangsa baik di dekat permukaan maupun di perairan dalam (Vaske et al. 2012 ; Logan et al. 2013 ). Meskipun relevan bagi perikanan, informasi tentang makanan tuna sangat langka di Atlantik barat daya, terutama untuk ikan kecil yang kurang tersedia dari perikanan komersial.
Analisis isi lambung telah digunakan secara luas untuk menggambarkan kebiasaan makan tuna (misalnya, Hyslop 1980 ; Ankenbrandt 1985 ). Keuntungan utamanya adalah kemungkinan untuk mengidentifikasi spesies mangsa yang dikonsumsi. Namun, informasi ini dibatasi untuk jangka waktu antara 12–24 jam sebelum pengambilan sampel (misalnya, Olson dan Boggs 1986 ). Teknik lain, seperti analisis isotop stabil karbon (δ 13 C) dan nitrogen (δ 15 N), dapat memberikan informasi terintegrasi waktu dari makanan yang diasimilasi, dalam skala waktu mulai dari bulan hingga tahun (Pinnegar dan Polunin 1999 ; Martinez del Rio et al. 2009 ; Madigan et al. 2012 ). Oleh karena itu, kombinasi teknik ini berguna untuk mempelajari ekologi makan tuna.
Dalam penelitian ini, kami bertujuan untuk mendeskripsikan komposisi makanan dan memperkirakan posisi trofik tuna bigeye muda Thunnus obesus yang ditangkap secara oportunistik di Samudra Atlantik barat daya. Kami menggabungkan analisis isi perut dan analisis isotop stabil δ 13 C dan δ 15 N dari individu muda yang berkelompok di malam hari di lereng benua (kedalaman ~1500 m).
2 Bahan dan Metode
2.1 Area Studi dan Pengambilan Sampel
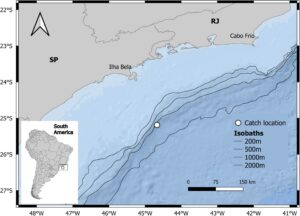
Daerah kajian dipengaruhi oleh Arus Brasil yang mengalir ke selatan, yang mengangkut Air Tropis oligotrofik yang hangat. Produktivitas ditingkatkan oleh arus naik Air Tengah Atlantik Selatan, yang didorong oleh angin di dekat Cabo Frio dan oleh pusaran frontal di sepanjang patahan landas kontinen (Castro dan Miranda 1998 ; Acha et al. 2004 ).
Pengambilan sampel individu mematuhi Sistem Otorisasi dan Informasi Brasil untuk Keanekaragaman Hayati dari Kementerian Lingkungan Hidup (Lisensi Tetap untuk pengumpulan materi zoologi #11531-1). Sampel diperoleh menggunakan kail dan tali dengan umpan buatan pada malam hari, pada bulan Agustus 2023 (Gambar 1 ). Kami menggunakan karakteristik morfologi untuk mengonfirmasi identitas spesies (ICCAT 2006 ; Itano 2005 ). Ikan diukur untuk panjang garpu lurus (FL, cm) dan ditimbang menggunakan dinamometer digital (g). Sampel dipisahkan ke dalam kategori ukuran 2,5 cm untuk memetakan distribusi ukuran sampel. Individu diklasifikasikan sebagai juvenil mengikuti FL kematangan pertama (L 50 = 107,8 cm; Zhu et al. 2010 ). Model pertumbuhan menunjukkan bahwa individu hingga 40 cm FL kemungkinan muda-tahunan (Duarte-Neto et al. 2012 ). Jaringan otot putih dikeluarkan dari bagian punggung dan disimpan dalam keadaan beku di dalam tabung Eppendorf yang diberi label. Kemudian, ikan dikeluarkan isi perutnya, dikeluarkan dan ditutup rapat. Untuk mencegah pencernaan mangsa, kami menyuntikkan formalin yang dinetralkan (10%) ke dalam perut.
2.2 Analisis Isi Lambung
Di laboratorium, lambung dipindahkan dari formalin dan disimpan dalam alkohol (70%) selama minimal 1 minggu. Kemudian, berat total setiap lambung diperoleh (g). Jenis mangsa disortir, dihitung, ditimbang, dan diidentifikasi hingga takson serendah mungkin dengan mengikuti panduan identifikasi untuk ikan, zooplankton, dan moluska dari Samudra Atlantik barat daya (misalnya, Figueiredo dan Menezes 1980 ; Boltovskoy 1999 ; Santos dan Figueiredo 2008 ; Haimovici et al. 2009 ; Sutton et al. 2020 ). Ketika hanya paruh sefalopoda yang ditemukan di lambung, spesies diidentifikasi dari panduan bergambar paruh sefalopoda yang ditemukan di lepas pantai Atlantik barat daya (Santos 1999 ; Santos dan Haimovici 2000 ).
Pentingnya mangsa dievaluasi melalui Indeks Kepentingan Relatif Spesifik Mangsa (%PSIRI) dan analisis grafis yang diusulkan oleh Brown et al. ( 2012 ). Kami menghitung frekuensi kemunculan ( %FOi) mangsa i sebagai jumlah perut yang berisi mangsa i dibagi dengan jumlah total perut. %PNi dan %PWi adalah kelimpahan spesifik mangsa, dihitung sebagai jumlah proporsi berdasarkan jumlah dan berat mangsa i dibagi dengan jumlah perut tempat mangsa i muncul (Brown et al. 2012 ).
2.3 Analisis Isotop Stabil
Jaringan otot putih dicairkan, dicuci dengan air suling, dikeringkan beku (48 jam), dan dihaluskan menggunakan lumpang dan alu. Serbuk yang telah dihomogenkan ditempatkan dalam kapsul timah (0,5–0,7 μg) dan dikirim ke Centro Integrado de Análises –CIA/FURG untuk dianalisis oleh penganalisis unsur yang digabungkan dengan spektrometer massa rasio isotop (EA Flash 2000 Delta V Advantage e TC/EA, ThermoFisher Scientific). Nilai isotop dilaporkan dalam notasi δ sebagai δX = [(R sampel /R standar ) − 1] × 1000, di mana X adalah 13 C atau 15 N dan R adalah rasio antara 13 C/ 12 C atau 15 N/ 14 N (Peterson dan Fry 1987 ). Standar yang diterima secara internasional untuk δ 13 C dan δ 15 N adalah Vienna Pee Dee Belemnite (V-PDB) dan atmosfer N 2 , masing-masing. Tiga sampel memiliki rasio CN > 3,5, yang menunjukkan potensi bias pada nilai δ 13 C (Post et al. 2007 ). Nilai δ 13 C ini dinormalisasi secara matematis mengikuti persamaan spesifik jaringan-taksa sebagai: δ 13 C′ − δ 13 C = P − (P × F/C:N), di mana P dan F masing-masing mewakili diskriminasi protein-lipid δ 13 C dan C:N bebas lipid (P = 7,489 ± 0,1439; F = 3,097 ± 0,0138) seperti yang dilaporkan untuk tuna sirip biru Atlantik Thunnus thynnus (Logan et al. 2008 ).
Akhirnya, kami menggunakan paket Bayesian “tRophic Position” (Quezada-Romegialli et al. 2022 ) untuk memperkirakan posisi trofik (TP) dalam R (R Core Team 2023 ). Kami menggunakan model “Onebaseline” dan menerbitkan nilai δ 15 N untuk copepoda yang diambil sampelnya di area lepas pantai di Samudra Atlantik barat daya (Troina et al. 2020 ) sebagai proksi untuk garis dasar isotop ( copepoda δ 15 N = 1,3 ± 2,0‰, n = 16). TP dasar untuk copepoda (λ = 2,2) dan nilai faktor diskriminasi trofik (TDF) untuk ikan ammoniotelik laut (Δ 15 N: 3,66 ± 1,85‰) diterapkan dalam model kami mengikuti Coletto et al. ( 2022 ), yang memperkirakan TP untuk ikan cakalang ( Katsuwonus pelamis ) untuk berbagai kelas ukuran. Kami juga membuat estimasi TP alternatif dengan nilai TDF yang dilaporkan dalam Vanderklift dan Ponsard ( 2003 ) (Δ 15 N = 2,4‰) dan Madigan et al. ( 2012 ) (Δ 15 N = 1,8 ± 0,4‰). Model dijalankan dengan 4 rantai dan 20.000 adaptasi. Hasil TP dilaporkan sebagai mean ± simpangan baku, dan interval kredibel dari distribusi posterior TP.
3 Hasil
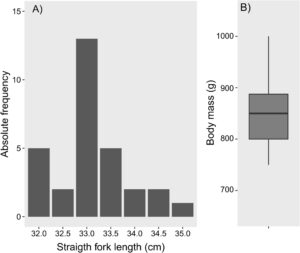
Panjang garpu lurus untuk tuna mata besar remaja berkisar antara 32,0 hingga 35,0 cm (rata-rata ± SD: 32,2 ± 8,0 cm; n = 30; Gambar 2A ). Massa tubuh total berkisar antara 750 hingga 1000 g (rata-rata ± SD: 850,0 ± 67,9 g; Gambar 2B ).
Dari 14 lambung yang dianalisis, 13 lambung berisi makanan dan satu lambung kosong. Delapan belas jenis makanan diidentifikasi (Tabel 1 ). Takson terpenting dalam makanan adalah Teleostei (%PSIRI = 79,1), diikuti oleh Cephalopoda (%PSIRI = 7,6) dan Crustacea (%PSIRI = 3,9). 10 jenis mangsa teratas untuk tuna mata besar muda, berdasarkan %PSIRI, ditunjukkan pada Gambar 3 .
| Kelas | Memesan | Keluarga | Jenis | %FO | %PN | %N | %PW | %W | %PSIRI |
|---|---|---|---|---|---|---|---|---|---|
| Crustacea | 42.9 | 24.5 | 10.5 | 3.1 | 0.9 | 3.9 | |||
| Amfipoda | Burung Hiperidae | Spesies: Hyperiidae | 7.1 | 7.7 | 0.5 | 0.0 | 0.2 | 0.3 | |
| Dekapoda | Solenoceridae | Pleoticus muelleri | 7.1 | 9.7 | 0.7 | 2.0 | 0.1 | 0.4 | |
| Isopoda | Isopoda yang tidak teridentifikasi | 35.7 | 26.0 | 9.3 | 2.5 | 0.5 | 3.1 | ||
| Tulang rusuk | 92.9 | 81.6 | 75.8 | 88.7 | 82.3 | 79.1 | |||
| Teleostei Tak Dikenal | Tidak teridentifikasi | 28.6 | 46.3 | 13.2 | 25.5 | 14.6 | 20.5 | ||
| Burung pipit | Burung Myctophidae | 85.7 | 71.3 | 61.1 | 78.5 | 67.3 | 64.2 | ||
| Benthosema suborbitale | 7.1 | 6.7 | 0.5 | 2.4 | 0.2 | 0.3 | |||
| Diaphus sp. | 7.1 | 14.3 | 1.0 | 14.7 | 1.1 | 1.0 | |||
| Bunga Hygophum hygomii | 7.1 | 3.2 | 0.2 | 3.0 | 0.2 | 0.2 | |||
| Hygophum macrochir | 7.1 | 4.0 | 0.3 | 13.4 | 1.0 | 0.6 | |||
| Hygophum sp. | 14.3 | 10.1 | 1.4 | 9.4 | 1.3 | 1.4 | |||
| Afinitas Myctophum | 21.4 | 30.0 | 6.4 | 33.6 | 7.2 | 6.8 | |||
| Myctophum asperum | 7.1 | 4.0 | 0.3 | 6.7 | 0.5 | 0.4 | |||
| Myctophum obtusirostre | 28.6 | 15.8 | 4.5 | 17.2 | 4.9 | 4.7 | |||
| Tidak teridentifikasi | 78.6 | 59.1 | 46.5 | 64.8 | 50.9 | 48.7 | |||
| Burung pipit Aulopiformes | Paralepididae | Tidak teridentifikasi | 14.3 | 9.9 | 1.4 | 3.5 | 0.5 | 1.0 | |
| Cephalopoda | 42.9 | 15.3 | 6.5 | 27.0 | 9.6 | 7.6 | |||
| Oegopsida | 42.9 | 15.3 | 6.5 | 27.0 | 9.6 | 7.6 | |||
| Enoploteuthidae | Abralia merah | 7.1 | 3.2 | 0.2 | 19.2 | 1.4 | 0.8 | ||
| Ommastrephidae | 35.7 | 17.7 | 6.3 | 29.0 | 8.3 | 6.7 | |||
| Tanaman liar Argentina | 7.1 | 7.7 | 0.5 | 51.3 | 3.7 | 2.1 | |||
| Ornitotheutis antillarum | 14.3 | 14.5 | 2.1 | 24.6 | 3.5 | 2.8 | |||
| Tidak teridentifikasi | 28.6 | 12.9 | 3.7 | 5.1 | 1.1 | 1.9 |
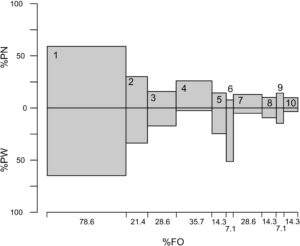
Dalam Teleostei, Myctophidae adalah famili yang paling umum (%FO = 85,7). Enam spesies yang termasuk dalam empat Genera Myctophidae telah diidentifikasi (Tabel 1 ). Mangsa utama dalam famili tersebut adalah Myctophum affine (%PSIRI = 6,8) dan M. obtisurostre (%PSIRI = 4,7). Selain Myctophidae, beberapa kejadian Paralepididae (%FO = 14,3) dan dua famili sefalopoda juga ditemukan. Ommastrephidae adalah yang paling umum (%FO = 35,7%) dan berkontribusi secara signifikan berdasarkan jumlah (% N = 17,7%). Dalam famili ini, dua spesies telah diidentifikasi: cumi-cumi burung Atlantik ( Ornitotheutis antillarum ) dan cumi-cumi sirip pendek ( Ilex argentinus ). Takson krustasea yang paling penting adalah Isopoda (%FO = 35,7), dengan kontribusi numerik yang signifikan (%PN = 26,0).
Nilai δ 13 C berkisar antara -18,5‰ hingga -16,2‰ (rata-rata ± SD: -17,6 ± 1,1‰). Nilai δ 15 N berkisar antara 7,2‰ hingga 8,4‰ (rata-rata ± SD: 7,8 ± 0,3‰). Rasio CN berkisar antara 3,2 hingga 4,3 (rata-rata ± SD: 3,7 ± 0,5). Posisi trofik (TP) yang diperkirakan untuk tuna mata besar muda adalah 4,15 ± 0,47 (interval kredibel 95%: 3,44–5,29). TP yang diperkirakan dengan nilai TDF yang lebih rendah semakin tinggi (Tabel 2 ).
| Δ 15 N (‰) | TP ± SD | Konsentrasi CI (2,5%–97,5%) |
|---|---|---|
| 3,7 ± 1,8 | 4,15 ± 0,47 | 3.44–5.29 |
| 2.4 | 4,99 ± 0,36 | 4.34–5.72 |
| 1,9 ± 0,4 | 5,65 ± 0,38 | 4.94–6.44 |
4 Diskusi
Studi kami melaporkan isi perut dan data isotop stabil untuk tuna mata besar muda di Atlantik barat daya. Hasil kami menunjukkan bahwa ikan lentera adalah mangsa penting bagi tuna mata besar muda. Ikan lentera termasuk dalam serikat zooplanktivora (Drazen dan Sutton 2017 ; Eduardo et al. 2021 ). Menghuni lautan terbuka, sebagian besar ikan lentera bermigrasi ke permukaan untuk mencari makan di malam hari, yang berfungsi sebagai makanan bagi predator pelagis (Eduardo et al. 2021 ). Di Samudra Atlantik barat daya, penilaian hidroakustik menunjukkan bahwa ekotipe “mesopelagik planktivora” memiliki distribusi yang mencolok di sepanjang lereng benua (Madureira et al. 2005 ). Di wilayah samudra dekat ~25° S tempat sampel kami ditangkap, kepadatan ikan lentera bervariasi antara 36 dan 144 ton/nm 2 (Madureira et al. 2005 ).
Untuk sefalopoda, kami mengidentifikasi jaringan lunak dari empat mangsa yang berbeda, tetapi hanya satu yang diidentifikasi hingga tingkat spesies (yaitu, Ornithotheutis antillarum ). Dalam kasus yang tersisa, spesies sefalopoda diidentifikasi dari paruh. Di lereng atas dan perairan laut yang berdekatan di Brasil Selatan, Ommastrephidae adalah famili sefalopoda yang paling penting dalam makanan predator pelagis, termasuk tuna (Santos dan Haimovici 2002 ; Coletto et al. 2022 ). Ornithotheutis antillarum adalah sefalopoda utama dalam makanan bigeye di Atlantik Tropis (Vaske et al. 2012 ). Ilex argentinus , Ommastrephes bartramii , O. antillarum , Lycoteuthis lorigera , dan Chiroteuthis veranii merupakan spesies yang sering ditemukan dalam isi perut tuna mata besar dewasa (Santos 1999 ; Santos dan Haimovici 2002 ).
Tidak ada penelitian tentang kebiasaan makan tuna mata besar berukuran serupa untuk menyimpulkan pola makan regional, karena sebagian besar informasi tersedia untuk orang dewasa (Gorni et al. 2013 ; Satoh et al. 2004 ; Vaske et al. 2012 ). Dalam penelitian ini, kami bertujuan untuk mengatasi ukuran sampel kecil untuk isi perut dengan mengintegrasikan analisis isotop stabil untuk mendapatkan wawasan jangka panjang tentang perilaku mencari makan tuna mata besar muda. Di selatan lokasi penelitian kami (30°–35° S), tuna mata besar kecil memiliki nilai δ 13 C (−16,5 ± 0,6‰) dan δ 15 N (10,2 ± 1,2‰) yang lebih tinggi daripada yang ada dalam penelitian kami (Bugoni et al. 2010 ). Ikan cakalang muda (FL: 38–47 cm) dari garis lintang yang sama memiliki nilai δ 13 C dan δ 15 N masing-masing sebesar −17,9 ± 0,2‰ dan 9,0 ± 1,2‰ (Coletto et al. 2021 ). Nilai δ 13 C yang serupa untuk ikan cakalang dan ikan mata besar yang dikumpulkan di area yang sama mungkin menunjukkan sumber basal serupa yang memicu jaring makanan pelagis di lepas pantai Atlantik barat daya. Ikan dewasa memiliki nilai δ 15 N 2‰ lebih tinggi daripada ikan yang lebih kecil (Bugoni et al. 2010 ), yang menunjukkan kemungkinan peningkatan TP seiring dengan peningkatan ukuran spesies tuna (misalnya, Pethybridge et al. 2018 ; Coletto et al. 2022 ).
Perkiraan TP kami untuk bigeye (TP bulk = 4,2) lebih tinggi daripada skipjack muda (TP bulk = 3,5). Skipjack muda banyak memakan krill (Coletto et al. 2022 ), mangsa dengan TP yang relatif lebih rendah yang tidak ditemukan di perut bigeye dalam penelitian kami. Oleh karena itu, nilai δ 15 N yang lebih rendah untuk bigeye dibandingkan dengan skipjack dengan ukuran yang sama mungkin terkait dengan komposisi makanan, dan juga dengan garis dasar δ 15 N yang meningkat di landas kontinen dan menurun di daerah lepas pantai di Atlantik barat daya (Troina et al. 2020 ). Skipjack tampaknya banyak mencari makan pada ikan lentera dan krill di landas kontinen (Coletto et al. 2021 ), sementara bigeye muda yang diambil sampelnya dalam penelitian kami sebagian besar memakan ikan lentera dan sefalopoda di perairan laut di lereng benua.
Estimasi TP sensitif terhadap nilai TDF, dan kami mengasumsikan TDF yang lebih tinggi dibandingkan dengan yang dilaporkan untuk tuna sirip biru Pasifik (yaitu, Δ 15 N = 1,8‰; Madigan et al. 2012 ) dan yang diasumsikan dalam penelitian lain pada spesies tuna (yaitu, Δ 15 N = 2,4‰, Pethybridge et al. 2018 ). Selain itu, kami mengasumsikan TP yang cukup rendah untuk copepoda (TP = 2,2) yang digunakan sebagai proksi dasar δ 15 N. Meskipun demikian, TP mendekati 4 tampaknya konsisten untuk bigeye muda tahun ini dalam penelitian kami, karena mereka sebagian besar memakan ikan lentera (yaitu, tingkat trofik 3), dan parameter TP seperti yang diadopsi dalam penelitian kami selanjutnya divalidasi dengan kumpulan data isi perut yang luas dan dengan analisis asam amino δ 15 N untuk tuna cakalang di Samudra Atlantik Barat Daya (Coletto et al. 2022 ).
Studi diet yang dilakukan dari sampel yang diperoleh dari perikanan tuna komersial (misalnya, longline, bait boat) dapat menimbulkan bias karena konsumsi umpan selama penangkapan (misalnya, Logan et al. 2013 ; Ankenbrandt 1985 ; Romero et al. 2021 ; Coletto et al. 2021 ). Kami menggunakan umpan buatan untuk pengambilan sampel, dan semua makanan dianggap sebagai mangsa alami. Meskipun ukuran sampel terbatas, hasil kami akan berkontribusi untuk mengisi kesenjangan dalam pemahaman kita tentang kebiasaan makan tuna mata besar muda sebelum mereka mencapai ukuran yang sesuai untuk ditangkap.



