Abstrak
Tepung ikan (FM) masih diyakini sebagai sumber protein standar emas, terutama untuk spesies akuakultur bernilai tinggi seperti salmon. Namun, karena fluktuasi pasokan dan harga, ditambah dengan masalah lingkungan dalam produksi FM, FM tidak lagi menjadi sumber yang berkelanjutan dari perspektif ekonomi dan lingkungan. Baru-baru ini, produk sampingan jagung berprotein tinggi, seperti biji-bijian kering penyulingan protein tinggi (HP-DDG) dan protein fermentasi jagung (CFP) telah menarik banyak perhatian sebagai bahan protein alternatif. Oleh karena itu, uji coba pemberian pakan selama 12 minggu dilakukan untuk menilai produk CFP pada kinerja pertumbuhan, pemanfaatan pakan, respons imun antioksidan dan non-spesifik, dan histopatologi usus sebagai pengganti FM dalam diet parr salmon Atlantik, Salmo salar . Lima diet isonitrogen (51% protein kasar) dan isokalori (22,3 MJ kg −1 ) diformulasikan untuk menggantikan 0% (CFP 0 ), 25% (CFP 25 ), 50% (CFP 50 ), 75% (CFP 75 ), dan 100% (CFP 100 ) FM dengan jumlah CFP yang sesuai. Diet eksperimental diberikan sampai kenyang, tiga kali sehari, untuk memperbanyak empat kelompok parr salmon Atlantik (11,6 ± 0,06 g). Pada akhir uji pemberian makan 12 minggu, berat akhir, pertambahan berat, dan kelangsungan hidup ikan tidak berbeda secara signifikan antara kelompok perlakuan. Namun, pada ikan yang diberi CFP100, baik rasio konversi pakan (FCR) dan rasio efisiensi protein (PER) menunjukkan perbedaan yang signifikan dibandingkan dengan ikan yang diberi perlakuan lain, dengan FCR secara signifikan lebih tinggi dan PER secara signifikan lebih rendah. Regresi kuadratik PER dan FCR terhadap tingkat inklusi CFP makanan menunjukkan bahwa tingkat substitusi optimal adalah antara 18,6% dan 25%. Parameter yang terkait dengan respons imun antioksidan dan non-spesifik tidak terpengaruh secara signifikan oleh perlakuan makanan kecuali untuk aktivitas lisozim. Aktivitas lisozim menunjukkan peningkatan yang signifikan pada ikan yang diberi makan CFP 25 dibandingkan dengan ikan yang diberi makan CFP 75. Sehubungan dengan morfologi usus distal, ikan yang diberi makan CFP 0 dan CFP 25 menunjukkan tinggi lipatan yang secara signifikan lebih tinggi, sementara ikan yang diberi makan CFP 50 menunjukkan pengurangan tinggi lipatan. Skor rata-rata fitur histopatologi yang dievaluasi tidak dipengaruhi secara signifikan oleh tingkat CFP makanan. Sebagai kesimpulan, berdasarkan hasil analisis varians (ANOVA), penggantian 50% FM dengan CFP dapat diterapkan tanpa efek merugikan pada kinerja pertumbuhan, pemanfaatan pakan, imunitas non-spesifik, dan kesehatan usus selama fase parr produksi salmon Atlantik.
1. PENDAHULUAN
Akuakultur telah menjadi penting dalam keamanan dan pasokan pangan global, secara signifikan mempersempit kesenjangan pasokan-permintaan, dengan proyeksi yang menunjukkan peningkatan 15% dalam produksi pangan akuatik pada tahun 2030 (FAO, 2022 ). Secara luas diyakini bahwa pertumbuhan ini akan dipenuhi terutama oleh produksi akuakultur. Selama beberapa tahun terakhir, peningkatan produksi akuakultur global telah mendorong harga tepung ikan (FM) karena permintaan untuk pakan akuakultur terus melonjak. FM masih dianggap sebagai bahan protein standar emas, terutama untuk spesies akuakultur bernilai tinggi seperti salmon, mengingat komposisi asam amino yang seimbang, palatabilitas yang luar biasa, dan daya cerna. Namun, penyertaannya dalam pakan akuakultur telah menurun karena fluktuasi harga yang disebabkan oleh ketersediaan yang tidak dapat diprediksi dan kekhawatiran mengenai keberlanjutan aspek lingkungan dan ekologi dari produksi FM (FAO, 2022 ). Karena alasan ini, telah dikemukakan bahwa penggunaan FM dalam pakan akuakultur tidak lagi menjadi sumber yang berkelanjutan dari perspektif ekonomi dan lingkungan (Tacon & Metian, 2008 ). Dengan demikian, pengembangan bahan pakan berkelanjutan tetap penting bagi sistem pangan global untuk menggantikan FM dengan bahan-bahan yang hemat biaya dengan dampak lingkungan minimal dan tidak menghambat pertumbuhan industri akuakultur.
Salmon Atlantik, Salmo salar adalah spesies ikan bernilai tinggi yang semakin digemari di pasar pangan global, dan hampir semua salmon Atlantik yang tersedia secara komersial telah dibudidayakan, dengan produksi meningkat lebih dari 1000% sejak tahun 1990 (MOWI, 2022 ). Namun, sementara FM secara progresif telah digantikan oleh alternatif lain, terutama protein yang berasal dari tumbuhan, dalam akuakultur salmon Atlantik, formulasi pakan untuk spesies ini masih sangat bergantung pada FM (Sørensen et al., 2016 ). Faktanya, banyak penelitian telah menunjukkan bahwa bahkan protein yang berasal dari tumbuhan yang digunakan dalam pengganti FM memiliki efek buruk dibandingkan dengan diet berbasis FM, termasuk penurunan laju pertumbuhan, asupan pakan, kecernaan nutrisi, dan kesehatan usus (Burr et al., 2013 ; Carter & Hauler, 2000 ; Egerton et al., 2020 ; Pratoomyot et al., 2010 ). Lebih jauh lagi, peningkatan berkelanjutan dalam penggunaan protein yang berasal dari tumbuhan menciptakan persaingan permintaan dan pasokan dengan sektor konsumsi manusia dan perdagangan internasional, yang meningkatkan biaya dan menimbulkan kekhawatiran tentang keberlanjutan lingkungannya (Matos et al., 2017 ). Oleh karena itu, pemanfaatan produk sampingan yang berasal dari operasi manufaktur dalam industri biofuel sebagai pengganti FM atau sumber protein berbasis tumbuhan menghadirkan alternatif yang menjanjikan yang ditandai dengan tidak adanya kekhawatiran terkait ini.
Administrasi Informasi Energi AS ( 2020 ) melaporkan bahwa produksi etanol yang berasal dari jagung di Amerika Serikat telah meningkat dari 6,1 miliar liter per tahun pada tahun 2000 menjadi lebih dari 56,8 miliar liter per tahun pada tahun 2019 dan diproyeksikan akan terus meningkat. Peningkatan produksi etanol, ditambah dengan hasil tinggi biji-bijian kering penyulingan dengan zat terlarut (DDGS), telah mengarahkan sektor nutrisi hewan untuk memanfaatkannya sebagai bahan pakan (Webster & Lim, 2006 ). DDGS, produk sampingan utama dari industri bioetanol, dengan cepat muncul sebagai pengganti baru untuk sumber protein yang berasal dari hewan dalam akuakultur karena harganya yang lebih rendah daripada FM dan kandungan protein kasar sedang (28%–32%), lemak (4%–9%), dan fosfor (7%–10%), tergantung pada asal biji-bijian. Studi telah menunjukkan bahwa DDGS cocok untuk penggantian sebagian FM pada krustasea dan berbagai spesies ikan (Diógenes et al., 2018 ; Gyan et al., 2022 ; Zhu et al., 2022 ). Namun, salah satu kelemahan DDGS yang membatasi penggunaannya dalam jumlah besar pada pakan akuatik adalah kandungan polisakarida nonpati yang tidak dapat dicerna yang tinggi, yang berdampak negatif pada pemanfaatan pakan pada ikan dan krustasea (Diógenes et al., 2019 ; Ray et al., 2022 ).
Dengan kemajuan terkini dalam ekstraksi lipid dan pemisahan polisakarida nonpati yang tidak dapat dicerna melalui fermentasi, bahan dasar jagung berprotein tinggi telah memasuki pasar pakan ternak. Salah satu produk tersebut, ProCap Gold (Marquis Procap LLC, Hennepin, Il, AS), dipasarkan sebagai protein fermentasi jagung (CFP) yang mengandung 52,0% protein (berat kering). Produk ini juga merupakan sumber lisin yang baik, 1,88% berat kering, jika dibandingkan dengan DDGS konvensional, dan dapat menjadi alternatif yang sesuai untuk FM dalam pakan akuakultur, yang mana protein merupakan komponen utamanya. Produk CFP ini baru-baru ini dievaluasi dalam diet ikan nila, Oreochromis niloticus dan salmon Atlantik, S. salar , dan ditemukan sebagai sumber protein alternatif yang menjanjikan untuk diet kedua spesies tersebut. Suehs dan Gatlin ( 2022 ) melaporkan bahwa produk ini berfungsi sebagai sumber protein yang cocok untuk pakan ikan nila Nil, menggantikan FM dan bungkil kedelai hingga 37,5% dari total protein makanan dengan koefisien kecernaan protein yang tinggi (83,1%), mungkin karena kandungan polisakarida non-pati yang lebih rendah. Baru-baru ini, Hossain et al. ( 2023 ) menunjukkan dalam sebuah penelitian dengan salmon Atlantik bahwa CFP dapat digunakan secara efektif sebagai pengganti bungkil kedelai tanpa mengorbankan pertumbuhan dan kesehatan ikan. Oleh karena itu, penelitian saat ini dirancang untuk menilai produk CFP (ProCap Gold) sebagai sumber protein alternatif untuk menggantikan FM dalam makanan salmon Atlantik terhadap pertumbuhan, pemanfaatan pakan, morfologi usus, dan kesehatan.
2 BAHAN DAN METODE
2.1 Perlakuan dan formulasi diet
Lima diet isonitrogen (51% protein kasar) dan isokalori (22,3 MJ kg −1 energi kotor) diformulasikan untuk menggantikan 0% (CFP 0 ), 25% (CFP 25 ), 50% (CFP 50 ), 75% (CFP 75 ), dan 100% (CFP 100 ) FM dengan jumlah CFP yang sesuai dan disiapkan dan diekstrusi pada ukuran 2,5 mm di Bozeman Fish Technology Center, Bozeman, MT. Untuk mempertahankan profil nutrisi yang seimbang, penyesuaian kecil dilakukan pada komponen bahan lainnya, termasuk makanan sampingan unggas, makanan gluten gandum, konsentrat protein jagung, makanan darah, dan tepung terigu. Modifikasi ini diperlukan untuk mengimbangi perbedaan kandungan protein, lipid, dan energi kotor yang dihasilkan dari penggantian FM sambil memastikan bahwa semua diet tetap sebanding secara nutrisi. Minyak ikan digunakan sebagai sumber lipid untuk memasok asam lemak esensial. DL-metionina dimasukkan ke dalam diet untuk mencapai kebutuhan metionina salmon Atlantik, sesuai dengan National Research Council (NRC, 2011 ). Taurina pada konsentrasi 0,5% ditambahkan secara merata ke semua diet eksperimental. Formulasi pakan, proksimat, dan komposisi asam amino dari diet eksperimental disajikan dalam Tabel 1 dan 2 , masing-masing. Produk CFP (ProCap Gold) disediakan oleh Marquis Energy, Hennepin, IL, AS. Komposisi proksimat produk CFP yang digunakan dalam penelitian saat ini adalah 8,3% air, 49,5% protein kasar, 12,7% lemak, 6,0% serat, dan 4,7% abu.
| Bahan-bahan | Pola makan | ||||
|---|---|---|---|---|---|
| CFP 0 | CFP 25 | CFP 50 | CFP 75 | CFP 100 | |
| Tepung ikan, ikan putih a | 40.00 | Rp 30.000 | pukul 20.00 | Jam 10.00 | 0.00 |
| CFP b | 0.00 | Jam 10.00 | pukul 20.00 | Rp 30.000 | 40.00 |
| Bungkil kedelai c | jam 8.00 | jam 8.00 | jam 8.00 | jam 8.00 | jam 8.00 |
| PBM, pakan kelas c | 4.00 | 7.50 | 10.50 | 12.50 | 13.50 |
| Tepung gluten gandum c | jam 8.00 | Jam 7.00 | Jam 6.00 | 5.00 | 5.00 |
| Konsentrasi protein jagung, 75% CP d | Jam 9.00 | jam 8.00 | Jam 7.00 | Jam 6.00 | 5.00 |
| Makanan darah c | 0.00 | 1.10 | 2.50 | 4.60 | 6.60 |
| Tepung terigu c | Tanggal 12.10 | Jam 11.30 | 10.60 | 9.60 | jam 8.00 |
| DL-metionina e | 0.00 | 0.00 | 0.00 | 0,09 | 0.10 |
| Monokalsium fosfat c | 0.00 | 0.00 | 0.00 | 0.51 | 1.60 |
| Taurin dan | 0,50 | 0,50 | 0,50 | 0,50 | 0,50 |
| Campuran Trace Mineral, Trouw f | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 |
| Premix vitamin, ARS 702 g | 1.00 | 1.00 | 1.00 | 1.00 | 1.00 |
| Kolin klorida h | 0,60 | 0,60 | 0,60 | 0,60 | 0,60 |
| Vitamin C stabil (35% ) | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
| Minyak ikan c | 16.50 | 14.70 | Jam 13.00 | Jam 11.30 | 9.80 |
| Komposisi (% berdasarkan yang diberikan) | |||||
| Bahan kering | 95.8 | 95.3 | 95.8 | 96.3 | 94.5 |
| Protein | 51.4 | 50.8 | 51.8 | 51.4 | 51.8 |
| Gemuk | 16.9 | 15.5 | 16.1 | 16.5 | 15.2 |
| Abu | 10.4 | 9.50 | 8.17 | Tanggal 7.07 | 5.48 |
| Energi kotor (MJ kg −1 ) | 22.1 | 22.0 | 22.5 | 22.8 | 22.3 |
Singkatan: CFP, protein fermentasi jagung.
SeaPro 75, BioOregon Protein, Inc., Warrenton, OR, AS (75% protein kasar, 8% lemak kasar).
b ProCap Gold (Marquis Energy, Hennepin, IL, AS).
c Makanan sampingan unggas, Rangen Inc., Buhl, ID, AS.
d Empyreal® 75, Penggilingan Jagung Cargill, Cargill, Inc., Blair, NE, AS.
e Sigma-Aldrich, St. Louis MO, AS.
f US Fish and Wildlife Service Trace Mineral Premix #3 menyediakan (mg kg −1 diet) berikut ini: Zn (sebagai ZnSO 4 ·7H 2 O), 75; Mn (sebagai MnSO 4 ), 20; Cu (sebagai CuSO 4 ·5H 2 O), 1,54; I (sebagai KIO 3 ), 10.
g Premiks vitamin diberikan per kg makanan berikut ini: vitamin A, 2,4 mg; vitamin D, 0,15 mg; vitamin E, 267 mg; vitamin K sebagai menadion natrium bisulfit, 20 μg; tiamin sebagai tiamin mononitrat, 32 mg; riboflavin, 64 mg; piridoksin sebagai piridoksin-HCl, 64 mg; asam pantotenat sebagai Ca-d-pantotenat, 192 mg; niasin sebagai asam nikotinat, 240 mg; biotin, 0,56 mg; asam folat, 12 mg; vitamin B12, 50 μg; dan inositol sebagai meso-inositol, 400 mg.
h Skretting AS, Tooele, UT, AS.
| Komposisi asam amino | Pola makan | ||||
|---|---|---|---|---|---|
| CFP 0 | CFP 25 | CFP 50 | CFP 75 | CFP 100 | |
| Arginin (Arg) | 2.90 | 2.86 | 2.75 | 2.70 | 2.69 |
| Sistein (Cys) | 0.40 | 0.45 | 0.46 | 0.44 | 0.56 |
| Histidin (His) | 1.30 | 1.41 | 1.49 | 1.66 | 1.86 |
| Isoleusin (Ile) | 2.11 | 2.09 | 1.97 | 1.89 | 1.85 |
| Leusin (Leu) | 4.55 | 4.72 | 4.82 | 5.07 | 5.43 |
| Lisin (Lys) | 3.20 | 2,99 | 2.75 | 2.66 | 2.58 |
| Metionina (Met) | 1.20 | 1.20 | 1.06 | 1.04 | 1.00 |
| Fenilalanin (Phe) | 2.46 | 2.52 | 2.54 | 2.61 | 2.75 |
| Treonin (Thr) | 2.05 | 2.01 | 1.92 | 1.93 | 1.94 |
| Triptofan (Trp) | 0.30 | 0.66 | 1.21 | 1.38 | 1.36 |
| Tirosin (Tyr) | 1.27 | 1.32 | 1.29 | 1.25 | 1.27 |
| Valin (Val) | 2.25 | 2.36 | 2.37 | 2.48 | 2.65 |
| Alanin (Ala) | 3.25 | 3.31 | 3.29 | 3.36 | 3.47 |
| Aspartat (Asp) | 4.23 | 4.22 | 4.10 | 4.17 | 4.24 |
| Glutamat (Glu) | 9.84 | 9.72 | 9.17 | 8.89 | 8.87 |
| Prolin (Pro) | 3.28 | 2.21 | 4.14 | 3.59 | 3.07 |
| Serin (Ser) | 2.34 | 2.40 | 2.36 | 2.41 | 2.49 |
| Taurin (Tau) | 0,78 | 0,78 | 0.71 | 0.66 | 0.63 |
Singkatan: CFP, protein fermentasi jagung.
2.2 Percobaan ikan dan pemberian pakan
Uji coba pemberian pakan dilakukan di Hagerman Fish Culture Experiment Station, Universitas Idaho di Hagerman (HFCES), ID. Benih ikan salmon Atlantik yang digunakan dalam penelitian ini dipelihara dari telur yang dibuahi yang bersumber dari USDA-ARS National Cold Water Marine Aquaculture Center di Orono, ME, AS. Ikan dipelihara hingga mencapai ukuran benih dan diaklimatisasi ke tangki 145 L, selama waktu itu mereka diberi diet komersial dengan 45% protein kasar dan 16% kandungan lipid dari Skretting, AS, selama 2 minggu sebelum dimulainya penelitian. Pada awal penelitian, parr salmon Atlantik dengan berat tubuh awal 11,6 ± 0,06 g didistribusikan secara acak ke dalam masing-masing dari dua puluh tangki 145 L, dengan 30 ikan di setiap tangki. Air pegas suhu konstan (15 °C) dipasok ke setiap tangki eksperimen dengan laju 8–10 L min −1 . Setiap pakan secara acak dimasukkan ke dalam empat tangki menggunakan rancangan acak lengkap. Ikan diberi pakan masing-masing secara manual hingga kenyang tiga kali sehari, 6 hari seminggu, selama 12 minggu. Fotoperiode dipertahankan pada 14 jam terang dan 10 jam gelap, dengan lampu neon yang dikontrol oleh pengatur waktu elektrik. Semua prosedur penanganan ikan dan protokol eksperimen yang digunakan dalam penelitian ini telah disetujui terlebih dahulu oleh Institutional Animal Care and Use Committee (IACUC-2022-39) di University of Idaho.
2.3 Pengambilan sampel
Pada akhir 12 minggu pemberian pakan, 24 jam pasca makan, semua ikan dihitung dan ditimbang secara individual untuk menentukan pertambahan berat (WG), rasio konversi pakan (FCR), dan persen kelangsungan hidup (SUR). Setelah penimbangan akhir, tiga ikan per tangki ( n = 12 ikan per diet) dipilih secara acak dan dibius menggunakan tricaine methanesulfonate (MS-222, 100 mg L −1 , pH buffer hingga 7,0). Kemudian, berat dan panjang setiap ikan diukur secara individual untuk menentukan faktor kondisi (CF). Sampel darah utuh kemudian diperoleh dari pembuluh darah ekor ikan menggunakan spuit heparin 1 mL yang dilengkapi dengan jarum 25G ¾ inci. Gas darah dan kimia diukur segera menggunakan kartrid i-STAT CG8+ (Laboratorium Abbot, Nepean, Kanada) dari setetes darah, dan sisa darah utuh disentrifugasi pada 1000 × g selama 10 menit untuk mengumpulkan plasma untuk alanine transaminase (ALT), aspartate aminotransferase (AST), antioksidan, dan uji imun non-spesifik. Selanjutnya, ikan tersebut di-eutanasia secara manusiawi menggunakan dosis mematikan MS-222 pada konsentrasi 300 mg L −1 , setelah itu usus distal dibedah untuk histopatologi. Hati dibedah dan ditimbang secara individual dari ikan yang sama untuk menghitung indeks hepatosomatik (HSI). Tiga ikan lainnya per tangki di-eutanasia dan disimpan pada suhu −20°C untuk analisis komposisi proksimat seluruh tubuh. Sampel jaringan dan plasma disimpan pada suhu −80°C hingga analisis lebih lanjut.
2.4 Analisis kimia dan asam amino
Analisis komposisi proksimat dan kandungan energi dilakukan pada pakan percobaan dan sampel ikan seluruh tubuh. Sampel ikan seluruh tubuh dikumpulkan berdasarkan tangki dan dihomogenisasi dengan prosesor makanan industri. Sampel dikeringkan dalam oven konveksi pada suhu 105°C selama 12 jam untuk menilai tingkat kelembapan, mengikuti pedoman yang ditetapkan oleh AOAC (Association of Official Analytical Chemists) ( 1995 ). Setelah proses pengeringan, sampel ditumbuk halus menggunakan lumpang dan alu, kemudian dilakukan analisis protein kasar (dihitung sebagai nitrogen total x 6,25) menggunakan metode pembakaran dengan penentu nitrogen (Elementar nitrogen analyzer, Ronkonkoma, NY). Analisis lipid kasar melibatkan hidrolisis asam sampel menggunakan ANKOM HCL (ANKOM Technology, Macedon, NY), diikuti dengan ekstraksi sampel menggunakan eter minyak bumi dengan ekstraktor ANKOM CT15. Kandungan abu ditentukan dengan membakar sampel pada suhu 550°C dalam tungku muffle selama 5 jam. Kandungan energi sampel dinilai menggunakan kalorimeter bom isoperibol (Parr 6300, Parr Instrument Company Inc., Moline, IL). Analisis asam amino untuk pakan dilakukan dengan menggunakan penganalisa asam amino Biochrom 30+ (Biochom Ltd., Cambridge, Inggris).
2.5 ALT, AST, antioksidan dan respon imun non-spesifik
Aktivitas ALT dan AST diukur menggunakan kit komersial yang dibeli dari Cayman Chemical (Ann Arbor, Michigan). Secara singkat, ALT dan AST dalam plasma diperkirakan dengan mengamati laju oksidasi NADH selama reaksi berpasangan dengan laktat dehidrogenase. Penurunan laju absorbansi dibaca pada 340 nm, yang berkorelasi langsung dengan aktivitas ALT dan AST dalam plasma.
Penilaian produksi radikal oksidatif oleh fagosit selama ledakan pernapasan melibatkan penggunaan uji nitro-blue tetrazolium (NBT) yang diuraikan oleh Anderson dan Siwicki ( 1995 ). Singkatnya, sampel darah utuh dicampur dengan NBT (0,2%) (Sigma-Aldrich, St. Louis, MO, AS) pada rasio 1:1 dan diinkubasi pada suhu kamar selama 30 menit. Setelah inkubasi, 50 μL campuran diambil dan ditempatkan ke dalam tabung gelas. Kemudian, 1 mL dimetilformamida (Sigma-Aldrich) dimasukkan ke dalam tabung gelas, diikuti dengan sentrifugasi pada 2000 × g selama 5 menit. Akhirnya, densitas optik dari supernatan yang dihasilkan dinilai pada 540 nm menggunakan pembaca mikroplat (Infinite m200 PRO, Tecan Trading AG, Swiss), dengan dimetilformamida digunakan sebagai blanko.
Aktivitas plasma superoksida dismutase (SOD) dan katalase (CAT) diukur pada suhu 25°C menggunakan kit yang tersedia secara komersial dari Cayman Chemical (Ann Arbor, Michigan). Aktivitas SOD ditentukan pada 450 nm melalui pemanfaatan xantin dan xantin oksidase untuk menghasilkan radikal superoksida. Aktivitas SOD dinilai berdasarkan laju penghambatan dalam reaksi ini. Satu unit aktivitas SOD sama dengan penghambatan 50% terhadap reduksi 2-(4-iodofenil)-3-(4nitrofenol)-5-feniltetrazolium klorida dalam kondisi percobaan.
Aktivitas CAT dinilai dengan mengamati pengurangan absorbansi H 2 O 2 pada 540 nm. Larutan reaksi, yang terdiri dari 50 mM buffer K-fosfat pada pH 6,5 dan 50 mM H 2 O 2 , selanjutnya diencerkan dalam 80 mM buffer K-fosfat pada pH 6,5. Perhitungan aktivitas dilakukan dengan menetapkan koefisien kepunahan untuk H 2 O 2 ( a = 40 M −1 cm −1 ). Aktivitas lisozim dalam plasma dievaluasi menggunakan Enzchek Lysozyme Assay kit (Thermo, AS). Singkatnya, 10 μL alikuot plasma dicampur dengan 40 μL buffer reaksi 1×, diikuti oleh inkubasi dengan 50 μL Micrococcus lysodeikticus yang diberi label dengan fluorescein selama 2 jam pada 37 °C. Fluoresensi dinilai pada panjang gelombang eksitasi/emisi 494/518 nm dengan pembaca mikroplat (Infinite m200 PRO, Tecan Trading AG). Aktivitas lisozim ditentukan dari kurva standar yang dihasilkan melalui pengenceran lisozim putih telur ayam.
2.6 Parameter biokimia darah
Sampel darah dinilai menggunakan i-STAT Portable Clinical Analyzer dan kartrid CG8+ (Laboratorium Abbott). Setelah darah lengkap terkumpul, jarum dilepaskan, dan setetes darah lengkap diteteskan ke kartrid CG8+. Selanjutnya, lubang kartrid ditutup rapat, dan kartrid dimasukkan ke dalam i-STAT Portable Clinical Analyzer. Kartrid CG8+ ini memberikan nilai natrium (Na, mmol L −1 ), kalium (K, mmol L −1 ), kalsium terionisasi (iCa, mmol L −1 ), glukosa (Glu, mg dL −1 ), hematokrit (Hct, % Packed Cell Volume [PCV]), pH, tekanan parsial karbon dioksida (pCO 2 , mm Hg), tekanan parsial oksigen (pO 2 , mm Hg), saturasi oksigen (sO 2 , %), hemoglobin (Hb, g dL −1 ), dan total karbon dioksida (tCO 2 , mmol L −1 ).
2.7 Penilaian histopatologi usus distal
Sampel usus distal, diawetkan dalam formalin buffer netral 10%, selanjutnya dipindahkan ke etanol 70% untuk diproses melalui prosedur histologis standar. Setelah diproses, sampel diwarnai dengan Hematoxylin & Eosin (H&E), setelah itu pengukuran fitur morfologi usus, termasuk tinggi lipatan usus, tinggi enterosit, dan ketebalan lamina propria, dilakukan. Sistem penilaian, mulai dari 1 hingga 5, digunakan untuk mengevaluasi peradangan usus dengan menilai fusi lipatan mukosa, jumlah sel goblet, vakuolisasi supranuklear, infiltrasi granulosit eosinofilik, ketebalan lamina propria, dan tampilan mukosa sub-epitel di usus. Sistem penilaian ini diadaptasi dari Urán et al. ( 2008 ). Saat nilai penilaian meningkat, hal itu mencerminkan tingkat peradangan usus yang lebih tinggi. Slide disiapkan di Bozeman Fish Health Center (Bozeman, MT, AS) dan dinilai di HFCES menggunakan mikroskop cahaya (Zeiss Axioscope A1, Carl Zeiss Ltd., Cambridge, Inggris). Evaluator tidak mengetahui penugasan pengobatan setelah pengacakan.
2.8 Perhitungan dan metode statistik
Indeks berikut dihitung sebagai berikut

Untuk analisis statistik kinerja pertumbuhan, pemanfaatan pakan, komposisi seluruh tubuh, kimia darah, dan data morfologi usus distal, nilai rata-rata tangki ( n = 4) dikenakan analisis varians satu arah (ANOVA) untuk mendeteksi perbedaan di antara perlakuan diet. Sebelum ANOVA, normalitas dan homogenitas varians diuji untuk semua data.
Jika ditemukan perbedaan yang signifikan, data tersebut akan diuji dengan uji Tukey’s HSD untuk memisahkan nilai tengah, dengan tingkat signifikansi yang ditetapkan pada p < 0,05. Semua analisis statistik dilakukan dengan menggunakan SPSS (Versi 21 untuk Window; IBM SPSS Inc., Chicago, IL, AS). Hasil histopatologi dinilai dengan menggunakan uji Kruskal–Wallis, diikuti dengan analisis post hoc Wilcoxon, karena data tidak memenuhi asumsi parametrik kenormalan. Selain itu, analisis tren menggunakan kontras polinomial ortogonal (linier dan/atau kuadrat) digunakan untuk menentukan respons terhadap tingkat inklusi CFP dalam makanan, dan data tersebut selanjutnya akan dianalisis dengan regresi.
3 HASIL
3.1 Kinerja pertumbuhan dan pemanfaatan pakan
Kinerja pertumbuhan ikan tidak menunjukkan pengurangan signifikan dengan mengganti FM dengan CFP ( p > 0,05) (Tabel 3 ). Kelangsungan hidup secara keseluruhan tinggi, di atas 95%, dan tidak ada perbedaan signifikan yang terdeteksi di antara kelompok perlakuan. Namun, FCR pada ikan yang diberi CFP 100 secara signifikan lebih tinggi daripada ikan yang diberi perlakuan lain ( p < 0,05), sementara tidak ada perbedaan signifikan yang diamati dalam asupan pakan ( p = 0,071). Demikian pula, PER secara signifikan lebih rendah pada ikan yang diberi CFP 100 dibandingkan dengan ikan yang diberi diet lain ( p < 0,05). Hasil lebih lanjut menunjukkan bahwa CF dan HSI tidak dipengaruhi secara signifikan oleh perlakuan diet. Namun, linear dan/atau tren signifikan diamati antara tingkat penyertaan CFP diet dan FI, FCR, PER, CF, dan HSI. Dengan meningkatnya penyertaan CFP diet, FCR dan PER menunjukkan model regresi kuadratik, seperti yang ditunjukkan pada Gambar 1 ; Analisis regresi kuadrat menunjukkan bahwa tingkat penggantian optimal adalah masing-masing 25,0% dan 18,6%. Kisaran FCR dan PER di semua kelompok makanan berada dalam nilai yang diinginkan.
| Pola makan | W i (g ikan −1 ) | W f (g ikan −1 ) | WG (g ikan −1 ) | FI (g ikan -1 ) | FCR | PER | SUR (%) | CF (%) | Indeks Harga Saham Gabungan (IHSG) |
|---|---|---|---|---|---|---|---|---|---|
| CFP 0 | 11.6 | 89.7 | 78.1 | 53.1 | 0,68c tahun | 2.85a | 96.7 | 1.10 | 0.86 |
| CFP 25 | 11.8 | 96.1 | 84.4 | 58.0 | 0,69 SM | 2.85a | 96.7 | 1.07 | 0,79 |
| CFP 50 | 11.5 | 88.0 | 76.6 | 53.2 | 0,69 SM | 2,76 inci | 95.0 | 1.08 | 0,77 |
| CFP 75 | 11.6 | 96.0 | 84.3 | 60.6 | 0,72b | 2,69 miliar | 95.0 | 1.02 | 0.83 |
| CFP 100 | 11.6 | 87.7 | 76.2 | 61.8 | 0.81a | 2,37c tahun | 97.5 | 1.06 | 0,85 |
| SEM gabungan | 0.127 | 2.820 | 2.840 | 2.160 | 0,006 | 0,027 | 0.812 | 0,025 | 0,043 tahun |
| ANOVA satu arah | 0,949 tahun | 0.209 | 0.231 | 0,071 tahun | 0.000 | 0.000 | 0,278 | 0.103 | 0,259 |
| Kontras polinomial ortogonal | |||||||||
| Linier | 0,532 | 0,695 tahun | 0.719 | 0,022 | 0.000 | 0.000 | 0,974 tahun | 0,050 | 0.826 |
| Kuadrat | 0.791 | 0.290 | 0.294 | 0.610 | 0.000 | 0.000 | 0,078 tahun | 0.363 | 0,044 tahun |
| Regresi | |||||||||
| Model | – | – | – | Linier | Kuadrat | Kuadrat | – | Linier | Kuadrat |
| R 2 | 0.254 | 0.899 | 0.908 | 0.190 | 0.234 | ||||
| Nilai p | 0,024 | 0.000 | 0.000 | 0,055 | 0.104 | ||||
Singkatan: ANOVA, analisis varians; CF, faktor kondisi; CFP, protein fermentasi jagung; FCR, rasio konversi pakan; FI, asupan pakan; HSI, indeks hepatosomatik; PER, rasio efisiensi protein; SUR, kelangsungan hidup; W f , berat akhir; W i , berat awal; WG, pertambahan berat badan.
a Nilai disajikan sebagai rata-rata ( n = 4). Nilai dengan huruf yang sama atau tidak ada huruf yang sama tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).

3.2 Komposisi proksimal seluruh tubuh
Seperti yang ditunjukkan pada Tabel 4 , mengganti FM dengan CFP tidak menghasilkan perbedaan signifikan pada tingkat kelembaban seluruh tubuh (70,9 ± 0,16), protein kasar (17,0 ± 0,10), lipid kasar (10,1 ± 0,17), abu (2,20 ± 0,03), dan energi kotor (27,2 ± 0,09, MJ kg −1 ) (dinyatakan sebagai % dari berat basah kecuali energi kotor). Protein kasar menurun secara linear ( p = 0,031) dengan meningkatnya tingkat CFP.
| Pola makan | Kelembaban (%) | Protein (%) | Lipid (%) | Abu (%) | Energi (MJ kg −1 ) |
|---|---|---|---|---|---|
| CFP 0 | 70.7 | 17.4 | 10.3 | 2.18 | 27.1 |
| CFP 25 | 71.2 | 17.1 | 9.71 | 2.18 | 27.0 |
| CFP 50 | 70.8 | 17.1 | 9.97 | 2.23 | 27.2 |
| CFP 75 | 70.9 | 16.7 | 10.1 | 2.24 | 27.3 |
| CFP 100 | 70.8 | 16.8 | 10.2 | 2.19 | 27.3 |
| SEM gabungan | 0,388 | 0.202 | 0.404 | 0,079 tahun | 0.202 |
| ANOVA satu arah | 0.894 | 0.212 | 0.872 | 0,972 tahun | 0.651 |
| Kontras polinomial ortogonal | |||||
| Linier | 0,970 | 0,031 | 0.852 | 0,769 tahun | 0,255 |
| Kuadrat | 0,549 tahun | 0,565 tahun | 0.426 | 0.656 | 0,973 tahun |
| Regresi | |||||
| Model | – | Linier | – | – | – |
| R 2 | 0.263 | ||||
| Nilai p | 0,021 | ||||
Singkatan: ANOVA, analisis varians; CFP, protein fermentasi jagung.
a Nilai-nilai disajikan sebagai rata-rata ( n = 4). Nilai-nilai tanpa alfabet tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).
3.3 ALT, AST, antioksidan dan respon imun non-spesifik
ALT, AST, antioksidan, dan parameter imun non-spesifik yang dinilai dalam penelitian ini tidak dipengaruhi secara signifikan oleh penambahan CFP kecuali aktivitas lisozim (Tabel 5 dan 6 ). Aktivitas lisozim secara signifikan lebih tinggi pada ikan yang diberi CFP 25 dibandingkan dengan ikan yang diberi CFP 75 ( p < 0,05). Tren linear ditemukan antara kadar CFP dalam makanan dan aktivitas lisozim.
| Pola makan | ALT | Bahasa Inggris |
|---|---|---|
| CFP 0 | 12.1 | 26.7 |
| CFP 25 | 14.7 | 21.4 |
| CFP 50 | 10.2 | 24.0 |
| CFP 75 | 11.3 | 25.9 |
| CFP 100 | 14.0 | 29.8 |
| SEM gabungan | 3.347 | 2.255 |
| ANOVA satu arah | 0.863 | 0,158 |
| Kontras polinomial ortogonal | ||
| Linier | 0,974 tahun | 0.153 |
| Kuadrat | 0.658 | 0,053 |
| Regresi | ||
| Model | – | Kuadrat |
| R 2 | 0.293 | |
| Nilai p | 0,052 | |
Singkatan: ALT, aktivitas alanin transaminase (U L −1 ); ANOVA, analisis varians; AST, aspartat transaminase (U L −1 ); CFP, protein fermentasi jagung.
a Nilai-nilai disajikan sebagai rata-rata ( n = 4). Nilai-nilai tanpa alfabet tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).
| Pola makan | Tidak ada komentar: | MERUMPUT | KUCING | LIS |
|---|---|---|---|---|
| CFP 0 | 0,50 | 2.94 | 57.2 | 402ab |
| CFP 25 | 0,58 | 3.20 | 66.4 | 422a |
| CFP 50 | 0.67 | 3.05 | 56.5 | 381ab |
| CFP 75 | 0.60 | 3.08 | 65.3 | 366b |
| CFP 100 | 0.56 | 3.43 | 60.5 | 383ab |
| SEM gabungan | 0,067 tahun | 0.202 | 3.285 | 11.58 |
| ANOVA satu arah | 0,550 | 0,527 | 0,165 | 0,033 |
| Kontras polinomial ortogonal | ||||
| Linier | 0,537 tahun | 0.208 | 0.604 | 0,021 |
| Kuadrat | 0,148 | 0.652 | 0.459 | 0,676 tahun |
| Regresi | ||||
| Model | – | – | – | Linier |
| R 2 | 0.229 | |||
| Nilai p | 0,033 | |||
Singkatan: ANOVA, analisis varians; CAT, aktivitas katalase (nmol min −1 mL −1 ); CFP, protein fermentasi jagung; LYS, aktivitas lisozim (enzim unit mL −1 ); NBT, uji tetrazolium nitro-biru (OD 540 nm); SOD, Superoksida dismutase (% penghambatan).
a Nilai disajikan sebagai rata-rata ( n = 4). Nilai dengan alfabet yang sama atau tidak adanya alfabet tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).
3.4 Parameter biokimia darah
Parameter biokimia darah lengkap dari ikan salmon Atlantik yang diberi diet percobaan ditunjukkan pada Tabel 7. Penambahan CFP tidak memengaruhi parameter biokimia darah apa pun dalam penelitian ini. Kadar Hb total dan Hct juga serupa di seluruh kelompok perlakuan ( p > 0,05).
| Pola makan | Tingkat keasaman (pH) | pCO2 (mmHg ) | PO2 (mmHg ) | tCO2 (mmol L − 1 ) | SO2 (% ) | Na (mmol L −1 ) | K (mmol L −1 ) | iCa (mmol L −1 ) | Glukosa (mg dL −1 ) | Hct (%PCV) | Hb (gram dL −1 ) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| CFP 0 | 6.87 | 36.1 | 18.4 | 7.56 | 12.0 | 148 | 2.08 | 1.63 | 108 | 40.9 | 13.9 |
| CFP 25 | 6.83 | 35.0 | 17.4 | 6.98 | 10.8 | 150 | 2.00 | 1.66 | 89.4 | 40.6 | 13.8 |
| CFP 50 | 6.90 | 33.8 | 16.6 | 7.63 | 10.6 | 147 | 2.24 | 1.63 | 100 | 37.8 | 12.8 |
| CFP 75 | 6.86 | 34.5 | 16.9 | Tanggal 7.08 | 11.3 | 150 | 2.33 | 1.64 | 91.9 | 39.5 | 13.4 |
| CFP 100 | 6.89 | 35.9 | 18.2 | 7.90 | 13.2 | 149 | 2.21 | 1.66 | 97.2 | 38.4 | 13.6 |
| SEM gabungan | 0,022 | 1.831 | 2.157 | 0.261 | 2.685 | 0.887 | 0.186 | 0,037 tahun | 5.329 | 2.038 | 0.634 |
| ANOVA satu arah | 0.188 | 0.884 | 0,967 tahun | 0.119 | 0,958 | 0.143 | 0.772 | 0,960 | 0.173 | 0,777 tahun | 0,775 tahun |
| Kontras polinomial ortogonal | |||||||||||
| Linier | 0.234 | 0.883 | 0,895 | 0.364 | 0.737 | 0.311 | 0.356 | 0.702 | 0.286 | 0.363 | 0.604 |
| Kuadrat | 0.629 | 0.324 | 0.493 | 0.121 | 0.490 | 0.810 | 0.763 | 0.907 | 0.173 | 0.696 | 0.397 |
Singkatan: ANOVA, analisis varians; CFP, protein fermentasi jagung; Glu, glukosa; Hb, hemoglobin; Hct, hematokrit; iCa, kalsium terionisasi; K, kalium; Na, natrium; pCO 2 , tekanan parsial karbon dioksida; PCV, volume sel yang dikemas; pH, hidrogen potensial; pO 2 , tekanan parsial oksigen; sO 2 , sulfur dioksida; tCO 2 , total karbon dioksida.
a Nilai-nilai disajikan sebagai rata-rata ( n = 4). Nilai-nilai tanpa alfabet tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).
3.5 Penilaian histopatologi usus distal
Morfologi usus distal salmon Atlantik yang diberi diet eksperimental selama 12 minggu disajikan dalam Tabel 8. Pencantuman CFP tidak secara signifikan memengaruhi tinggi lamina propria dan enterosit ( p > 0,05); namun, tinggi lipatan dipengaruhi secara signifikan oleh berbagai tingkat pencantuman CFP. Tinggi lipatan ikan yang diberi CFP 0 dan CFP 25 secara signifikan lebih tinggi daripada ikan yang diberi CFP 50 ( p < 0,05). Selain itu, tinggi lipatan menurun seiring dengan peningkatan tingkat CFP dalam diet, yang menunjukkan model linier ( p = 0,046).
| Pola makan | Satuan hF (μm) | Nilai hE (μm) | Jumlah LPG (μm) |
|---|---|---|---|
| CFP 0 | 403a | 17.0 | 19.8 |
| CFP 25 | 411a | 17.3 | 18.9 |
| CFP 50 | 374b | 17.4 | 21.3 |
| CFP 75 | 394ab | 17.0 | 21.1 |
| CFP 100 | 389 tahun | 17.1 | 20.1 |
| SEM gabungan | 6.997 | 0.705 | 1.609 |
| ANOVA satu arah | 0,013 | 0.882 | 0.812 |
| Kontras polinomial ortogonal | |||
| Linier | 0,046 tahun | 0,574 tahun | 0,591 tahun |
| Kuadrat | 0.207 | 0.616 | 0.654 |
| Regresi | |||
| Model | Linier | – | – |
| R 2 | 0.142 | ||
| Nilai p | 0.101 | ||
Singkatan: ANOVA, analisis varians; CFP, protein fermentasi jagung; hE, tinggi enterosit; hF, tinggi lipatan; hLP, tinggi lamina propria.
a Nilai disajikan sebagai rata-rata ( n = 4). Nilai dengan alfabet yang sama atau tidak adanya alfabet tidak berbeda secara statistik ( p > 0,05; rancangan acak lengkap, ANOVA satu arah; uji Tukey’s HSD).
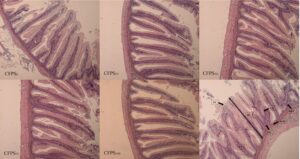
Tabel 9 menunjukkan histopatologi usus distal yang diamati pada salmon Atlantik yang diberi diet eksperimental selama 12 minggu. Tak satu pun parameter yang dievaluasi, termasuk fusi lipatan mukosa, jumlah sel goblet, vakuolisasi supranuklear, infiltrasi granulosit eosinofilik, tinggi lamina propria, dan skor mukosa sub-epitel, menunjukkan perbedaan yang signifikan. Skor histopatologi rata-rata, yang menggambarkan enteritis usus distal kasar, menunjukkan bahwa penggantian FM oleh CFP tidak secara signifikan memengaruhi kesehatan usus salmon Atlantik. Gambar 2 mengilustrasikan gambar representatif. Tren linier terdeteksi antara CFP diet dan variabel dependen, termasuk jumlah sel goblet dan vakuolisasi supranuklear.
| Pola makan | MFF | Bahasa Inggris | Bahasa Inggris | MISALNYA | LP | Bahasa Inggris SeM | Skor rata-rata |
|---|---|---|---|---|---|---|---|
| CFP 0 | 2.41 | 2.38 | 2.44 | 2.50 | 2.50 | 1.50 | Jam 2.30 |
| CFP 25 | 2.81 | 2.72 | 3.03 | 2.34 | 2.00 | 1.50 | 2.40 |
| CFP 50 | 2.97 | 3.00 | 3.06 | 2.41 | 2.50 | 2.00 | 2.66 |
| CFP 75 | 2.95 | 3.03 | 3.07 | 2.34 | 2.25 | 1.75 | 2.57 |
| CFP 100 | 2.97 | 3.19 | 3.16 | 2.50 | 2.00 | 2.25 | 2.68 |
| SEM gabungan | 0.220 | 0.218 | 0.218 | 0,158 | 0,335 | 0.438 | 0,185 |
| ANOVA satu arah | 0,581 tahun | 0.143 | 0,265 | 0,954 | 0.630 | 0.728 | 0,567 tahun |
| Kontras polinomial ortogonal | |||||||
| Linier | 0.123 | 0,013 | 0,048 tahun | 0,996 tahun | 0.490 | 0.226 | 0,134 tahun |
| Kuadrat | 0.334 | 0.456 | 0,225 | 0.414 | 0,845 | 0.881 | 0.642 |
| Regresi | |||||||
| Model | – | Linier | Linier | – | – | – | – |
| R 2 | 0.333 | 0.209 | |||||
| Nilai p | 0,008 | 0,043 tahun | |||||
Singkatan: ANOVA, analisis varians; CFP, protein fermentasi jagung; EG, granulosit eosinofilik; GC, sel goblet; LP, lamina propria; MFF, fusi lipatan mukosa; SeM, mukosa sub-epitel; SV, vakuola supranuklear.
a Nilai-nilai disajikan sebagai rata-rata ( n = 4). Nilai-nilai tanpa alfabet tidak berbeda secara statistik ( p > 0,05; Data dianalisis dengan uji Kruskal–Wallis dan uji post hoc Wilcoxon). Untuk menilai keberadaan peradangan usus distal, sistem penilaian (berkisar dari 1 hingga 5) digunakan untuk mengevaluasi fusi lipatan mukosa, jumlah sel goblet, vakuolisasi supranuklear, infiltrasi granulosit eosinofilik, tinggi lamina propria, dan tampilan mukosa subepitel di usus distal, diadaptasi dari Urán et al. ( 2008 ).
4 DISKUSI
DDGS tradisional telah dievaluasi secara luas sebagai sumber protein alternatif dalam makanan berbagai spesies, menunjukkan tingkat keberhasilan yang bervariasi, khususnya pada spesies herbivora dan omnivora. Sebaliknya, ikan karnivora, yaitu ikan laut dan salmonid, biasanya menunjukkan permintaan yang tinggi terhadap kandungan protein dan ketergantungan pada FM, sehingga menimbulkan keterbatasan dalam pemanfaatan DDGS tradisional sebagai pengganti FM. Penelitian telah melaporkan bahwa kinerja pertumbuhan spesies ikan karnivora seperti turbot (Diógenes et al., 2018 ) dan kerapu hibrida (Zhu et al., 2022 ) terhambat oleh penggabungan DDGS tradisional dalam upaya menggantikan FM. Bahasa Indonesia : Dalam beberapa tahun terakhir, HP-DDG, yang dikembangkan menggunakan teknologi canggih untuk meningkatkan kandungan protein dan mengurangi kandungan serat yang tidak dapat dicerna, telah menunjukkan janji penting pada beberapa spesies akuakultur seperti tilapia (Suehs & Gatlin, 2022 ), striped catfish (Allam et al., 2020 ), European sea bass (Goda et al., 2020 ), dan rainbow trout (Øverland et al., 2013 ). Meski begitu, penelitian tentang penyertaan produk sampingan jagung berprotein tinggi saat ini sebagai sumber protein utama dalam makanan spesies tingkat trofik tinggi, seperti salmonid, masih terbatas. Sejauh pengetahuan kami, di antara eksperimen yang dilakukan selama lebih dari 10 minggu atau lebih, empat penelitian dilakukan dengan salmonid. Øverland et al. ( 2013 ) dan Prachom et al. ( 2013 ) melakukan penilaian HP-DDG pada rainbow trout, dan Hossain et al. ( 2023 ) mengevaluasi pemanfaatan CPFS (ProCap Gold) dalam diet salmon Atlantik. Baru-baru ini, Grayson dkk. ( 2024 ) meneliti produk CFP pada ikan trout pelangi. Masing-masing penelitian ini dirancang untuk menilai produk HP-DDG atau CFP sebagai pengganti bahan yang berasal dari tumbuhan, seperti tepung gluten jagung, tepung bunga matahari, tepung lobak, atau protein kedelai, sebagai lawan dari penggantian FM. Namun, kandungan protein yang tinggi pada CFP menunjukkan kemungkinan penggantian FM. Oleh karena itu, penelitian saat ini dirancang untuk menyelidiki kesesuaian CFP sebagai pengganti FM dalam diet salmon Atlantik.
Temuan dari studi ini menunjukkan bahwa produk CFP dapat digunakan untuk menggantikan FM dalam diet parr salmon Atlantik pada tingkat hingga 50% tanpa berdampak buruk pada kinerja pertumbuhan dan pemanfaatan pakan. Ketika tingkat substitusi lebih tinggi dari 50%, tidak ada perbedaan signifikan yang diamati dalam kinerja pertumbuhan ikan; meskipun demikian, peningkatan FCR dan pengurangan nilai PER tercatat. Dalam studi terbaru yang mengevaluasi produk CFP yang sama (ProCap) pada nila (Suehs & Gatlin, 2022 ) dan salmon Atlantik (Hossain et al., 2023 ), penggantian yang berhasil baik campuran bungkil kedelai dan FM atau bungkil kedelai saja dicapai tanpa dampak buruk pada pemanfaatan pakan seperti FCR dan PER. Dalam studi kami, efek negatif pada FCR dan PER ditemukan pada tingkat penggantian FM yang lebih tinggi, kontras dengan studi sebelumnya menggunakan CFP di mana tidak ada dampak pada nilai FCR dan PER yang dicatat saat mengganti bungkil kedelai atau kombinasi bungkil kedelai dan FM. Nilai FCR yang lebih tinggi dan nilai PER yang lebih rendah pada kelompok CFP 75 dan CFP 100 dibandingkan pada kelompok perlakuan lain dalam studi ini mungkin dapat dikaitkan dengan tinggi lipatan yang lebih pendek. Tinggi lipatan yang memendek mengindikasikan pengurangan pada area permukaan yang tersedia untuk penyerapan nutrisi di usus (Caspary, 1992 ), yang pada gilirannya dapat mempengaruhi FCR dan PER. Dalam evaluasi parameter histomorfologi usus dalam studi saat ini, hanya tinggi lipatan yang dipengaruhi oleh penyertaan CFP. Secara khusus, ikan yang diberi makan baik diet CFP 0 atau CFP 25 menunjukkan tinggi lipatan yang jauh lebih besar dibandingkan dengan yang diberi makan CFP 50 . Penurunan tinggi lipatan saat kadar konten CFP meningkat dalam studi ini mungkin dikaitkan dengan peningkatan kandungan serat kasar, yang mungkin dihasilkan dari residu serat yang tidak dapat dicerna dalam produk CFP. Khususnya, konsekuensi ini cenderung diperbesar pada spesies ikan karnivora, yang secara inheren memiliki kapasitas terbatas untuk memetabolisme polisakarida. Menariknya, studi sebelumnya oleh Hossain et al. ( 2023 ), yang meneliti produk CFP yang identik (ProCap Gold) pada salmon Atlantik, mengungkapkan peningkatan numerik baik pada tinggi lipatan maupun ketebalan lamina propria seiring dengan peningkatan tingkat inklusi CFP, yang menunjukkan efek menguntungkan dari CFP sebagai pengganti bungkil kedelai. Mengingat bahwa CFP digunakan sebagai pengganti bungkil kedelai dalam penelitian sebelumnya, beberapa laporan menunjukkan bahwa inklusi substansial bungkil kedelai dalam formulasi pakan untuk ikan karnivora berdampak buruk pada morfologi usus (Gu et al., 2016 ; Heikkinen et al., 2006 ; Zhang et al., 2018). Akibatnya, CFP kemungkinan memiliki efek positif pada kesehatan usus dibandingkan dengan bungkil kedelai, sedangkan penerapannya sebagai pengganti FM tampaknya membahayakan integritas struktural usus distal. Namun, meskipun ada perubahan morfologi yang diamati, tidak ada aspek patologis yang terkait dengan enteritis yang dicatat dalam penelitian ini.
Telah diakui secara luas bahwa kualitas sumber protein memengaruhi aktivitas enzim metabolisme protein, termasuk ALT dan AST (Cheng et al., 2010 ; Mugwanya et al., 2023 ). Temuan kami menunjukkan bahwa penambahan CPFS tidak memengaruhi kadar AST dan ALT. Hasil ini, pada gilirannya, menyiratkan bahwa efisiensi penggunaan protein yang berkurang yang diamati dalam penelitian ini tampaknya tidak bergantung pada kadar ALT dan AST. ALT dan AST berfungsi sebagai indikator biokimia yang penting, tidak hanya dalam menilai fungsi pencernaan tetapi juga status kesehatan hati. Kedua enzim metabolisme ini dilepaskan ke dalam sistem peredaran darah saat terjadinya kerusakan hepatosit yang dipicu oleh faktor stres biotik atau abiotik (Mugwanya et al., 2023 ). Dalam penelitian ini, kadar ALT dan AST plasma tidak terpengaruh oleh penambahan CFP, yang sesuai dengan temuan eksperimen lain yang dilaporkan pada ikan trout pelangi (Øverland et al., 2013 ). Namun, beberapa penelitian yang mengevaluasi DDGS melaporkan efek buruk pada hati, seperti peningkatan kadar ALT dan AST pada beberapa spesies akuakultur, seperti pada ikan turbot (Diógenes et al., 2018 ) dan kerapu hibrida (Zhu et al., 2022 ). Temuan yang kontras ini mungkin disebabkan oleh faktor-faktor khusus spesies atau perbedaan dalam proses produksi DDGS, yang pada akhirnya memengaruhi kualitas produk akhir.
Dalam kondisi normal, spesies oksigen reaktif (ROS) yang diproduksi selama ledakan pernapasan memainkan peran penting dalam berbagai fungsi, termasuk mempertahankan inang terhadap mikroorganisme patogen, mengatur siklus sel, dan terlibat dalam berbagai jalur pensinyalan seluler (Martínez-Álvarez et al., 2005 ). Meskipun demikian, gangguan dalam keseimbangan antara pembentukan ROS dan kapasitas organisme untuk mengatasi ROS ini dapat menyebabkan stres oksidatif, yang menyebabkan potensi kerusakan pada sel dan organ. Uji NBT adalah metode yang paling populer untuk mendeteksi ledakan pernapasan (Vera-Jimenez et al., 2013 ). SOD berfungsi sebagai enzim yang bertanggung jawab untuk menetralkan superoksida, memfasilitasi konversi dua molekul superoksida menjadi oksigen dan hidrogen peroksida. Selanjutnya, enzim seperti CAT berperan dalam menghilangkan sebagian hidrogen peroksida ini (Hoseinifar et al., 2020 ). Dalam penelitian saat ini, ledakan pernapasan dan respons antioksidan ditemukan tidak bergantung pada tingkat inklusi CFP; Namun, meskipun tidak signifikan secara statistik, penyertaan CFP menunjukkan kecenderungan untuk meningkatkan respons antioksidan jika dibandingkan dengan kelompok kontrol, yang menunjukkan potensi efek menguntungkan pada pengaturan ROS pada ikan. Sebaliknya, aktivitas lisozim dipengaruhi secara signifikan oleh kadar CFP dalam makanan. Ikan terutama bergantung pada imunitas non-spesifik karena evolusi awalnya, di mana lisozim berfungsi sebagai molekul pertahanan penting, yang memfasilitasi pertahanan terhadap invasi mikroba (Saurabh & Sahoo, 2008 ). Dalam penelitian ini, aktivitas lisozim meningkat pada kelompok CFP 25 dibandingkan dengan kelompok kontrol; namun, penurunan aktivitas lisozim berikutnya diamati dengan meningkatnya kadar penyertaan CFP, yang menunjukkan bahwa penyertaan CFP yang berlebihan menghambat aktivitas respons imun non-spesifik. Hasil ini konsisten dengan temuan Suehs dan Gatlin ( 2022 ), di mana aktivitas lisozim meningkat hingga tingkat penyertaan CFP tertentu dan kemudian menurun. Dalam penelitian yang menilai DDGS sebagai alternatif bungkil kedelai, peningkatan aktivitas lisozim diamati dalam korelasi dengan penambahan DDGS (Goda et al., 2019 ; Hossain et al., 2023 ), yang dikaitkan dengan senyawa imunomodulator seperti mannan oligosakarida yang terdapat dalam DDGS (Shurson, 2018 ). Namun, hal ini berbeda saat mengganti FM, yang menunjukkan bahwa imunostimulan yang melekat dalam FM lebih kuat dalam hal kekebalan non-spesifik.
Parameter biokimia, terutama kadar Hct dan Hb, berfungsi sebagai indikator berharga untuk kesehatan ikan secara keseluruhan, yang mencerminkan status nutrisi, kerentanan penyakit, dan tingkat stres (Brill et al., 2008 ), yang dalam penelitian ini tidak dipengaruhi oleh penambahan CFP. Telah dilaporkan secara luas bahwa penambahan sumber protein berbasis tanaman, yang sering digunakan sebagai pengganti FM, pada tingkat yang lebih tinggi dapat menyebabkan penurunan kadar Hct dan Hb pada organisme akuatik (Blom et al., 2001 ; Lim & Lee, 2009 ; Pham et al., 2007 ). Seperti yang dilaporkan oleh Lim dan Lee ( 2009 ), yang menunjukkan bahwa kadar Hct dan Hb dipengaruhi oleh defisiensi nutrisi esensial dalam bahan pakan dan faktor anti-nutrisi, CFP yang digunakan dalam penelitian ini mengandung profil nutrisi yang seimbang dengan kandungan faktor anti-nutrisi yang rendah.
5 KESIMPULAN
Temuan studi kami menunjukkan bahwa penambahan CFP (ProCap Gold) sebagai pengganti FM berhasil menggantikan seluruh komponen FM dalam pakan salmon Atlantik tanpa mengorbankan kinerja pertumbuhan ikan, komposisi seluruh tubuh, dan parameter biokimia darah dari parr salmon Atlantik. Lebih jauh, penambahan CFP tidak berdampak buruk pada komposisi seluruh tubuh, ALT, AST, respons antioksidan, parameter hematologi, dan hasil histopatologi. Namun, tingkat substitusi yang lebih tinggi, khususnya di atas 50%, menunjukkan peningkatan FCR dan penurunan nilai PER. Model regresi kuadrat yang menghubungkan PER dan FCR dengan tingkat CFP makanan menunjukkan bahwa tingkat penggantian yang optimal adalah antara 18,6% dan 25%. Selain itu, ada penurunan aktivitas lisozim dan tinggi lipatan bersamaan dengan peningkatan kandungan CFP, yang menyoroti perlunya penyelidikan lebih lanjut terhadap dampak potensial pada respons imun non-spesifik dan penyerapan nutrisi pada spesies ikan karnivora. Berdasarkan hasil ANOVA, penggantian 50% FM dengan CFP dapat diterapkan tanpa efek merugikan pada kinerja pertumbuhan, pemanfaatan pakan, kekebalan non-spesifik, dan kesehatan usus selama fase parr produksi salmon Atlantik.
Studi ini memberikan wawasan berharga tentang potensi CFP sebagai pengganti FM yang layak secara ekonomi dan ramah lingkungan dalam diet salmon Atlantik. Penelitian lebih lanjut diperlukan untuk mengeksplorasi efek jangka panjangnya pada kesehatan ikan dan untuk lebih memahami mekanisme di balik penurunan aktivitas lisozim dan perubahan morfologi yang diamati pada usus distal pada kelompok CFP tinggi.



