ABSTRAK
Residu pestisida menimbulkan risiko yang signifikan terhadap ekosistem perairan, fauna, dan kesehatan manusia. Namun, dampak fisiologis pada organisme perairan, terutama ikan yang terpapar residu pestisida pada musim kemarau, masih belum dieksplorasi, dan bahkan data tentang paparan kronis terhadap campuran residu pestisida dalam kondisi lingkungan alami masih langka. Studi ini mengevaluasi respons imun, hematologi, dan pertumbuhan Oreochromis niloticus yang terpapar limbah ladang kapas dalam kondisi in-situ selama musim kemarau di waduk air Batran. Percobaan selama 56 hari dilakukan selama musim kemarau menggunakan desain 2 × 1 (sistem kultur kandang × dua lingkungan). Waduk air Batran di cekungan kapas Benin (lokasi yang terpapar limbah) digunakan sebagai lingkungan uji (tercemar), dan tangki beton di Station de Recherche et d’Innovation en Aquacultures (SRIA) Universitas Parakou mewakili lingkungan yang terkendali. Hasilnya mengungkapkan bahwa O. niloticus yang terpapar pada lingkungan tercemar menunjukkan aktivitas makrofag yang secara signifikan lebih rendah dibandingkan dengan kontrol ( p > 0,05). Analisis hematologi menunjukkan peningkatan kadar eosinofil dan heterofil di lingkungan tercemar dibandingkan dengan kontrol ( p < 0,05). Pada parameter pertumbuhan, secara umum, O. niloticus menunjukkan kinerja pertumbuhan yang lebih tinggi di lingkungan tercemar dibandingkan dengan kontrol, dengan perbedaan yang signifikan hanya dengan berat rata-rata akhir (83,61 ± 16,61 g; 69,44 ± 5,73 g, berturut-turut) ( p < 0,05) pada akhir percobaan. Temuan ini menyiratkan bahwa tidak adanya aplikasi pestisida selama musim kemarau di Batran kemungkinan mengurangi stres fisiologis yang disebabkan oleh polutan, sehingga meningkatkan pertumbuhan meskipun metrik kekebalannya sebanding. Temuan ini menunjukkan perlunya mengontekstualisasikan strategi pengelolaan akuakultur dalam siklus penggunaan agrokimia musiman, karena periode non-aplikasi dapat menawarkan interval pemulihan kritis untuk spesies yang dibudidayakan.
1 Pendahuluan
Polutan yang dibuang ke ekosistem perairan berkontribusi terhadap kerusakan sosial ekonomi dan lingkungan yang signifikan. Meskipun ada kerangka peraturan dan proses pengolahan air limbah yang canggih, sistem perairan terus mengandung senyawa aktif biologis, termasuk agrokimia, farmasi, dan bahan kimia industri, yang menimbulkan risiko bagi satu kesehatan. Praktik pertanian merupakan kontributor utama kontaminasi perairan karena limpasan yang mengandung pupuk, pestisida, dan herbisida. Di sebagian besar negara Afrika Sub-Sahara (SSA), pertanian merupakan komponen substansial dari aktivitas sosial ekonomi. Bagi jutaan orang, industri ini menyediakan sarana utama penghidupan mereka dan secara signifikan memengaruhi jalannya ekonomi umum wilayah tersebut. Produksi pertanian sering kali diberi harga, terutama jika menyangkut penggunaan pestisida secara besar-besaran. Pestisida termasuk di antara polutan antropogenik paling berbahaya yang dimasukkan ke dalam ekosistem perairan. Hal ini disebabkan oleh stabilitas kimianya yang persisten, ketahanan metabolik, dan sifat lipofiliknya (Yang et al. 2021 ), yang memfasilitasi bioakumulasi dan retensi lingkungan yang berkepanjangan. Pada tahun 2021 saja, negara-negara SSA mengimpor sekitar 370.267 metrik ton pestisida untuk perlindungan tanaman, yang diperlukan untuk mempertahankan hasil panen dan mendukung pertumbuhan populasi (FAOSTAT 2021 ). Di Benin, sejak 1992, produksi kapas telah menjadi sektor pertanian yang dominan dalam hal nilai ekonominya, yang mencakup lebih dari 35% ekspor negara tersebut (Ahmad dan Hasanuzzaman 2020 ). Produksi ini diarahkan ke wilayah utara, dengan dua produsen departemen utama, Borgou dan Alibori. Kedua departemen ini menyumbang sekitar 70% dari hasil kapas negara tersebut (MAEP 2014 ). Namun, budidaya kapas di Benin menghadapi tantangan yang signifikan karena tekanan hama yang intens, yang menyebabkan penggunaan pestisida yang substansial. Pada tahun 2015, negara tersebut mengimpor pestisida senilai US $6,8 juta, dengan setengahnya diarahkan pada pestisida yang sangat berbahaya (FAO 2017 ). Namun, penelitian telah menunjukkan bahwa hanya sebagian kecil (1%) dari pestisida ini yang secara efektif mencapai targetnya, dengan mayoritas (99%) tersebar ke dalam ekosistem (Yildirim 2023 ). Menurut Chaumet et al. ( 2021 ), ekosistem perairan merupakan wadah terakhir dari sisa fraksi pestisida yang digunakan. Melalui berbagai rute, seperti limpasan lahan dan pencucian air tanah, pestisida yang digunakan oleh petani akhirnya memasuki badan air tetangga (Mtashobya 2021 ). Setelah masuk ke lingkungan perairan, pestisida dapat memiliki efek berbahaya pada keseimbangan ekosistem yang rapuh ini (Ting dan Stagner 2023)). Perairan ini, termasuk waduk kecil dan besar yang sebagian besar terletak di cekungan produksi kapas di wilayah utara (Adam Sanni 2011 ), telah digunakan secara luas untuk menangkap ikan selama bertahun-tahun (Pèlèbè et al. 2019 ). Mereka menyediakan lebih dari 60% ikan segar yang dikonsumsi di Benin utara, termasuk Oreochromis niloticus (Adam Sanni 2011 ; Imorou Toko et al. 2011 ). Pengenalan pestisida ke waduk ini dapat terakumulasi dalam sedimen, bertahan untuk jangka waktu yang lama dan mengganggu keseimbangan ekologi, membahayakan kesehatan flora akuatik dan fauna lainnya. Pelepasan pestisida ke badan air ini mengkhawatirkan, karena 50% pestisida dapat bertahan dalam jaringan ikan selama lebih dari 30 hari. Hal ini menimbulkan masalah lingkungan yang membawa implikasi kesehatan karena ikan merupakan sumber protein langsung bagi populasi dan kelompok penting dalam jaring makanan akuatik (Orou-Seko et al. 2024 ). Penggunaan pestisida juga menyebabkan berkurangnya tingkat pertumbuhan dan dikaitkan dengan berbagai gangguan metabolisme dan reproduksi (Mohapatra et al. 2025 ; Orou-Seko et al. 2024 ; Pèlèbè et al. 2020 ) dan mengubah fungsi kekebalan pada ikan.
Untuk melawan xenobiotik ini, ikan teleost, termasuk O. niloticus , sangat bergantung pada imunitas bawaan sebagai garis pertahanan pertama mereka (Abdel-Latif et al. 2020 ). Mekanisme bawaan pada nila ( O. niloticus ) meliputi penghalang fisik (lendir, kulit), efektor seluler (makrofag, neutrofil) dan faktor humoral (protein pelengkap, lisozim, peptida antimikroba) (Abdel-Latif et al. 2020 ) yang bekerja cepat terhadap infeksi atau stres lingkungan. Dalam kondisi stres termal atau kimia, jalur ini dapat terganggu, yang menyebabkan kerusakan oksidatif, produksi sitokin yang tidak teratur, dan berkurangnya pembersihan patogen (Shohreh et al. 2025 ). Meskipun imunostimulan makanan dan suplemen fitokimia digunakan untuk melawan efek ini, kapasitas perlindungannya dapat terbatas (Mashhadizadeh et al. 2024 ; Shohreh et al. 2025 ). Gangguan ini dapat menyebabkan perubahan histopatologis pada organ-organ seperti insang, hati, limpa, ginjal dan tubulus renal, serta pada jaringan endokrin dan otak. Selain itu, dapat mengakibatkan kelainan neurologis dan perilaku, serta cacat genetik (Ibrahim et al. 2023 ; Kar dan Senthilkumaran 2024 ). Sementara penggunaan pestisida pertanian sangat diperlukan dalam pertanian konvensional untuk ketahanan pangan, dampak ekologisnya memerlukan pendekatan penelitian holistik untuk menginformasikan praktik berkelanjutan. Namun, sedikit yang diketahui tentang efek fisiologis dari polutan ini selama musim kemarau pada organisme yang menghuni ekosistem perairan ini. Misalnya saja penelitian yang ada di daerah penghasil kapas di Benin (Agbohessi et al. 2015 ; Douny et al. 2021 ; Guedegba et al. 2022 ; Zoumenou et al. 2019)) terutama difokuskan pada dampak pestisida selama musim hujan, saat aplikasi mencapai puncaknya. Studi-studi ini mengabaikan dampak residu yang bertahan hingga musim kemarau, mengingat persistensi pestisida dalam ekosistem perairan. Tanpa investigasi pada kondisi musim kemarau, informasi penting tentang dampak laten dan kumulatif dari residu agrokimia pada biota perairan akan tetap tidak jelas. Efek sub-mematikan kronis seperti imunosupresi, respons hematologi, stres oksidatif atau retardasi pertumbuhan selama periode aplikasi rendah dapat menghindari deteksi, yang mengarah pada perkiraan risiko ekologis yang lebih rendah. Strategi pengelolaan yang hanya bergantung pada data musim hujan tidak akan cukup mengatasi dinamika kontaminan sepanjang tahun, yang berpotensi memungkinkan paparan yang berkepanjangan membahayakan kesehatan ikan dan ketahanan populasi. Selain itu, sebagian besar pengetahuan mengenai dampak residu pestisida pada parameter fisiologis diperoleh dari uji laboratorium yang dilakukan dalam kondisi yang dikontrol ketat. Pendekatan semacam itu sering kali tidak memadai karena menggunakan konsentrasi paparan yang jauh melebihi yang ditemui di alam dan tidak memiliki kompleksitas lingkungan habitat alami. Selain itu, uji laboratorium gagal mereplikasi fluktuasi dinamis dalam faktor fisikokimia yang secara kritis memengaruhi sensitivitas organisme, mobilitas polutan, bioavailabilitas, dan toksisitas. Akibatnya, ada kebutuhan mendesak untuk studi yang mengevaluasi efek pestisida di musim kemarau dan dalam kondisi yang lebih ekologis. Dengan demikian, studi ini menilai respons imunohematologi dan pertumbuhan O. niloticus di waduk Batran selama musim kemarau, ketika masuknya pestisida berkurang tetapi kontaminasi lama masih dapat membahayakan kesehatan ikan. Fokus temporal dan ekotoksikologi ini memajukan pemahaman tentang dinamika kontaminan musiman, menawarkan bukti yang penting untuk strategi pengelolaan adaptif untuk menjaga keanekaragaman hayati perairan dan perikanan di wilayah yang bergantung pada pestisida. Ini juga mendukung praktik pengelolaan berkelanjutan dalam ekosistem perairan di wilayah tersebut.
2 Bahan dan Metode
2.1 Lingkungan Belajar
2.1.1 Lingkungan yang Tercemar
Dalam studi ini, kami menggunakan waduk air Batran, yang terletak di Banikoara dalam cekungan kapas Benin (11°23′58.62″N, 2°22′6.69″W), yang mencakup area seluas 20 hektar. Ini adalah salah satu badan air yang paling terkontaminasi di Benin utara karena penggunaan pestisida pertanian yang luas, seperti yang sebelumnya didokumentasikan dalam beberapa studi (Douny et al. 2021 ; Guedegba et al. 2022 ; Pèlèbè et al. 2023 ; Zoumenou et al. 2019 ). Meskipun tercemar, waduk tersebut banyak digunakan untuk kegiatan penangkapan ikan sehari-hari dan tetap beroperasi sepanjang musim kemarau, menjadikannya sumber daya air yang penting bagi masyarakat setempat. Berbagai macam pestisida telah terdeteksi di waduk, termasuk organoklorin, organofosfat, dan kelompok pestisida lainnya (Tabel 1 ).
| Pestisida terdeteksi | Jangkauan |
|---|---|
| Oreochromis niloticus (µg. kg −1 ) | |
| p,p′-DDD + o,p′-DDT | 2.1–3.2 |
| p,p′-DDE | 1–6 |
| λ-sihalotrin | 7.4–8.4 |
| β-siflutrin | 6.6–11 |
| Klorpirifos | 1.9–3.3 |
| Permetrin | 4.5 |
| Air (µg. l −1 ) | |
| o, p′-DDE | 0,089–0,176 |
| p, p′-DDT | 0,065–0,105 |
| p, p′-DDE | 0,074–0,178 |
| p, p′-DDD | 0,076–0,094 |
| o, p′-DDD | 0,069–0,086 |
| Endosulfan | 1 |
| Heptaklor | 0,45–1,444 |
| asam amino alfa-HCH | 0,2–2,1 |
| Klorpirifos | 8–941 |
| Deltametrin | 1–7 |
| Sedimen (µg. kg −1 ) | |
| p,p′-DDT | 1–1,8 |
| p,p′-DDE | 0,7–2,8 |
| δ—HCH | 0,7–1,1 |
| β + γ—HCH | 3.6 |
| asetamiprid | 0,1–479,8 |
| Permetrin | 0,8–11 |
| Klorpirifos | 1–1,5 tahun |
| λ-sihalotrin | 0,8–8,8 |
2.1.2 Lingkungan Kontrol
Lingkungan kontrol terdiri dari cekungan beton yang dibangun khusus (9°20′18.44″N, 2°38′52.19″W) di Station de Recherche et d’Innovation en Aquaculture (SRIA), yang dikelola oleh Laboratorium Penelitian Akuakultur dan Ekotoksikologi Akuatik (LaRAEAq), Universitas Parakou. Cekungan ini dipasok secara eksklusif dengan air tanah dari sumber pengeboran yang dipantau, dipilih untuk meminimalkan kontaminasi antropogenik. Untuk memvalidasi kesesuaiannya sebagai kontrol, parameter kualitas air dan tingkat kontaminan diukur sebelum periode eksperimen, menganalisis parameter fisikokimia utama, termasuk suhu, oksigen terlarut, pH, konduktivitas, amonia, nitrit dan konsentrasi nitrat. Selain itu, analisis kimia dilakukan untuk menyaring kontaminasi residu pestisida menggunakan metode analisis standar (LC-MS/MS). Hasil mengonfirmasi tingkat agrokimia target yang tidak terdeteksi (<0,01 µg/L batas deteksi) di bawah pedoman WHO untuk kehidupan akuatik. Hal ini memastikan bahwa lokasi kontrol menyediakan lingkungan yang relatif tidak terkontaminasi dan stabil untuk penelitian. Mengingat tidak ada ekosistem perairan alami yang sepenuhnya bebas dari pengaruh antropogenik, penggunaan cekungan eksperimental yang terkontrol dianggap tepat untuk penelitian ini.
2.2 Ikan Percobaan
Ikan nila [ O. niloticus : (Linnaeus 1758 )] digunakan sebagai model biologis untuk penelitian ini. O. niloticus adalah spesies asli Afrika Barat, yang dibudidayakan secara luas di seluruh SSA karena pertumbuhannya yang cepat, tingkat reproduksi yang tinggi, dan kemampuan beradaptasi terhadap berbagai kondisi lingkungan. Selain itu, di Benin dan khususnya di daerah penghasil kapas, ikan ini berfungsi sebagai sumber utama protein dan pendapatan bagi masyarakat pedesaan, sehingga menjadikannya bagian integral dari ketahanan pangan dan ekonomi lokal (Imorou Toko et al. 2011 ). Secara ilmiah, O. niloticus adalah organisme model yang mapan dalam penelitian ekotoksikologi, yang sering digunakan untuk menilai dampak polutan seperti pestisida pada kehidupan akuatik (Guedegba et al. 2022 ; Ibrahim et al. 2023 ; Kumar et al. 2011 ; Mashhadizadeh et al. 2024 ). Respons fisiologis dan biokimianya terhadap kontaminan telah terdokumentasi dengan baik, menjadikannya bioindikator yang andal untuk memantau kesehatan lingkungan. Selain itu, kebiasaan makannya yang omnivora dan posisinya dalam jaring makanan akuatik menjadikannya bioindikator yang efektif untuk menilai kesehatan ekosistem air tawar (Adokiya et al. 2025 ).
Ikan muda O. niloticus berjenis kelamin campuran (bobot awal rata-rata: 15 ± 0,9 g; n = 440) diperoleh dari Tonon Cossi Gilbert Foundation, sebuah fasilitas akuakultur nila intensif dan pusat rujukan yang diakui untuk produksi benih berkualitas tinggi dengan sebutan Pusat Penelitian dan Inkubasi Akuakultur Benin (CRIAB). Fasilitas ini terletak di Ouèdo, kotamadya Abomey-Calavi (Benin Selatan), sebuah wilayah dengan aktivitas pertanian minimal, yang memastikan spesimen dasar dengan paparan agrokimia sebelumnya yang dapat diabaikan. CRIAB mengoperasikan sistem akuakultur sirkulasi tertutup (RAS) yang memanfaatkan air tanah yang bersumber dari lubang bor sedalam 60 m. Parameter air tambak dijaga pada 27,5 ± 1,2°C, pH 7,1 ± 0,3, oksigen terlarut 6,5 ± 0,4 mg/L dan amonia <0,02 mg/L menggunakan biofiltrasi dan aerasi otomatis. Ikan diangkut ke lokasi percobaan dalam kantong polietilen beroksigen 30 L (kepadatan penebaran: 110 individu/kantong) dengan air yang disesuaikan salinitasnya (2%) untuk mengurangi stres osmotik. Setelah tiba (pasca pengangkutan), aklimatisasi selama 10 hari dilakukan di keramba jaring apung 10 m3 ( 150 ikan/keramba) di lokasi Batran dan SRIA. Ikan diberi makan diet protein 35% standar (2% berat badan/hari) secara menyeluruh, dengan puasa pra-percobaan selama 24 jam sebelum pengambilan sampel untuk menstandardisasi status metabolisme.
2.3 Desain Eksperimen
Rancangan faktorial 2 × 1 dilaksanakan pada musim kemarau (pertengahan Oktober hingga Maret), yaitu periode yang ditandai dengan tidak adanya penggunaan pestisida. Rancangan percobaan terdiri dari tiga kandang, masing-masing dengan luas permukaan 1,69 m 2 dan tinggi 1,79 m. Kandang-kandang ini dipasang di masing-masing dari dua lokasi percobaan. Di satu lokasi, kandang-kandang dipasang menggunakan penyangga kayu di semua sisi dan dibenamkan di sedimen waduk Batran. Di stasiun LaRAEAq, kandang-kandang dipasang di tepi atas tanduk horizontal, dan diletakkan di atas tangki beton.
2.4 Prosedur Percobaan
Setelah aklimatisasi, 100 juvenil O. niloticus (15 ± 0,9 g) ditebar ke dalam setiap kandang berukuran 10 m 3 di kedua lokasi dengan kondisi operasional standar: kepadatan penebaran yang identik (10 ikan/m 3 ), pola pemberian pakan (pakan komersial berprotein 32% “Le GOUESSANT”, Prancis, dua kali sehari sampai kenyang pada pukul 07:00 dan 17:00), dan desain kandang (ukuran mata jaring 1 cm, kedalaman 2 m). Sementara cekungan kontrol SRIA memungkinkan pengaturan aktif parameter air (suhu: dipertahankan melalui penutup yang teduh; oksigen terlarut: melalui aerator), lingkungan alami Waduk Batran memerlukan strategi stabilisasi pasif. Waktu percobaan pada musim kemarau meminimalkan variabilitas hidrologi, dan kandang diposisikan di zona yang terlindung dan memiliki kedalaman yang seragam (2 m) untuk mengurangi kekeruhan dan stratifikasi termal. Parameter kualitas air (suhu, pH) dipantau setiap dua hari di kedua lokasi menggunakan multimeter HANNA HI 9911–5 yang terkalibrasi, dengan pengukuran dilakukan pada pukul 07:00 pagi dan 5:00 sore sebelum pemberian pakan untuk menstandardisasi fluktuasi diurnal.
2.5 Pengambilan Sampel
Pada awal percobaan (Hari 0 = D0), berat individu dicatat untuk 30 ikan yang dipilih secara acak (10 per kandang) di setiap lokasi menggunakan timbangan elektronik (PHILIPS, 5 kg, 0,1 g). Pengukuran berat diulang pada Hari ke-15 (D15) dan pada akhir penelitian pada Hari ke-56 (D56). Pada akhir percobaan, sampel darah dan limpa dikumpulkan dari tiga jantan (berat rata-rata: 84,2 ± 17,1 g) dan tiga betina (berat rata-rata: 82,9 ± 16,3 g) O. niloticus per replikasi kandang di kedua lokasi. Penentuan jenis kelamin mengikuti kriteria morfologi yang divalidasi (papila genital kerucut yang berbeda pada jantan vs. lubang genital dan urin ganda pada betina), dengan individu yang ukurannya cocok dipilih untuk meminimalkan efek pengganggu dimorfisme seksual pada respons fisiologis. Setiap ikan dibius menggunakan MS-222 (100 mg/L; 3 aminobenzoate methanesulfonate salt, Sigma-Belgium) sebelum pengambilan sampel. Sampel darah (total 36) diambil dari arteri atau vena kaudal menggunakan spuit 1 cc yang diheparinisasi dan dipindahkan ke dalam tabung vakum yang telah diolah terlebih dahulu dengan asam etilendiamintetraasetat (EDTA) untuk analisis hematologi (kadar imunoglobulin (IG) total, hematokrit, dan parameter leukosit). Tabung-tabung tersebut diberi label dengan hati-hati. Setelah pengambilan darah, ikan-ikan tersebut dieutanasia dengan dislokasi serviks, dan limpa mereka dikumpulkan menggunakan instrumen pembedahan yang disterilkan. Sebanyak 36 limpa dikumpulkan dan segera ditempatkan ke dalam tabung Eppendorf 5 mL yang telah diberi label sebelumnya yang berisi 500 µL medium Leibovitz (L-15, Sigma, Belgia) untuk analisis produksi superoksida (aktivitas makrofag). Sampel yang dikumpulkan disimpan dalam es pada suhu 4°C di lapangan dan segera diangkut ke laboratorium untuk dianalisis.
2.6 Parameter Kekebalan Tubuh
2.6.1 Aktivitas Makrofag
Aktivitas makrofag (MA) dinilai dengan mengukur produksi anion superoksida selama stres oksidatif di limpa menggunakan metode yang dilaporkan oleh Fatima et al. ( 2007 ) dan Milla et al. ( 2010 ). Pengujian ini dimulai dengan penambahan 0,5 mL medium L-15, yang dipindahkan ke dalam cawan Petri yang berisi 0,5 mL medium yang diperkaya. Suspensi sel yang dihasilkan kemudian dipindahkan ke dalam tabung polipropilena 1,5 mL dan disentrifugasi pada 500 g selama 5 menit. Supernatan dibuang, dan sel disuspensikan kembali dalam 0,5 mL medium pertumbuhan segar. Prosedur pencucian ini diulang dua kali. Duplikat suspensi sel dipindahkan ke dalam tabung polipropilena 1,5 mL, dengan 100 µL alikuot digunakan untuk pengujian. Setelah 30 menit inkubasi, 100 µL larutan nitroblue tetrazolium (NBT) (1 mg/mL dalam PBS, pH 7,4) ditambahkan ke setiap sampel. Untuk membuat kurva standar relatif, 100 µL suspensi sel yang terkumpul diperlakukan dengan berbagai jumlah NBT (0–150 µL). Setelah inkubasi selama 1 jam pada suhu ruangan, sel disentrifugasi, dan supernatan dibuang. Sel kemudian difiksasi menggunakan 280 µL metanol. Formazan tereduksi dalam setiap tabung dilarutkan dalam campuran 240 µL KOH 2 M dan 280 µL N -dimetilformamida. Jumlah NBT tereduksi diukur menggunakan spektrofotometer pada panjang gelombang 550 nm setelah sentrifugasi pada 3500 rpm.
2.6.2 Imunoglobulin Total (IG)
Konsentrasi total IG plasma ditentukan mengikuti metode yang dijelaskan oleh Milla et al. ( 2010 ). Sampel darah disentrifugasi pada 1610 g selama 3 menit untuk memisahkan plasma. IG diendapkan dengan menambahkan polietilen glikol (PEG), dengan berat molekul 10.000 kDa (Sigma). Serum dicampur dengan volume yang sama dari larutan PEG 12% dan diinkubasi selama 2 jam pada suhu kamar dengan agitasi terus menerus. Sampel kemudian disentrifugasi pada 1000 × g selama 10 menit. Supernatan dikumpulkan, dan konsentrasi proteinnya diukur. Konsentrasi total IG dihitung dengan mengurangi konsentrasi protein supernatan dari konsentrasi total protein plasma sebelum presipitasi dengan PEG.
2.7 Parameter Hematologi
2.7.1 Hematokrit
Sampel darah dikumpulkan dalam tabung hematokrit dengan aksi kapiler dan disentrifugasi pada 3000 rpm selama 5 menit. Volume sel padat (PCV) diukur sebagai persentase menggunakan pembaca hematokrit. Hematokrit ditentukan sebagai rasio volume sel darah merah terhadap volume darah total.
2.7.2 Parameter Leukosit
Analisis diferensial leukosit dilakukan dengan mengikuti protokol hematologi ikan standar yang dimodifikasi dari Witeska et al. ( 2022 ). Sampel darah tepi diambil dari pembuluh darah kaudal menggunakan spuit yang mengandung heparin (1 mL natrium heparin per 10 mL darah) untuk mencegah pembekuan darah. Apusan darah tipis disiapkan dalam waktu 5 menit setelah pengambilan menggunakan teknik irisan pada slide mikroskop yang telah dibersihkan sebelumnya (76 × 26 mm, ketebalan 1,0–1,2 mm) untuk memastikan distribusi sel monolayer. Apusan dikeringkan dengan udara selama 15 menit pada suhu 25°C, difiksasi dalam metanol absolut selama 5 menit dan diwarnai dengan May-Grunwald Giemsa (MGG; Sigma-Aldrich) menggunakan protokol dua langkah: pewarnaan May-Grunwald (5 menit dalam larutan murni) dan pewarnaan Giemsa [15 menit dalam buffer Giemsa 10% (pH 6,8)]
Kaca objek dibilas dengan larutan penyangga fosfat (PBS, pH 7,4) dan dikeringkan dengan udara secara vertikal untuk meminimalkan artefak pewarnaan. Diferensiasi leukosit dilakukan di bawah perendaman minyak 100x (Nikon Eclipse E200, Jepang) oleh dua pengamat independen yang tidak mengetahui kelompok eksperimen. Minimal 200 leukosit per kaca objek dihitung di beberapa bidang mikroskopis untuk memperhitungkan heterogenitas distribusi, dengan identifikasi sel berdasarkan kriteria morfologi teleost yang telah ditetapkan (Tabel 2 ):
| Jenis sel | Kriteria morfologi |
|---|---|
| Limfosit | Rasio inti: sitoplasma tinggi, kromatin padat |
| Monosit | Inti berbentuk ginjal, sitoplasma pucat |
| Heterofil | Granula eosinofilik, inti berlobulus |
| Eosinofil | Granula eosinofilik bulat yang lebih besar |
| Basofil | Jarang ditemukan pada teleost, diidentifikasi dengan butiran metakromatik |
Semua slide yang menunjukkan artefak pembekuan atau pewarnaan yang tidak merata (>5% dari sediaan) dikeluarkan dan disiapkan kembali dari alikuot cadangan. Variabilitas antar pengamat diukur menggunakan koefisien κ Cohen ( κ = 0,89, yang menunjukkan kesesuaian yang sangat baik). Rumus leukosit dihitung sebagai:
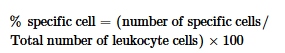
2.8 Parameter Pertumbuhan, Pemanfaatan Pakan dan Kelangsungan Hidup
Untuk menilai kinerja pertumbuhan dan tingkat kelangsungan hidup ikan di lingkungan terkendali dan tercemar, parameter berikut digunakan oleh Pèlèbè et al. ( 2023 ) diukur pada Hari ke-0, 15 dan 56:

2.9 Pengolahan Data dan Analisis Statistik
Data dicatat menggunakan Microsoft Excel 2016, dan hasilnya disajikan sebagai mean ± standar deviasi. Analisis statistik dilakukan menggunakan perangkat lunak R pada tingkat signifikansi 5%. Parameter kelangsungan hidup dan pertumbuhan (SGP), parameter pemanfaatan pakan, bersama dengan parameter leukosit, dianalisis menggunakan analisis varians dua arah (ANOVA). Periode pemeliharaan dan lokasi percobaan digunakan sebagai variabel untuk analisis SGP, sedangkan lokasi percobaan dan jenis kelamin dianggap sebagai faktor untuk parameter leukosit. Beberapa perbandingan mean dilakukan menggunakan uji Tukey. Selain itu, uji- t dilakukan untuk membandingkan parameter kualitas air dan parameter imunohematologi, termasuk MA, total IG, dan hematokrit. Analisis ini mengevaluasi dampak polusi di waduk Batran.
3 Hasil
3.1 Parameter Kualitas Air
Parameter fisikokimia dari lingkungan kontrol (SRIA) dan lingkungan tercemar (Batran) yang tercatat selama percobaan disajikan dalam Tabel 3. Penelitian menunjukkan bahwa suhu di lingkungan tercemar (28,30 ± 2,19°C) jauh lebih tinggi dibandingkan dengan lingkungan kontrol (26,01 ± 1,35°C). Sebaliknya, mengenai nilai pH, catatan menunjukkan nilai yang relatif sama antara kedua lingkungan, dengan lingkungan kontrol mencatat pH yang sedikit lebih tinggi (7,33 ± 0,34) dibandingkan dengan lingkungan tercemar (7,15 ± 0,25). Tidak ada perbedaan signifikan dalam dua lingkungan penelitian untuk kedua parameter ( p > 0,05).
| Lingkungan | Suhu (°C) | Tingkat keasaman (pH) |
|---|---|---|
| Lingkungan pengendalian (SRIA) | 26,01 ± 1,35 | 7,33 ± 0,34 |
| Lingkungan tercemar (Batran) | 28.30 ± 2.19 | 7,15±0,25 |
3.2 Biomarker Imunohematologi
3.2.1 Aktivitas Makrofag
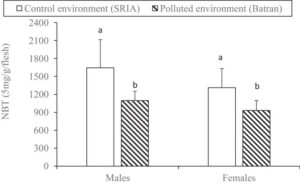
Perbandingan MA pada O. niloticus yang dipelihara di lingkungan tercemar (Batran) dan lingkungan kontrol (SRIA) untuk ikan jantan dan betina diilustrasikan dalam Gambar 1. Selama 56 hari percobaan, MA secara signifikan lebih tinggi di lingkungan kontrol dibandingkan dengan lingkungan tercemar untuk kedua jenis kelamin ( p < 0,05). Di lingkungan kontrol, O. niloticus jantan menunjukkan kadar MA yang lebih tinggi (1644,01 ± 470,60 mg/g/daging), dibandingkan dengan betina (1313,15 ± 316,12 mg/g/daging). Demikian pula, MA di lingkungan tercemar lebih tinggi, dengan jantan mencatat 1098,45 ± 155,65 mg/g/daging dan betina 931,92 ± 167,25 mg/g/daging.
3.2.2 Total IG dan Hematokrit
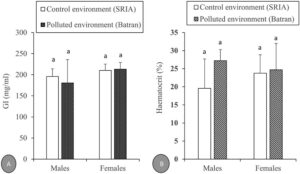
Tingkat IG total yang diukur dalam O. niloticus yang dipelihara di lingkungan yang tercemar (Batran) dan kontrol (SRIA), dikelompokkan berdasarkan jenis kelamin, ditampilkan dalam Gambar 2A . Di lingkungan kontrol, jantan menunjukkan tingkat IG rata-rata 195,58 ± 18,34 mg/mL, sedangkan betina memiliki tingkat yang sedikit lebih tinggi pada 210,06 ± 15,08 mg/mL. Di lingkungan yang tercemar, jantan menunjukkan penurunan tingkat IG total (180,59 ± 55,18 mg/mL), sedangkan betina menunjukkan peningkatan (213,10 ± 15,83 mg/mL) dibandingkan dengan lingkungan kontrol. Tidak ada perbedaan signifikan yang diamati antara lokasi percobaan ( p > 0,05).
3.2.3 Parameter Leukosit
Proporsi sel leukosit dalam O. niloticus yang dipelihara selama 56 hari di lingkungan tercemar (Batran) dan kontrol (SRIA) disajikan dalam Tabel 4. Penelitian ini mengungkapkan bahwa kadar limfosit sebanding di seluruh kelompok, dengan nilai berkisar antara 84,18% hingga 85,60% (85,60 ± 5,39% untuk jantan di lingkungan tercemar; 84,18 ± 5,30% untuk betina di lingkungan kontrol). Demikian pula, persentase monosit konsisten, berkisar antara 6,43% hingga 7,03% (6,82 ± 3,55% untuk jantan di lingkungan tercemar; 6,43 ± 4,24% untuk betina di lingkungan kontrol). Persentase limfosit dan monosit tidak menunjukkan perbedaan signifikan di seluruh lingkungan atau jenis kelamin. Namun, penelitian menunjukkan bahwa O. niloticus dari lingkungan tercemar memiliki kadar eosinofil yang secara signifikan lebih tinggi (3,26 ± 0,63% untuk jantan; 3,65 ± 1,29% untuk betina) dibandingkan dengan kontrol (0,94 ± 0,98% untuk jantan; 1,25 ± 1,21% untuk betina) ( p ˂ 0,001). Sebaliknya, persentase heterofil secara signifikan lebih rendah di lingkungan tercemar (4,30 ± 3,29% untuk jantan; 4,95 ± 1,52% untuk betina) dibandingkan dengan kontrol (7,40 ± 2,21% untuk jantan; 8,13 ± 1,80% untuk betina) ( p ˂ 0,001). Tidak ditemukan interaksi signifikan antara lingkungan dan jenis kelamin untuk semua parameter leukosit.
| Lingkungan | Seks | Limfosit (%) | Eosinofil (%) | Monosit (%) | Heterofil (%) | Basofil (%) |
|---|---|---|---|---|---|---|
| Republik Rakyat Sri Lanka | M | 84,84 ± 4,98 per menit | 0,94 ± 0,98 per menit | 6,80 ± 3,66 per menit | 7,40 ± 2,21 jam | angka 0 |
| F | 84,18 ± 5,30 menit | 1,25 ± 1,21 per menit | 6,43 ± 4,24 jam | 8,13 ± 1,80 per menit | angka 0 | |
| Batran | M | 85,60 ± 5,39 menit | 3,26 ± 0,63 miliar | 6,82 ± 3,55 menit | 4,30 ± 3,29 detik | angka 0 |
| F | 84,35 ± 5,44 jam | 3,65 ± 1,29 miliar | 7,03 ± 4,20 per menit | 4,95 ± 1,52 miliar | angka 0 | |
| Efek yang diamati setelah ANOVA dua arah | ||||||
| Lingkungan | tidak ada | S | tidak ada | S | — | |
| Seks | tidak ada | tidak ada | tidak ada | tidak ada | — | |
| Lingkungan × Seks | tidak ada | tidak ada | tidak ada | tidak ada | — | |
| p dimana signifikan | — | 0.000 | — | 0.000 | — | |
Catatan : Data disajikan sebagai rata-rata ± simpangan baku. Dalam kolom, nilai dengan huruf yang sama tidak berbeda secara signifikan ( p > 0,05). Singkatan: F, betina; M, jantan; ns, efek tidak signifikan; s, signifikan.
3.3 Parameter Kelangsungan Hidup, Pertumbuhan dan Pemanfaatan Pakan
Tabel 5 menunjukkan perubahan dalam parameter kinerja kelangsungan hidup, pertumbuhan dan pemanfaatan pakan untuk ikan yang dipelihara di lingkungan kontrol (SRIA) dan lingkungan tercemar (Batran) selama 15 dan 56 hari. Tingkat kelangsungan hidup tinggi dan hampir identik di kedua lingkungan (98,32 ± 0,57% untuk SRIA dan 91,31 ± 8,94% untuk Batran) tanpa perbedaan signifikan antara lingkungan ( p > 0,05). Pada parameter pertumbuhan, hasil menunjukkan bahwa, pada Hari ke-15, tidak ada perbedaan signifikan antara lingkungan untuk parameter apa pun ( p > 0,05). Berat rata-rata akhir juga serupa (36,91 ± 1,51 g; 36,73 ± 1,76 g, masing-masing, untuk SRIA dan Batran), seperti juga pertambahan berat rata-rata (16 ± 2,23 g; 14,5 ± 1,59 g, masing-masing, untuk SRIA dan Batran) dan laju pertumbuhan spesifik (SRIA: 3,85 ± 0,92%; Batran: 3,34 ± 0,29%). Selama 56 hari percobaan, perubahan signifikan pada berat rata-rata akhir dan pertambahan berat rata-rata diamati antara periode pemeliharaan ( p < 0,001 dan p = 0,001, masing-masing). Hasil penelitian menunjukkan bahwa O. niloticus yang dipelihara di lingkungan tercemar (Batran) menunjukkan berat rata-rata akhir yang lebih tinggi (83,61 ± 16,61 g) dibandingkan dengan yang dipelihara di lingkungan kontrol (69,44 ± 5,73 g), serta pertambahan berat rata-rata yang lebih tinggi (46,87 ± 16,81 g; 32,53 ± 5,33 g, masing-masing, untuk Batran dan SRIA). Namun, tidak ditemukan perbedaan yang signifikan dalam laju pertumbuhan spesifik antar lingkungan pada hari ke-56 (3,23 ± 0,88%; 2,52 ± 0,94%, masing-masing, untuk Batran dan SRIA).
| Lingkungan | Periode | Kelangsungan hidup | Parameter pertumbuhan ( n = 30) | Parameter pemanfaatan pakan | |||
|---|---|---|---|---|---|---|---|
| Tingkat kelangsungan hidup (%) | Faw (g) | Gwa (g) | SGR (%) | FCR | PER | ||
| Republik Rakyat Sri Lanka | D15 | 99,33 ± 0,57 satu | 36,91 ± 1,51 per menit | 16 ± 2,23 jam | 3,85 ± 0,92 satuan | 0,39 ± 0,05 satu | 0,08 ± 0,01 satu |
| D56 | 98,32 ± 0,57 satu | 69,44 ± 5,73 jam | 32,53 ± 5,33 detik | 2,52 ± 0,94 per menit | 0,40 ± 0,2 satuan | 0,11 ± 0,19 per menit | |
| Batran | D15 | 99,33 ± 1,16 detik | 36,73 ± 1,76 jam | 14,5 ± 1,59 jam | 3,34 ± 0,29 per menit | 0,55 ± 0,21 satu | 0,06 ± 0,03 b |
| D56 | 91,31 ± 8,94 per menit | 83,61 ± 16,61 b | 46,87 ± 16,81 miliar | 3,23 ± 0,88 per menit | 0,41 ± 0,08 satu | 0,05 ± 0,01 b | |
| Efek yang diamati setelah ANOVA dua arah | |||||||
| Lingkungan | tidak ada | tidak ada | tidak ada | tidak ada | tidak ada | S | |
| Periode | tidak ada | S | S | tidak ada | tidak ada | tidak ada | |
| Lingkungan x Masa Pemeliharaan | tidak ada | tidak ada | tidak ada | tidak ada | tidak ada | tidak ada | |
| p dimana signifikan | — | 0.000 | 0,001 | — | — | 0,009 | |
Catatan : Data disajikan sebagai rata-rata ± simpangan baku. Dalam kolom; nilai dengan huruf yang sama tidak berbeda secara signifikan ( p > 0,05). Singkatan: Faw, berat rata-rata akhir, Gwa, pertambahan berat rata-rata; SGR, laju pertumbuhan spesifik.
Mengenai rasio konversi pakan (FCR), lingkungan tercemar (Batran) menunjukkan FCR yang lebih tinggi dibandingkan dengan kontrol (SRIA) pada D15 (0,55 ± 0,21 dan 0,39 ± 0,05, berturut-turut). Namun, pada D56 FCR serupa tercatat di kedua lingkungan. Tidak ada efek utama yang signifikan dari lingkungan, atau periode, atau interaksi lingkungan × periode yang signifikan ( p > 0,05). Mengenai rasio efisiensi protein (PER), ikan yang dipelihara di lingkungan kontrol (SRIA) menunjukkan efisiensi protein yang lebih tinggi (0,08 ± 0,01, 0,11 ± 0,19, berturut-turut untuk D15 dan D56) dibandingkan dengan yang ada di Batran (0,06 ± 0,03, 0,05 ± 0,01, berturut-turut untuk D15 dan D56). Terdapat pengaruh utama lingkungan yang signifikan terhadap PER ( p = 0,009), sedangkan pengaruh utama periode maupun interaksi lingkungan × periode tidak mencapai signifikansi ( p > 0,05).
4 Diskusi
Polusi pestisida merupakan masalah lingkungan yang kritis, yang berkontribusi terhadap degradasi ekosistem perairan, hilangnya keanekaragaman hayati dan terganggunya keseimbangan ekologi. Studi ini mengkaji respons fisiologis, khususnya respons imun, hematologi dan pertumbuhan O. niloticus yang terpapar campuran residu pestisida dalam kondisi alami musim kemarau di daerah penghasil kapas. Temuan keseluruhan menunjukkan bahwa paparan musim kemarau terhadap campuran pestisida residu di lingkungan yang tercemar (waduk Batran) tidak menyebabkan penekanan imun atau gangguan hematologi yang substansial pada O. niloticus . Sebaliknya, ikan di lingkungan yang terpapar limbah menunjukkan peningkatan kinerja pertumbuhan relatif terhadap ikan di kontrol di akhir. Pertumbuhan ini diamati secara signifikan pada berat rata-rata akhir di akhir percobaan. Hal ini menunjukkan bahwa musim kemarau, yang ditandai dengan kurangnya aplikasi pestisida aktif, dapat memberikan jendela stres toksikologi yang berkurang.
4.1 Parameter Kualitas Air
Suhu dan pH di lingkungan percobaan tetap dalam kisaran yang cocok untuk ikan tropis (28°C hingga 32°C; pH 6,5 hingga 9) (Lazard 2009 ). Sementara kondisi operasional (kepadatan penebaran, pola pemberian pakan, desain kandang) distandarisasi antar lokasi untuk mengisolasi efek polutan, disparitas lingkungan yang inheren muncul karena perbedaan mendasar dalam tipologi ekosistem. Lingkungan yang tercemar, sebagai sistem lentik alami, menunjukkan variabilitas termal yang lebih besar, yang mungkin dipengaruhi oleh iradiasi matahari dan dinamika hidrologi, sedangkan infrastruktur beton dan sumber air tanah cekungan kontrol SRIA memberikan stabilitas termal yang terlindungi. Demikian pula, fluktuasi pH di Batran dapat mencerminkan pergeseran diurnal alami dalam aktivitas fotosintesis dan dekomposisi bahan organik, yang tidak ada di lingkungan SRIA yang terkendali. Kontras ini mencerminkan perbedaan yang relevan secara ekologis antara sistem akuakultur alami dan yang dikelola. Nilai-nilai yang kami rekam selaras dengan hasil yang diperoleh dalam studi musim hujan di badan air Benin (Imorou Toko et al. 2011 ; Pèlèbè et al. 2020 , Pèlèbè et al. 2023 ), meskipun suhu yang sedikit lebih rendah dan pH yang lebih tinggi di lingkungan kontrol kami kemungkinan mencerminkan perbedaan dalam ukuran dan kedalaman badan air. Semua parameter tetap dalam ambang batas yang mendukung kesehatan ikan, memastikan respons biologis didorong terutama oleh paparan agrokimia. Meskipun studi kami tidak mencakup pengukuran karbon dioksida bebas, alkalinitas, kekerasan, konduktivitas, amonia, nitrat, nitrit atau kebutuhan oksigen kimia (COD). Mengingat peran utama suhu dan pH dalam mengatur kesehatan ekosistem perairan, fokus pada parameter ini memberikan pandangan kritis tentang kondisi lingkungan. Suhu dan pH berfungsi sebagai indikator integratif yang mencerminkan efek kumulatif dari berbagai faktor lingkungan (Furey et al. 2022 ; Napit dan Pillai 2024 ). Namun, Pèlèbè et al. ( 2019 ) mensintesis parameter kualitas air ini dari beberapa waduk termasuk waduk air Batran di Benin utara. Mereka melaporkan nilai konduktivitas berkisar antara 41 hingga 109,5 µS cm −1 , konsentrasi oksigen terlarut antara 1,23 dan 2,16 mg L −1 , tingkat kesadahan total 3,07 hingga 4,75 mg L −1 , konsentrasi nitrat berkisar antara 5,95 hingga 12,75 mg L −1 dan konsentrasi nitrit dari 0,18 hingga 0,40 mg L −1 .
4.2 Biomarker Imunohematologi
Mekanisme pertahanan spesifik dan nonspesifik pada ikan mencakup respons humoral dan seluler. Studi telah menunjukkan perubahan dalam sistem imun organisme akuatik yang terpapar polutan lingkungan, termasuk pestisida (Gibbons et al. 2015 ; Köhler dan Triebskorn 2013 ). Misalnya, Kumar et al. ( 2011 ) dan Yonar et al. ( 2014 ) melaporkan gangguan fungsi imun dan hematologi pada ikan nila ( O. mossambicus) dan ikan mas ( Cyprinus (C.) carpio ) setelah terpapar endosulfan dan malathion, masing-masing. Dalam studi saat ini, ikan dari lingkungan yang tercemar menunjukkan MA yang berkurang dibandingkan dengan kontrol, tanpa memandang jenis kelamin. Temuan ini sejalan dengan Galal et al. ( 2018 ) dan Kondera et al. ( 2018 ) di mana C. carpio terpapar Roundup dan Glyphosate, dan O. niloticus terpapar penoxsulam, menunjukkan jumlah sel darah putih dan aktivitas oksidatif fagosit (NBT) yang berkurang. Namun, temuan kami kontras dengan temuan Guedegba et al. ( 2022 ) selama musim hujan di lingkungan tercemar yang sama, MA (NBT) lebih tinggi dibandingkan dengan lingkungan kontrolnya, dengan jantan menunjukkan aktivitas yang lebih tinggi. Pengurangan aktivitas fagosit yang diamati dalam penelitian ini dibandingkan dengan musim hujan yang diamati oleh Guedegba et al. ( 2022 ) kemungkinan mencerminkan berkurangnya stres yang disebabkan pestisida karena penghentian penggunaan pestisida di daerah perkebunan kapas. Sebaliknya, peningkatan stres di lingkungan kontrol mungkin berasal dari faktor non-pestisida, termasuk patogen mikroba dan kondisi termal yang kurang optimal. Proliferasi mikroba dari pakan yang tidak termakan dalam sistem pengendalian yang stagnan, dangkal (kedalaman 1 m) tidak mungkin terjadi di lingkungan yang tercemar, mengalir, dan lebih dalam (>1 m), yang selanjutnya menggarisbawahi dinamika pemicu stres yang berbeda antara lokasi.
Produksi anion superoksida merupakan indikator penting aktivitas imun pada ikan, yang terutama terkait dengan makrofag. Namun, didokumentasikan bahwa spesies oksigen reaktif (ROS) ini juga dapat diproduksi oleh sel imun lain, seperti yang ada di limpa dan ginjal sefalik, dalam kondisi lingkungan atau fisiologis tertentu (Chandra et al. 2023 ). Reseptor mirip tol (TLR), khususnya TLR4, diketahui mengenali pola molekuler terkait patogen (PAMP) dan selanjutnya memicu jalur pensinyalan yang mengarah pada aktivasi makrofag dan produksi ROS (Wicherska-Pawłowska et al. 2021 ). Hal ini menyoroti kompleksitas dalam menghubungkan produksi anion superoksida hanya dengan MA. Dalam penelitian saat ini, uji enzimatik digunakan untuk mengevaluasi aktivitas imun, terutama berfokus pada makrofag limpa. Sementara pengujian ini memberikan wawasan berharga ke dalam status fungsional sistem imun, pengujian ini mencerminkan kontribusi gabungan makrofag dan jenis sel imun lain yang ada di limpa. Keterbatasan ini menggarisbawahi pentingnya menafsirkan hasil kami dalam konteks interaksi dan kontribusi sel imun yang lebih luas. Chandra et al. ( 2023 ) melaporkan ritme musiman dalam indeks fagositosis sel limpa, memuncak pada bulan Mei dan Desember dan menurun pada bulan Maret, yang mencerminkan interaksi antara populasi sel imun yang berbeda yang beradaptasi dengan stresor lingkungan dan fisiologis. Studi serupa sebelumnya telah melaporkan modulasi musiman aktivitas imun pada spesies ikan, di mana kapasitas fagositosis dan produksi ROS dipengaruhi oleh suhu, tekanan patogen, dan pertukaran energi yang terkait dengan respons imun (Collazos et al. 1994 ; Hardie et al. 1994 ; Morvan et al. 1998 ). Meskipun mekanisme komplemen TLR belum diselidiki, penelitian di masa mendatang sebaiknya menyertakan parameter untuk klarifikasi lebih lanjut tentang bagaimana makrofag memulai dan mempertahankan respons imun, terutama melalui ledakan oksidatif.
IG merupakan agen kunci imunitas humoral adaptif. Dalam penelitian ini, tidak ada perubahan signifikan pada IG yang diamati di lingkungan yang tercemar, berbeda dengan penelitian yang melaporkan penurunan pada konsentrasi pestisida yang lebih tinggi (Galal et al. 2018 ; Ma and Li 2015 ). Namun, hasil yang sebanding juga telah diamati pada ikan yang terpapar logam berat dan insektisida organoklorin tingkat tinggi (Di Giulio and Hinton 2008 ; Raibeemol and Chitra 2020 ). Hal ini menunjukkan bahwa tingkat residu pestisida di Batran tidak cukup untuk mengganggu imunitas adaptif selama periode pengamatan kami.
Kualitas darah adalah indikator penting fungsi imun dan kesehatan fisiologis secara keseluruhan pada hewan, termasuk ikan (Adedeji et al. 2009 ; Imorou Toko et al. 2014 ; Svoboda et al. 2001 ). Penelitian sebelumnya telah menunjukkan bahwa parameter hematologi adalah indikator gangguan fisiologis dan perilaku yang dapat diandalkan saat ikan terpapar polutan lingkungan (Adedeji et al. 2009 ; Ball et al. 2024 ; Fernandes 2003 ; Vosylienė 1999 ). Anemia dan defisiensi besi, misalnya, sering kali tercermin dalam kadar hematokrit yang berkurang (Rehulka 2002 ; Řehulka 2002 ). Ikan yang dipelihara di lingkungan yang tercemar menunjukkan nilai hematokrit yang lebih tinggi dibandingkan dengan yang berasal dari lingkungan kontrol. Temuan ini sejalan dengan hasil Bojarski et al. ( 2015 ), yang mengamati peningkatan kadar hematokrit pada C. carpio yang terpapar herbisida pendimethalin dan Ethofumesate dalam durasi pendek. Namun, hasil kami berbeda dari temuan Adedeji et al. ( 2009 ) pada Clarias gariepinus liar dan tawanan yang terpapar diazinon, serta temuan Imorou Toko et al. ( 2014 ), yang melaporkan efek negatif pada parameter hematologi pada induk C. gariepinus yang terpapar Thian. Penurunan serupa pada parameter hematologi dicatat oleh Svoboda et al. ( 2001 ) pada C. carpio yang terpapar Diazinon.
Banyak faktor yang mempengaruhi distribusi dan jumlah granulosit pada ikan (Firdaus-Nawi dan Zamri-Saad 2016 ). Faktor-faktor ini termasuk musim dalam setahun, polutan lingkungan, penyakit dan stresor, seperti transportasi, penanganan, trauma dan paparan bahan kimia. Jumlah eosinofil yang secara signifikan lebih tinggi di lingkungan yang tercemar dibandingkan dengan kontrol dalam penelitian ini kontras dengan Ighwela et al. ( 2012 ), yang mengamati perubahan hematologi pada O. niloticus setelah 14 minggu pemberian makanan dengan berbagai tingkat maltosa (0,0, 20, 25, 30 dan 35%). Peningkatan ini mungkin menunjukkan adanya reaksi inflamasi alergi. Meningkatnya kadar eosinofil juga kemungkinan merupakan indikasi respons imun terhadap stresor lingkungan, berpotensi parasit, mengingat lingkungan yang tercemar merupakan lingkungan alami dengan lebih banyak stres risiko ekologis daripada lingkungan yang terkendali. Jumlah heterofil yang sangat tinggi di lingkungan kontrol (SRIA) dibandingkan dengan yang dari lingkungan tercemar serupa dengan yang diamati pada spesies lain, seperti Maena maena dan Pagellus eythrinus yang diparasit oleh cymothoadia (Romestand 1978 ) dan Micropterus salmoides , di bawah stres syok panas (Esch dan Hazen 1980 ). Ajadi et al. ( 2022 ) melaporkan respons hematologi serupa pada ikan lele Afrika yang terpapar berbagai proporsi tanaman makanan selama 12 minggu. Memang, heterofil teleost adalah fagosit profesional dan merupakan leukosit pertama yang direkrut ke tempat infeksi oleh kemokin (Havixbeck dan Barreda 2015 ). Peningkatan heterofil biasanya mencerminkan respons spesifik terhadap berbagai rangsangan stres, sering kali disertai dengan penurunan limfosit (Bragoni et al. 1983 ). Dengan demikian, pengurangan stres ini dapat menjelaskan kesehatan ikan secara keseluruhan yang relatif lebih baik di lingkungan yang tercemar. Namun, jumlah heterofil yang lebih tinggi dalam lingkungan kontrol mungkin menunjukkan bentuk stres yang berbeda, seperti infeksi bakteri, yang tidak terkait dengan paparan pestisida.
4.3 Parameter Kelangsungan Hidup dan Pertumbuhan, Parameter Pemanfaatan Pakan
Dalam studi ini, secara global, tingkat kelangsungan hidup O. niloticus di kedua lingkungan percobaan melebihi 90%, hasil yang konsisten dengan studi sebelumnya pada O. niloticus di Whedos di delta Ouémé (Benin) (Elegbe et al. 2015 ; Elègbè et al. 2015 ). Tingkat kelangsungan hidup yang serupa telah dilaporkan di keramba jaring apung di Gabon (Iga-Iga 2008 ), di kolam ikan di Senegal (Sarr et al. 2015 ) dan dalam sistem kultur kandang di waduk Batran selama musim hujan (Imorou Toko et al. 2018 ). Namun, dalam studi kami, lingkungan kontrol (SRIA) menunjukkan tingkat kelangsungan hidup sebesar 91,31% selama musim kemarau, yang sedikit lebih rendah daripada tingkat kelangsungan hidup 99% yang diamati di lingkungan kontrol oleh Pèlèbè et al. ( 2020, 2023 ). Sebaliknya, lingkungan tercemar (Batran) dalam penelitian kami menunjukkan tingkat kelangsungan hidup sebesar 98,32% selama musim kemarau, yang melampaui tingkat kelangsungan hidup 75% yang dilaporkan oleh Pèlèbè et al. ( 2020 ) selama musim hujan di lingkungan yang sama.
Pada akhir percobaan, semua indeks pertumbuhan, termasuk berat rata-rata akhir, pertambahan berat dan laju pertumbuhan spesifik, lebih tinggi di lingkungan tercemar dibandingkan dengan lingkungan kontrol. Nilai-nilai ini sedikit lebih rendah daripada yang dilaporkan oleh Imorou Toko et al. ( 2018 ) untuk O. niloticus yang dipelihara selama musim hujan di lingkungan tercemar (Batran). Namun, nilai-nilai kami lebih tinggi daripada yang diperoleh oleh Pèlèbè et al. ( 2020 ) untuk O. niloticus yang dipelihara di reservoir yang sama selama musim hujan selama lebih dari 120 hari. Perbedaan ini menyoroti dampak potensial penggunaan pestisida selama musim hujan dan variasi temporal dalam praktik fitosanitasi terhadap pertumbuhan dan perkembangan O. niloticus . Peningkatan pertambahan berat akhir yang diamati di lingkungan tercemar dapat dikaitkan dengan tiga faktor utama. Pertama, peningkatan suhu di lingkungan tercemar. Kedua, pengurangan residu pestisida akibat penghentian produksi kapas dan penurunan aktivitas pertanian lainnya selama musim kemarau kemungkinan berkontribusi pada peningkatan kesehatan dan pertumbuhan ikan. Ketiga, tidak seperti kolam beton yang digunakan di lingkungan kontrol, ikan yang dibesarkan di lingkungan yang tercemar memiliki kontak langsung dengan lumpur akuatik. Kontak ini kemungkinan menyediakan akses ke mikrobiota alami, seperti plankton, yang melengkapi pakan yang diberikan, sehingga meningkatkan kinerja pertumbuhan, yang ditunjukkan oleh efisiensi pemanfaatan protein yang lebih rendah di lingkungan yang tercemar, meskipun tingkat konversi pakan tidak berbeda menurut lokasi atau dari waktu ke waktu.
5 Keterbatasan Penelitian dan Arah Penelitian ke Depan
Sementara studi kami memberikan hasil penting tentang dampak limbah ladang kapas pada O. niloticus , beberapa keterbatasan perlu diakui. Pertama, variabilitas lingkungan yang melekat antara Waduk Batran alami dan cekungan SRIA yang terkontrol dalam hal fluktuasi suhu dan dinamika pH memperkenalkan faktor pengganggu yang tidak dapat dihindari, meskipun mereka berada dalam batas ambang batas. Ketimpangan ini, meskipun mewakili secara ekologis, mempersulit isolasi efek spesifik polutan dari variasi hidrologi alami. Kedua, ruang lingkup parameter kualitas air yang diukur terbatas (suhu dan pH dipantau selama periode percobaan). Tidak adanya data tentang karbon dioksida bebas, alkalinitas, kekerasan, konduktivitas, amonia, nitrat, nitrit dan COD membatasi kedalaman interpretasi lingkungan dan kemampuan untuk sepenuhnya memahami dampak limbah pertanian pada ekosistem perairan. Ketiga, studi yang difokuskan pada musim kemarau menghalangi ekstrapolasi ke kondisi musim hujan ketika limpasan pestisida kemungkinan lebih intens, yang berpotensi mengubah dinamika paparan dan respons fisiologis. Namun, temuan musim kemarau menetapkan dasar penting untuk dampak polutan tanpa adanya masukan pestisida baru-baru ini, mengisolasi efek kronis dari kontaminan lama atau bahan kimia pertanian yang tersisa. Ini memberikan perkiraan konservatif dampak polusi, yang relevan dengan wilayah dengan siklus pertanian musiman. Keterbatasan lain dari studi ini adalah tidak adanya analisis langsung limbah pertanian dari lingkungan yang tercemar karena studi sebelumnya yang dilakukan dalam unit penelitian kami dan limpasan yang disebabkan irigasi minimal ke lokasi studi kami selama musim kemarau. Akhirnya, kurangnya pemantauan konsentrasi kontaminan berkelanjutan di lingkungan yang tercemar membatasi korelasi dosis-respons yang tepat, karena fluktuasi temporal dalam beban bahan kimia pertanian tidak dikuantifikasi.
Berdasarkan studi ini, studi mendatang harus menyelidiki dampak periode paparan yang lebih lama, dengan mempertimbangkan keseluruhan durasi musim kemarau, untuk menilai dampak jangka panjang pada kinerja pertumbuhan dan menggabungkan rentang pengukuran kualitas air yang lebih luas untuk memberikan pemahaman yang lebih holistik tentang kondisi lingkungan yang memengaruhi sistem akuakultur. Gunakan mesocosms eksperimental yang mensimulasikan kondisi lapangan sambil memungkinkan pemberian dosis terkontrol dari agrokimia tertentu, yang memungkinkan investigasi mekanistik terhadap efek polutan individual. Selain itu, studi mendatang harus mengintegrasikan pelacakan kontaminan tingkat lanjut, seperti analisis residu pestisida frekuensi tinggi yang dipasangkan dengan sensor lingkungan waktu nyata, untuk membangun hubungan dosis-respons yang lebih kuat. Selain itu, studi juga harus memperluas penilaian biomarker (indikator stres oksidatif, uji genotoksisitas) untuk menjelaskan jalur molekuler yang mendasari respons imun dan pertumbuhan yang diamati. Penelitian mendatang harus menggabungkan parameter utama seperti indeks hepatosomatik, pemanfaatan protein bersih yang tampak, dan komposisi proksimat karkas. Metrik ini memberikan wawasan penting tentang status gizi, efisiensi metabolisme, dan kesehatan ikan secara keseluruhan, untuk mendapatkan pemahaman yang lebih mendalam tentang bagaimana pestisida memengaruhi spesies akuakultur. Terakhir, bandingkan sistem akuakultur regional di seluruh zona agroekologi untuk mengidentifikasi strategi mitigasi khusus konteks guna mengurangi dampak polusi pertanian.
6 Kesimpulan
Studi saat ini menilai respons imun, hematologi, dan pertumbuhan O. niloticus yang terpapar limbah pertanian selama musim kemarau. Studi ini memberikan bukti bahwa O. niloticus yang dibesarkan di Waduk Batran selama musim kemarau menunjukkan kinerja pertumbuhan yang kurang terganggu dan disregulasi imun yang terbatas dibandingkan dengan kontrol. Meskipun tidak adanya imunosupresi kontras dengan efek polutan yang dihipotesiskan, dampak fisiologis yang berkurang mungkin mencerminkan bioavailabilitas kontaminan yang lebih rendah selama periode non-aplikasi, seperti yang disimpulkan dari praktik pertanian regional. Temuan ini menunjukkan bahwa selama musim kemarau, ikan mengalami efek paparan residu pestisida yang berkurang, kemungkinan karena tidak adanya masukan segar dari limpasan pertanian dan sumber antropogenik lainnya. Temuan kami menyoroti potensi variasi temporal dalam polusi pertanian untuk memodulasi kesehatan organisme akuatik, yang menekankan perlunya strategi manajemen khusus konteks dalam sistem akuakultur yang terintegrasi secara agro-ekologi.



