Abstrak
- Efek gabungan dari tekanan antropogenik dan perubahan iklim menimbulkan ancaman signifikan terhadap spesies pembentuk habitat utama, seperti lamun. Memahami respons spesies terhadap stresor lingkungan dan mengidentifikasi ambang batas toleransi mereka sangat penting untuk upaya konservasi dan pemulihan yang efektif di lingkungan pesisir.
- Melalui eksperimen mesocosm, kami menilai respons metabolik Posidonia oceanica dalam kondisi yang realistis secara ekologis di tiga periode musiman (Februari–Maret, Juni–Juli, dan Oktober–November) saat tanaman secara alami beradaptasi dengan rezim suhu yang berbeda. Dalam setiap periode, kami menguji respons tanaman terhadap variasi suhu kecil (suhu sekitar dan dua langkah peningkatan sebesar 2°C) yang disilangkan dengan empat tingkat kekeruhan (0, 4, 16, dan 34 mg/L), yang memungkinkan konstruksi kurva kinerja termal yang realistis secara ekologis.
- Temuan kami mengungkap bahwa kekeruhan dapat mengganggu fungsi P. oceanica , termasuk penurunan kinerja termal dan jendela toleransi termal yang menyempit, mengganggu fotosintesis dan berpotensi membatasi pertumbuhan. Metabolisme meningkat dengan suhu hingga optimum termal (T opt ) yang diidentifikasi pada 23°C untuk semua tingkat perlakuan kekeruhan dan waktu paparan. Kami menunjukkan relevansi sifat stresor pada respons P. oceanica , dengan individu yang terpapar pada perlakuan yang lebih ekstrem (kekeruhan tinggi (34 mg/L) dan peningkatan waktu paparan (7 hari)) menunjukkan toleransi termal optimal yang berkurang dibandingkan dengan kontrol.
- Sintesis dan aplikasi . Mengintegrasikan respons organisme terhadap stresor lingkungan ke dalam protokol pemantauan dapat memberikan indikator peringatan dini kesehatan ekosistem. Pendekatan ini memperkuat inisiatif konservasi dan restorasi, mendukung keputusan kebijakan dalam menghadapi peningkatan pembangunan pesisir dan perubahan iklim.
1. PENDAHULUAN
Ekosistem di seluruh dunia mengalami degradasi yang signifikan, menjadikan pemulihan dan konservasi mereka tantangan utama bagi komunitas ilmiah, manajer dan pembuat kebijakan (Maes et al., 2024 ). Memahami fungsi ekosistem sangat penting untuk menjaga stabilitas, produktivitas dan ketahanan ekosistem (Hooper et al., 2005 ). Ciri-ciri fungsional spesies, seperti luas daun dan panjang akar pada tanaman, memainkan peran kunci dalam proses seperti penyerapan karbon dan stabilisasi tanah yang mendukung layanan ekosistem yang penting untuk kesejahteraan manusia (Reich, 2014 ). Mengidentifikasi ambang batas fungsional dalam menanggapi perubahan lingkungan sangat penting bagi para ahli ekologi, konservasionis dan pengelola habitat alami, khususnya di wilayah pesisir yang menghadapi tekanan yang meningkat dari stresor antropogenik, termasuk perubahan iklim (Hughes et al., 2017 ; Suding et al., 2004 ; Worm et al., 2006 ).
Secara tradisional, strategi konservasi dan restorasi berfokus pada ambang batas ekologis—titik kritis yang menentukan kemampuan ekosistem untuk mempertahankan struktur dan fungsinya seiring waktu dalam menghadapi gangguan eksternal (Hobbs & Norton, 2004 ; Isbell, 2022 ). Ambang batas ini khususnya relevan untuk spesies pembentuk habitat laut (seperti lamun dan karang; Maes et al., 2024 ; NOAA, 2020 ), yang bertindak sebagai produsen primer dan memfasilitasi pertumbuhan, kelangsungan hidup, dan reproduksi spesies lain dalam ekosistem (Orth et al., 2006 ; Waycott et al., 2009 ).
Dalam konteks ini, menyelidiki sifat metabolik spesies pembentuk habitat menjadi semakin penting untuk mengevaluasi efektivitas tindakan konservasi dan memprediksi hasil restorasi (Foley et al., 2017 ; NOAA, 2020 ). Sifat fungsional utama, seperti respirasi dan produksi oksigen, memberikan wawasan berharga tentang kinerja ekologi dan fungsionalitas spesies ini dan berfungsi sebagai indikator keberhasilan mereka dalam berbagai kondisi lingkungan (Brandl et al., 2023 ; Violle et al., 2012 ). Lebih jauh lagi, sifat-sifat ini membantu mengidentifikasi ambang batas kritis untuk ketahanan habitat di bawah berbagai pemicu stres. Ini sangat penting di wilayah pesisir tempat berbagai pemicu stres berinteraksi, memengaruhi stabilitas dan persistensi spesies pembentuk habitat (Gunderson et al., 2016 ; Jackson et al., 2021 ). Oleh karena itu, mengintegrasikan sifat fungsional spesies ke dalam strategi konservasi, pengelolaan, dan restorasi sangat penting untuk memastikan bahwa tindakan tersebut efektif dan baik secara ekologis.
Di antara spesies pembentuk habitat laut, lamun Posidonia oceanica (L.) Delile merupakan studi kasus penting di Laut Mediterania. Spesies endemik ini memainkan peran penting dalam ekosistem pesisir (Program, 2020 ) dengan membentuk padang rumput berkelanjutan pada kedalaman 0,5 hingga 50 m (tergantung pada ketersediaan cahaya). Padang rumput ini merupakan habitat utama yang terstruktur dengan nilai sosial-ekonomi dan ekologi yang signifikan, menyediakan tempat berlindung bagi banyak spesies dan berkontribusi pada banyak layanan ekosistem, termasuk penyerapan karbon, produksi oksigen, perlindungan erosi garis pantai, sanitasi air dan daur ulang nutrisi (Boudouresque et al., 2009 , 2012 ; Campagne et al., 2015 ; Costanza et al., 1997 ; Danovaro & Boero, 2019 ; Scanu et al., 2022 ). Karena relevansinya secara ekologis, padang rumput P. oceanica dikatalogkan sebagai habitat prioritas untuk konservasi oleh UE (Salomidi et al., 2012 ); namun, meskipun spesies tersebut terdaftar sebagai ‘risiko paling kecil’ pada Daftar Merah IUCN (Pergent et al., 2016 ), studi terbaru telah mendokumentasikan penurunan yang signifikan dalam kinerjanya—hingga 51% pengurangan produksi selama dua dekade terakhir—yang didorong oleh meningkatnya suhu permukaan laut, gelombang panas laut yang lebih sering, dan stresor antropogenik lainnya (Capello et al., 2014 ; Litsi-Mizan et al., 2023 ; Stipcich et al., 2022 ; Waycott et al., 2009 ).
Studi terbaru telah menunjukkan bahwa P. oceanica menampilkan pertumbuhan optimal antara 17 dan 20°C, dengan stres termal terjadi di atas 28°C (Rinaldi et al., 2023 ; Savva et al., 2018 ). Tutupan dan kepadatan spesies ini secara signifikan dipengaruhi oleh fluktuasi suhu musiman ini, karena respons metaboliknya sangat bergantung pada suhu (Weber et al., 2017 ). Namun, sementara beberapa penelitian telah menyelidiki respons stres di lamun, studi khusus tentang toleransi P. oceanica terhadap berbagai stresor lingkungan yang berinteraksi masih langka (Ceccherelli et al., 2018 ; Gunderson et al., 2016 ; Marín-Guirao et al., 2018 ). Kesenjangan pengetahuan ini sangat penting dalam memahami bagaimana toleransi termal dimodifikasi oleh tekanan antropogenik lainnya. Kekeruhan adalah salah satu stresor antropogenik paling signifikan yang memengaruhi produsen primer laut, sering diperburuk oleh aktivitas manusia seperti pengerukan dan pembangunan pesisir (Gacia & Duarte, 2001 ). Peningkatan kekeruhan mengurangi ketersediaan cahaya, menghambat proses penting seperti fotosintesis, pertukaran gas daun dan penyerapan nutrisi (Brodersen et al., 2017 ; Orth et al., 2006 ; Ruiz & Romero, 2003 ). Selain itu, pengendapan sedimen pada daun lamun dapat menciptakan hambatan fisik untuk pertukaran gas dan semakin memperburuk stres fisiologis. Peristiwa ekstrem yang diperburuk oleh perubahan iklim dapat semakin menambah tingkat kekeruhan di wilayah pesisir melalui peningkatan frekuensi dan intensitas badai, yang menyebabkan periode resuspensi sedimen yang berkepanjangan (Fettweis et al., 2010 ). Yang penting, kekeruhan dan pengayaan nutrisi saling terkait erat, karena limpasan nutrisi dari daerah pesisir dapat meningkatkan kejadian eutrofik, meningkatkan kekeruhan dan pengendapan sedimen, yang menekan lamun (Ceccherelli et al., 2018 ). Stresor sinergis ini secara signifikan merusak ketahanan P. oceanica , dengan pengayaan nutrisi memperburuk efek penguburan sedimen dan mempercepat keruntuhan lamun, yang menyoroti interaksi antara redaman cahaya dan eutrofikasi. Ketahanan produsen primer pembentuk habitat terhadap stresor ini, terutama mengingat efek tidak langsung yang disebabkan oleh perubahan iklim seperti perubahan tingkat salinitas dan perubahan ketersediaan cahaya (Mancuso et al., 2023)), memerlukan pemahaman menyeluruh tentang respons ekologis dan biologisnya, termasuk penyesuaian fisiologis seperti regulasi osmotik dan perubahan morfologis seperti pertumbuhan yang berkurang dan peningkatan nekrosis jaringan. Sementara berbagai penelitian telah meneliti efek independen dari suhu (Litsi-Mizan et al., 2023 ; Marín-Guirao et al., 2018 ; Rinaldi et al., 2023 ; Savva et al., 2018 ) dan kekeruhan (González-Correa et al., 2008 ; Ruiz & Romero, 2001 , 2003 ) pada P. oceanica , efek interaktifnya masih kurang dipahami.
Di sini, kami merancang eksperimen mesocosm di tiga periode musiman (musim dingin, musim panas, dan musim gugur) untuk menilai bagaimana kekeruhan memengaruhi toleransi termal spesies pembentuk habitat endemik ini dalam kondisi suhu alami. Kami menyelidiki bagaimana sifat metabolisme P. oceanica merespons berbagai tingkat kekeruhan dan suhu melalui pengukuran laju respirasi, produksi primer bruto dan netto, serta aktivitas fotosintesis (melalui analisis fluoresensi klorofil -a ). Kami berhipotesis bahwa kekeruhan yang meningkat dan peningkatan suhu akan berinteraksi untuk memengaruhi laju metabolisme P. oceanica , mengurangi aktivitas fotosintesis, dan mempersempit lebar toleransi termal (Sokolova et al., 2012 ).
2 BAHAN DAN METODE
Studi kami dirancang untuk menilai respons P. oceanica dalam kondisi lingkungan yang realistis secara ekologis. Daripada memaksakan rentang suhu yang lebar secara artifisial pada satu titik waktu, kami secara strategis melakukan eksperimen kami selama tiga periode musiman yang berbeda yang mencerminkan variasi suhu alami di habitat P. oceanica . Tugas ini dicapai dengan membagi periode waktu 12 bulan menjadi tiga periode eksperimen yang berbeda. Setiap periode disesuaikan untuk mencerminkan rezim suhu alami yang menjadi ciri habitat spesies, berdasarkan data variasi suhu dari lokasi pengambilan sampel di lepas pantai Civitavecchia di Laut Tyrrhenian utara (Italia), dan ceruk termal spesies yang diamati (Lampiran S1 : Gambar S1 ). Wilayah ini tunduk pada fluktuasi musiman alami dan tekanan antropogenik, termasuk aktivitas pengerukan yang memengaruhi tingkat kekeruhan lokal, menjadikannya tempat yang ideal untuk memeriksa interaksi stresor suhu dan kekeruhan. Periode pertama (Februari–Maret, dengan suhu berkisar antara 14 hingga 15°C) mencakup suhu minimum yang biasanya dialami oleh P. oceanica . Periode kedua (Juni–Juli, dengan suhu berkisar antara 22 hingga 28°C) mencakup suhu tertinggi yang dialami oleh tanaman, sedangkan periode ketiga (Oktober–November, dengan suhu berkisar antara 19 hingga 24°C) sangat cocok dengan kisaran suhu optimum potensial untuk P. oceanica (Lampiran S1 : Gambar S1 ).
2.1 Perawatan eksperimental
Penelitian ini mencakup total 9 suhu yang disilangkan dengan 4 tingkat kekeruhan.
Suhu: masing-masing dari tiga periode eksperimen mencakup tiga tingkat suhu: suhu air laut sekitar tempat P. oceanica dikumpulkan dan dua langkah peningkatan sebesar 2°C untuk total 9 suhu yang diuji selama penelitian (periode pertama = 15°C sekitar, 17°C, 19°C; periode kedua = 27°C sekitar, 29°C, 31°C; periode ketiga = 21°C sekitar, 23°C, 25°C).
Kekeruhan: untuk mewakili spektrum luas konsentrasi sedimen, empat tingkat kekeruhan progresif (0, 4, 16 dan 34 mg/L) dipilih, konsisten dengan nilai yang dilaporkan untuk lingkungan laut Civitavecchia (Piazzolla et al., 2018 ). Batas atas (34 mg/L) disertakan untuk mensimulasikan kondisi yang melebihi persentil ke-90 dari distribusi konsentrasi sedimen yang diamati di area ini, sejalan dengan pedoman nasional yang mendorong pertimbangan variabilitas spesifik lokasi (ISPRA, 2016 ). Menyadari bahwa pengukuran lokal sering kali menangkap kondisi umum tetapi mungkin meremehkan kejadian ekstrem, kami bertujuan untuk menyertakan tingkat kekeruhan yang lebih tinggi untuk menilai dampak potensial pada padang lamun. Sedimen dikumpulkan pada kedalaman 50 m di dekat lokasi pengambilan sampel P. oceanica . Di laboratorium, sedimen diayak dengan menahan fraksi yang lebih kecil dari 63 μm (lempung-lanau), yang kemudian ditempatkan pada suhu 450°C semalaman untuk menghilangkan kontaminasi biologis apa pun. Sedimen yang dihasilkan sebagian besar berukuran lanau, karakteristik gumpalan pengerukan (Piazzolla et al., 2018 ). Mengingat sedimen pada kedalaman 50 m mengandung sejumlah besar partikel halus (<63 μm), yang dapat dengan mudah tersuspensi kembali ke kedalaman yang lebih dangkal, tingkat kekeruhan yang dipilih kemungkinan mewakili kondisi yang mungkin dialami padang lamun pada kedalaman 10 m, terutama di area yang terkena dampak aktivitas pesisir seperti pengerukan. Sedimen ditambahkan ke tangki untuk memperoleh empat tingkat kekeruhan perlakuan, dan sistem sirkulasi digunakan untuk mempertahankan tingkat kekeruhan yang konstan. Tingkat kekeruhan diperiksa setiap hari dan disesuaikan sesuai kebutuhan untuk mempertahankan konsentrasi target.
2.2 Pengambilan sampel dan pengaturan laboratorium
Sebanyak 324 pucuk ortotropik P. oceanica yang sehat dan tidak rusak , termasuk rimpang dan akar (108 pucuk per periode, 9 pucuk per kombinasi perlakuan), dikumpulkan pada tahun 2023 dengan penyelaman SCUBA pada kedalaman 10 m, sekitar 300 m dari pantai Civitavecchia (Lat: 42.076562, Long: 11.802896, Italia), di Laut Tyrrhenian utara (tidak diperlukan otorisasi khusus untuk pengambilan sampel). Pucuk-pucuk dengan panjang daun dan rimpang yang sama (rata-rata ± SD: panjang daun = 40,0 ± 11,7 cm, panjang rimpang = 9,2 ± 3,3 cm) dipilih untuk mengurangi efek variabilitas morfologi antara pucuk-pucuk dengan usia yang berbeda (Ruocco et al., 2019 ; Tomasello et al., 2016 ). Setelah dikumpulkan, tunas-tunas tersebut diangkut ke laboratorium (sekitar 15 menit dengan perahu) dalam pendingin yang diisi dengan air laut yang bersuhu ruangan dan berventilasi. Tanaman dipelihara dalam kondisi lingkungan yang mirip dengan lokasi pengambilan sampel selama 48 jam sebelum percobaan (Gambar 1 , Lampiran S1 : Gambar S2 , Tabel S1 ).
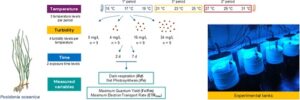
Untuk setiap periode eksperimen, pengaturan terdiri dari tiga tingkat suhu (suhu air laut sekitar dan dua langkah peningkatan sebesar 2°C) yang disilangkan dengan empat tingkat kekeruhan (0, 4, 16 dan 34 mg/L), menghasilkan total 12 perlakuan dalam 12 tangki PVC silinder (30 L). Setelah aklimatisasi, sembilan pucuk P. oceanica dipilih secara acak, diberi label, dipasang pada jaring PVC dan kemudian ditempatkan dalam setiap tangki eksperimen. Awalnya, semua tangki diatur ke suhu air laut sekitar tanpa mempedulikan tingkat kekeruhan. Selanjutnya, suhu dalam tangki yang dipilih dinaikkan pada kecepatan 1°C per jam hingga mencapai tingkat target yang ditentukan untuk perlakuan termal (misalnya Bosch-Belmar et al., 2022 ; Prusina et al., 2014 ). Setelah semua tangki mencapai suhu target masing-masing, mereka dibiarkan beraklimatisasi selama 48 jam. Pengukuran metabolik kemudian dilakukan setelah 2 hari dan diulang setelah 7 hari paparan terus-menerus dalam kondisi yang sama. Pengukuran untuk semua perlakuan dilakukan secara serentak dalam setiap periode (yaitu di semua 12 tangki pada waktu yang sama), untuk memastikan durasi paparan yang sama sebelum pengukuran. Daun yang diukur dari masing-masing 9 pucuk bersifat independen dan tidak digunakan kembali antara pengukuran 48 jam dan 7 hari.
Tangki memiliki bentuk kerucut-silinder di bagian dasar untuk mengurangi pengendapan sedimen pada permukaan horizontal (Gambar 1 ). Tangki diisi dengan air laut yang disaring 1,2 μm (Whatman GF/C), yang dijaga sirkulasinya oleh penggerak magnet, pompa sentrifugal yang mengumpulkan air dari atas tangki dan memaksa aliran naik dari titik tengah piramida terbalik di bagian dasar untuk mempertahankan tingkat kekeruhan yang konstan. Cahaya disediakan oleh susunan LED yang dibuat khusus yang digantung di atas setiap tangki. Setiap lampu terdiri dari 6 baris LED biru (400–540 nm) dan 5 baris LED hijau (520–565 nm) untuk mereproduksi karakteristik distribusi spektral kedalaman 10 m. Unit kontrol mengatur fotoperiode dan intensitas cahaya sepanjang hari untuk mensimulasikan kondisi alamiah. Cahaya sangat homogen, dengan iradiasi rata-rata yang sesuai dengan 50, 80 dan 92 μmol kuanta m −2 s −1 (diukur tepat di bawah permukaan air laut setiap tangki menggunakan sensor kuantum spektrum penuh Apogee SQ-520) untuk periode pertama, kedua dan ketiga, masing-masing (Madonia et al., 2021 ). Intensitas cahaya ini diperkirakan melalui model matematika yang mampu memperkirakan Radiasi Aktif Fotosintesis (PAR) di permukaan laut dan sepanjang kolom air sebagai fungsi waktu dan lokasi geografis (Marcelli et al., 2005 ; Piermattei et al., 2006 ). Model yang digunakan sebagai input adalah profil vertikal in situ dari iradiasi spektral ke bawah yang diukur di area pengambilan sampel di lepas pantai Civitavecchia, tempat tunas Posidonia oceanica dikumpulkan, menggunakan radiometer multispektral Satlantic OCR-507. Pengukuran yang diperoleh dari lapangan ini menginformasikan kondisi cahaya yang diterapkan dalam percobaan mesocosm.
Air laut dalam setiap akuarium diangin-anginkan dan dipantau setiap hari untuk suhu (±0,1°C), pH (±0,01, WTW Multi 3420) dan salinitas (±0,1). Air diganti seluruhnya setiap 3 hari. Tingkat salinitas dijaga konstan pada 35 psu dengan memasok air osmotik sesuai kebutuhan. Suhu air dalam tangki dipantau terus-menerus menggunakan logger HOBO Pendant dan dipertahankan pada kondisi perawatan menggunakan pengontrol termostatik.
2.3 Pengukuran metabolik
2.3.1 Respirasi dan fotosintesis bersih
Untuk setiap tingkat perlakuan, kami memperkirakan produksi dan konsumsi oksigen dalam sembilan daun individu pucuk percobaan P. oceanica . Setiap individu ditempatkan dalam ruang respirometri terpisah (270 mL) yang diisi dengan air laut jenuh udara yang telah disaring (Whatman GF/F 0,7 μm). Sebagai kontrol, tiga ruang respirometri hanya diisi dengan air laut yang telah disaring. Air laut dalam setiap ruang diaduk secara konsisten menggunakan batang magnet dan alat pengaduk individu. Selanjutnya, ruang respirometri ditempatkan dalam penangas air yang suhunya terkontrol (Grant Optima TX150), dan konsentrasi oksigen terlarut diukur menggunakan tiga meter oksigen optik (PyroScience Firesting O 2 ). Setiap meter dilengkapi dengan empat optode dan probe kompensasi suhu. Sebelum setiap inkubasi, elektroda oksigen dikalibrasi menggunakan metode 1 titik pabrikan (100% air jenuh udara).
Konsentrasi oksigen terlarut kemudian dipantau dalam kondisi gelap setiap detik selama setidaknya 90 menit setelah kemiringan oksigen terlarut terhadap waktu telah stabil. Setelah itu, lampu dinyalakan, dan konsentrasi oksigen diukur selama 90 menit lagi. Ruang respirometri dikalibrasi untuk mereplikasi spektrum cahaya dan intensitas tangki perlakuan eksperimental, memastikan konsistensi dengan kondisi yang dialami oleh Posidonia oceanica dalam berbagai tingkat perlakuan.
Laju respirasi gelap ( Rd ) dan fotosintesis bersih ( Pn ) masing-masing diukur dalam kondisi gelap dan terang, dan dihitung menggunakan persamaan berikut (Rosewarne et al., 2016 ; Svendsen et al., 2016 ):

di mana VR adalah volume air laut efektif (L) dari ruang respirometri, g adalah berat kering (DW, 48 jam pada 60°C) sebagaimana dinyatakan dalam gram P. oceanica dan β adalah kemiringan garis regresi antara konsentrasi oksigen dan waktu inkubasi. Sementara Rd menunjukkan respirasi gelap yang terjadi saat tidak ada cahaya, Pn menangkap efek bersih fotosintesis dan respirasi selama kondisi terang. Ini menunjukkan keseimbangan antara oksigen yang diproduksi melalui fotosintesis dan oksigen yang dikonsumsi melalui respirasi selama waktu tersebut. Produksi primer bersih (NPP) dihitung dengan mengurangi Rd dari Pn ( NPP = Pn − Rd ) (Falkowski & Raven, 2007 ). Oleh karena itu, NPP menunjukkan produksi primer bersih setelah memperhitungkan respirasi terang dan gelap, memberikan perkiraan akumulasi karbon organik aktual oleh P. oceanica dari waktu ke waktu (Falkowski & Raven, 2007 ).
2.3.2 Klorofil- a fluoresensi
Pada akhir pengukuran inkubasi, aktivitas fotosintesis setiap individu P. oceanica dinilai dengan mengukur fluoresensi klorofil -a fotosistem II (PSII) in vivo dengan fluorometer modulasi amplitudo pulsa portabel (Junior-PAM, Waltz). Untuk setiap sampel, Kurva Cahaya Cepat (RLC) dilakukan untuk mengevaluasi perbedaan kapasitas fotosintesis P. oceanica pada tingkat iradiasi yang berbeda. Untuk memastikan pengukuran yang andal, RLC dilakukan segera setelah P. oceanica beradaptasi dengan kondisi cahaya (berasal dari pengukuran NPP) untuk mencegah tanaman beradaptasi dengan gelap (Beer et al., 2014 ). RLC diperoleh dengan menghitung laju transpor elektron (ETR) melalui PSII untuk sembilan kerapatan fluks kuantum tambahan dari Radiasi Aktif Fotosintesis (PAR) (0, 66, 90, 125, 190, 285, 420, 625, 845 μmol foton m −2 s −1 ) selama 20 detik. ETR dihitung sebagai:
![]()
di mana ΦPSII adalah hasil kuantum efektif dari PSII yang dihitung menurut (Genty et al., 1989 ) sebagai ΦPSII = ( F m′- F t)/Fm, diperoleh dengan menerapkan pulsa cahaya jenuh pada setiap tingkat iradiasi; PAR adalah iradiasi insiden PAR; AF adalah faktor penyerapan, yang merupakan fraksi PAR yang diserap oleh daun. Itu dihitung dengan menutupi sensor kuantum dengan daun P. oceanica dan menghitung fraksi PAR yang diserap oleh daun sebagai AF = (PAR insiden – PAR yang ditransmisikan)/PAR insiden (Beer et al., 2014 ). Akhirnya, faktor 0,5 mewakili distribusi foton antara fotosistem II dan I, dengan asumsi bahwa 4 dari 8 elektron yang diperlukan untuk mengasimilasi 1 molekul CO 2 dipasok oleh PSII (Beer et al., 2014 ). Laju transpor elektron maksimum (ETR max ), penaksir produksi fotosintesis, diperoleh dari fungsi tangensial yang dilaporkan oleh Eilers dan Peeters (Eilers & Peeters, 1988 ).
Hasil kuantum maksimum ( F v / F m ) ditentukan pada sampel yang beradaptasi dengan gelap selama 15 menit; waktu ini sebelumnya diperkirakan cukup bagi P. oceanica untuk mengoksidasi pusat reaksi fotosistem II. Seperti yang dilaporkan untuk lamun lainnya, usia daun P. oceanica dapat memengaruhi parameter fluoresensi (Enríquez et al., 2002 ). Oleh karena itu, fluoresensi diukur tiga kali untuk setiap individu P. oceanica , dimulai dari 4 cm dari pangkal daun. Rata-rata dari ketiga replikasi ini dipertimbangkan dalam analisis berikut. Kemudian, kami mengukur fluoresensi minimum (basal) ( F o ) dan fluoresensi maksimum ( F m ) setelah pulsa saturasi (9000 mmol foton m −2 s −1 , 800 ms) cahaya aktinik dan memperkirakan hasil kuantum maksimum sebagai F v / F m = ( F m − F o )/ F m (Murchie & Lawson, 2013 ). Rasio F v / F m menunjukkan hasil potensial maksimum dan biasanya digunakan sebagai ukuran stres yang memengaruhi komponen fotosistem II, seperti protein D1 (Beer et al., 2014 ).
2.4 Analisis data
Untuk setiap tingkat perawatan yang diselidiki, kinerja P. oceanica dimodelkan dengan norma reaksi nonlinier kontinu (yaitu Kurva Kinerja Termal—TPC) menggunakan jalur rTPC (Padfield et al., 2021 ) di lingkungan perangkat lunak R (v. 4.4.2). Model regresi kuadrat terkecil nonlinier (NLLS) terbaik dipilih dari 27 yang disediakan dalam paket ‘rTPC’ (v. 1.0.2). Dari 27 model yang diuji, 6 dihapus karena gagal menyesuaikan data (lihat Informasi Pendukung untuk detail lebih lanjut). Pemilihan model terbaik didasarkan pada kriteria AICc (Angilletta, 2006 ), dan model dalam delta 2 AICc dipertahankan. Di antara model yang dipilih, pilihan akhir dibuat berdasarkan model yang paling sesuai dengan respons P. oceanica di semua tingkat kekeruhan. Setelah mengidentifikasi model dengan prediksi terbaik, asumsi model dinilai secara visual menggunakan fungsi ‘test.nlsResiduals’ dari paket ‘nlstools’ (Baty et al., 2015 ). Selain itu, fungsi ini melakukan pengujian formal untuk menilai kenormalan residual dan autokorelasi. Transformasi akar kuadrat diterapkan untuk memenuhi asumsi model. Selanjutnya, prosedur bootstrapping digunakan dengan mengambil sampel ulang data untuk memperkirakan prediksi model dan interval kepercayaan parameter. Parameter TPC, seperti suhu optimal ( T opt ), keluasan kinerja termal ( T br ) dan laju pada suhu optimum (μmax) diperkirakan untuk setiap model yang dipilih dan digunakan untuk secara mekanistis menggambarkan variasi lamun dalam sensitivitas termal dan kekeruhan. Secara khusus, T br dihitung sebagai rentang suhu di mana laju kurva berada di atas 69% dari nilai maksimum (Caretto et al., 2015 ; Matzelle et al., 2015 ).
3 HASIL
Suhu dan kekeruhan secara signifikan memengaruhi kinerja fisiologis P. oceanica , dengan penurunan kinerja secara umum yang diamati seiring dengan meningkatnya kekeruhan dan waktu paparan. Efek-efek ini disertai dengan kontraksi dalam rentang toleransi termal, yang menyoroti sensitivitas spesies terhadap stresor lingkungan ini.
3.1 Respirasi dan fotosintesis bersih
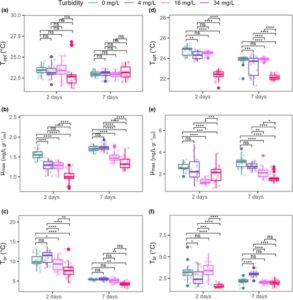
Kami mengamati bahwa tingkat kekeruhan menengah (16 mg/L) dan tinggi (34 mg/L) menyebabkan penurunan kuat sebesar 40% hingga 50% dalam kinerja termal P. oceanica . Di seluruh rentang suhu yang diselidiki (15–31°C), laju fotosintesis bersih ( Pn ) P. oceanica mengikuti hubungan yang bergantung pada suhu dengan respons nonlinier khas di semua tingkat kekeruhan dan waktu yang diselidiki (Gambar 2a,b ). Secara keseluruhan, Pn meningkat dengan suhu hingga optimum termal ( T opt ) yang diidentifikasi pada 23°C untuk semua tingkat dan waktu kekeruhan (Gambar 2a,b ; Lampiran S1 : Tabel S2 ). Peningkatan kekeruhan menyebabkan penurunan kinerja Pn (μ max ) dan penyempitan jendela toleransi termal ( T br ; Gambar 2 , Lampiran S1 : Tabel S2 ). Bahasa Indonesia: Setelah 2 hari perawatan, perawatan kekeruhan tertinggi (34 mg/L) memberikan efek lebih besar pada Pn P. oceanica , dengan nilai yang jauh lebih rendah dibandingkan dengan perawatan lainnya. Setelah 7 hari, kami mengamati pengurangan keseluruhan dalam napas ( T br ) dari TPC di semua tingkat kekeruhan dan peningkatan keseluruhan dalam nilai Pn (Gambar 3 , Lampiran S1 : Tabel S2 ). Selain itu, ada tumpang tindih TPC antara tingkat kekeruhan 0 dan 4 mg/L yang menyajikan nilai kinerja yang jauh lebih tinggi dibandingkan dengan perawatan 16 dan 34 mg/L yang cenderung mengelompok di sekitar satu sama lain (Gambar 2 , Lampiran S1 : Tabel S2 ).
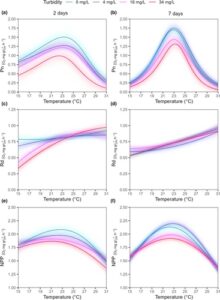
Berbeda dengan laju fotosintesis bersih, laju respirasi gelap ( Rd ) meningkat hingga 31°C tanpa identifikasi suhu optimum (Gambar 2c,d ). Selain itu, tidak ada efek yang terlihat dari peningkatan kekeruhan pada Rd , kecuali fakta bahwa setelah 2 hari kami mengamati nilai Rd yang lebih rendah pada suhu 15–19°C di bawah tingkat kekeruhan 16 dan 34 mg/L dibandingkan dengan perlakuan kekeruhan lainnya (Gambar 2c,d ).
Produksi Primer Bersih (NPP) P. oceanica menunjukkan tren Pn yang serupa , dengan NPP meningkat dengan suhu hingga optimum ( T opt = 23°C) dan penurunan kinerja (μ max ) yang disebabkan oleh peningkatan tingkat kekeruhan (Gambar 2e,f ; Lampiran S1 : Tabel S2 ). Namun, berbeda dengan Pn , kinerja termal luas ( T br ) NPP meningkat pada tingkat kekeruhan yang tinggi (Gambar 3 , Lampiran S1 : Tabel S2 ).
Secara keseluruhan, pengurangan kinerja sebesar 40% untuk Pn (0,5 O 2 mg gr −1 DW h −1 ) dan 20% untuk NPP (0,2 O 2 mg gr −1 DW h −1 ) diamati dari kontrol ke tingkat kekeruhan tertinggi (34 mg/L), bersama dengan penyempitan jendela toleransi optimal 3–4°C. Khususnya, P. oceanica yang terkena perlakuan lebih ekstrem (kekeruhan tinggi (34 mg/L) dan peningkatan waktu paparan (7 hari)) menunjukkan rentang toleransi termal optimal yang berkurang dari 22 hingga 24°C, sehubungan dengan kontrol (19,5 hingga 26,5°C).
3.2 Klorofil- a fluoresensi
Analisis ETR maks menunjukkan tren serupa dengan apa yang diamati pada respons fisiologis yang dilaporkan sebelumnya, dengan suhu optimum serupa ( T opt ~ 23°C) dan dengan efek keseluruhan berupa peningkatan kekeruhan yang menyebabkan berkurangnya kinerja fotosintesis P. oceanica dan penyempitan rentang toleransi spesies (Gambar 4 ).
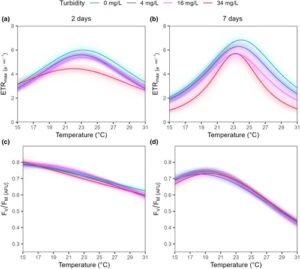
Analisis efisiensi fotosintesis maksimum ( F v/ F m) menunjukkan bagaimana peningkatan suhu menyebabkan penurunan kinerja fotosintesis P. oceanica , sebagaimana dibuktikan oleh nilai F v/ F m yang berkurang. Penurunan ini diperparah dengan peningkatan waktu paparan dan tidak bergantung pada kekeruhan (Gambar 5 ). Selain itu, setelah 7 hari paparan perlakuan, suhu optimum dapat diidentifikasi sebesar 19°C (Gambar 5 , Lampiran S1 : Tabel S3 ).

4 DISKUSI
Percobaan mesocosm kami menggarisbawahi peran penting sifat-sifat pemicu stres dalam memengaruhi respons P. oceanica terhadap kekeruhan dan suhu. Tingkat kekeruhan sedang (16 mg/L) dan tinggi (34 mg/L) secara signifikan memengaruhi kinerja fotosintesis lamun. Paparan yang berkepanjangan terhadap pemicu stres ini semakin melemahkan fungsi spesies, yang menyebabkan penyempitan jendela toleransi termalnya hingga 3–4°C. Temuan ini menyoroti kerentanan P. oceanica terhadap pemicu stres lingkungan gabungan, yang menekankan kebutuhan mendesak untuk mengintegrasikan pemahaman tentang bagaimana organisme merespons interaksi multi-pemicu stres ke dalam kerangka konservasi dan restorasi.
Studi terbaru telah menggarisbawahi meningkatnya dampak kekeruhan air, yang diperburuk oleh perubahan penggunaan lahan di wilayah pesisir, pada fungsi produsen primer, mengidentifikasinya sebagai pemicu stres lingkungan yang kritis (Zweifler et al., 2021 ). Respons ini terutama dapat dijelaskan melalui mekanisme fisiologis langsung dan tidak langsung. Redaman cahaya yang disebabkan oleh kekeruhan yang lebih tinggi secara langsung mengurangi ketersediaan foton di pusat reaksi PSII, seperti yang ditunjukkan oleh pengukuran ETR maks kami dan konsisten dengan temuan terbaru pada lamun Mediterania (Bité et al., 2007 ; Marín-Guirao et al., 2018 ; Ruiz & Romero, 2003 ). Gangguan fotosintesis ini telah diukur melalui pengukuran fluoresensi klorofil, dengan pengurangan ETR maks hingga 50% diamati dalam kondisi kekeruhan tinggi (Ralph et al., 2007 ; Silva & Santos, 2004 ). Selain itu, partikel sedimen yang terakumulasi pada daun dapat menciptakan penghalang fisik yang berpotensi menghalangi pertukaran gas dengan air di sekitarnya (Brodersen et al., 2017 ). Sedimen juga dapat mengubah dinamika nutrisi dan merusak struktur habitat, yang pada akhirnya berkontribusi terhadap penurunan padang rumput P. oceanica , terutama yang dekat dengan daerah perkotaan (Ruiz & Romero, 2003 ) . Penurunan tersebut dapat menyebabkan hilangnya keanekaragaman hayati dan berkurangnya produktivitas ekologi dalam ekosistem lamun (Orth et al., 2006 ). Nilai kekeruhan yang sama dengan atau lebih besar dari 16 mg/L secara signifikan mengganggu kinerja P. oceanica , terutama melalui penurunan kapasitas fotosintesis dari waktu ke waktu. Ini menekankan pengaruh ganda dari intensitas stresor (peningkatan konsentrasi sedimen) dan durasi (2 atau 7 hari pengobatan). Paparan yang berkepanjangan dapat memperkuat dampak negatif pada kapasitas fotosintesis dan kesehatan tanaman secara keseluruhan, yang menunjukkan bahwa peristiwa kekeruhan kronis dapat memiliki implikasi yang luas terhadap ketahanan padang lamun P. oceanica (Serrano et al., 2011 ). Seiring berjalannya waktu, tekanan yang berkelanjutan ini tidak hanya dapat merusak fungsi masing-masing tanaman tetapi juga membahayakan integritas struktural dan layanan ekosistem yang disediakan oleh habitat lamun ini.
Suhu muncul sebagai pendorong utama proses metabolisme lamun, menggarisbawahi perlunya menilai bagaimana pemicu stres berinteraksi dengan fluktuasi suhu alami untuk lebih baik memprediksi persistensi spesies dalam skenario pemanasan global (Sokolova et al., 2012 ; Staudt et al., 2013 ). Temuan kami selaras dengan dan memperluas studi terbaru tentang fisiologi termal P. oceanica , di mana suhu optimal yang sama (22–24°C) ditemukan (Rinaldi et al., 2023 ; Savva et al., 2018 ), tetapi hasil kami memberikan wawasan baru dengan menunjukkan bagaimana kekeruhan dapat membatasi jendela toleransi termal spesies, yang dapat mengganggu dinamika pertumbuhan dan proses fotosintesisnya (Gacia & Duarte, 2001 ; Ruiz & Romero, 2003 ). Kendala ini sangat relevan mengingat tren pemanasan di Laut Mediterania (Garrabou et al., 2022 ; Pastor et al., 2020 ), karena menunjukkan kekeruhan dapat memperburuk efek stres suhu.
Interaksi antara kekeruhan dan suhu kemungkinan beroperasi melalui kompensasi metabolik: saat suhu naik, kapasitas fotosintesis yang lebih besar biasanya diperlukan untuk mengimbangi peningkatan kebutuhan respirasi. Namun, keterbatasan cahaya yang disebabkan oleh kekeruhan dapat menghambat mekanisme kompensasi ini, mencegah P. oceanica mempertahankan keseimbangan metabolik dalam kondisi seperti itu (Marín-Guirao et al., 2018 ). Pekerjaan kami adalah yang pertama mengukur interaksi ini, menunjukkan bahwa kekeruhan tinggi (>16 mg/L) dapat mengurangi jendela toleransi termal P. oceanica hingga 4°C. Ambang batas kekeruhan yang diidentifikasi selaras dengan penilaian terkini di seluruh Mediterania tentang dampak kualitas air pada kesehatan lamun (Fernández-Torquemada et al., 2020 ) dan memberikan target pengelolaan yang jelas. Selain itu, penyempitan jendela toleransi optimal P. oceanica yang diamati dapat membahayakan persistensi dan kapasitas adaptifnya dalam skenario pemanasan saat ini dan yang diproyeksikan. Dengan batas termal yang berkurang, P. oceanica beroperasi mendekati batas fisiologisnya, yang berarti bahwa peningkatan suhu air yang kecil sekalipun dapat membebani mekanisme kompensasinya, yang mengakibatkan ketidakseimbangan karbon, pertumbuhan yang berkurang, dan tingkat kematian yang lebih tinggi. Kerentanan yang meningkat ini melemahkan ketahanan dan potensi adaptif padang rumput P. oceanica , sehingga meningkatkan risiko degradasi ekosistem yang tidak dapat dipulihkan dalam kondisi iklim di masa mendatang.
Temuan kami memperluas pekerjaan sebelumnya tentang efek terisolasi dari suhu (Rinaldi et al., 2023 ; Savva et al., 2018 ) dan kekeruhan (Ruiz & Romero, 2003 ) dengan memberikan wawasan ke dalam efek gabungan mereka pada fisiologi lamun. Kekeruhan tinggi mempersempit jendela toleransi termal P. oceanica sebesar 4°C, konsisten dengan penelitian yang menunjukkan bahwa stresor lingkungan dapat membatasi toleransi termal spesies (Pazzaglia et al., 2020 ; Wang et al., 2022 ). Sementara Pazzaglia et al. menghubungkan stres nutrisi dengan toleransi termal yang berkurang dalam kondisi eutrofik, hasil kami menunjukkan bahwa kekeruhan menciptakan kendala serupa melalui mekanisme yang berbeda. Temuan ini menunjukkan bahwa proyeksi dampak pemanasan dapat meremehkan kerentanan lamun di perairan pantai yang keruh (Wang et al., 2022 ). Pendekatan kami untuk mengukur sifat metabolik di seluruh variasi suhu musiman memberikan penilaian yang lebih relevan secara ekologis daripada eksperimen musim tunggal tradisional, yang lebih mencerminkan kondisi habitat alami. Efek interaktif yang kami dokumentasikan menunjukkan bahwa kekeruhan tidak hanya berdampak langsung pada lamun melalui keterbatasan cahaya, seperti yang ditunjukkan oleh Ruiz dan Romero ( 2003 ), tetapi juga secara mendasar mengubah kapasitas mereka untuk merespons stres termal. Ini adalah temuan yang menjembatani penelitian sebelumnya tentang efek stresor terisolasi dengan skenario multi-stresor yang lebih realistis secara ekologis.
Mengintegrasikan wawasan ilmiah ke dalam rencana konservasi praktis sambil mempertimbangkan interaksi lingkungan yang kompleks dapat secara signifikan meningkatkan ketepatan dan efektivitas strategi pengelolaan (Hendriks et al., 2017 ). Pendekatan berbasis sifat memiliki aplikasi praktis yang signifikan dalam konservasi dan restorasi ekologi. Khususnya, sifat eko-fisiologis semakin dihargai sebagai indikator kinerja organisme dan pada akhirnya kebugaran, menawarkan penilaian yang lebih cepat dan sama-sama dapat diandalkan dibandingkan dengan sifat tradisional. Sifat-sifat ini telah digunakan secara efektif untuk memprediksi distribusi spesies dan menilai risiko ekologis, seperti yang ditunjukkan dalam studi terkini, yang menggarisbawahi relevansinya yang semakin meningkat sebagai alat manajemen yang penting (Bosch-Belmar et al., 2021 , 2022 ; Marchessaux et al., 2022 ). Ambang batas spesifik yang kami identifikasi (kekeruhan <16 mg/L, kisaran suhu optimal 19,5–26,5°C) memberikan pedoman kuantitatif untuk perencanaan konservasi dan pengelolaan pesisir (NOAA, 2020 ), menginformasikan peraturan tentang tingkat kekeruhan selama aktivitas manusia (misalnya pengerukan, pembangunan pesisir, dll.), memandu, misalnya, tindakan konservasi atau pemilihan lokasi restorasi dan menginformasikan waktu upaya restorasi. Indikator metabolik terukur ( Pn , NPP, ETR max ) melengkapi metrik pemantauan tradisional dan dapat mendukung pemantauan jangka panjang dan sistem peringatan dini dengan mendeteksi stres sebelum kerusakan padang rumput yang terlihat terjadi (Moreno-Marín et al., 2018 ). Sebagai ukuran langsung kinerja yang terkait dengan kebugaran (Andersson et al., 2022 ), sifat-sifat ini menawarkan alat manajemen proaktif ketika diintegrasikan ke dalam jaringan pemantauan waktu nyata menggunakan teknologi hemat biaya seperti sistem sensor IoT (dos Santos Alvalá et al., 2019 ). Penerapan sifat-sifat metabolik dalam konteks ini masih terbatas, mungkin karena pengetahuan, instrumen, dan teknik khusus yang dibutuhkan untuk pengukurannya. Namun, hubungan langsungnya dengan fungsi organisme dan respons yang cepat dan terukur menjadikannya alat yang menjanjikan untuk konservasi, dengan penerapan yang terbukti dalam beberapa studi kasus.
Temuan kami memiliki implikasi relevan untuk layanan ekosistem yang disediakan oleh P. oceanica , khususnya mengenai kemampuannya untuk mempertahankan produksi primer bersih (NPP) dalam kondisi stres. Tingkat kekeruhan yang tinggi secara langsung mengganggu produksi oksigen, yang mengakibatkan berkurangnya laju pertumbuhan (Larkum et al., 2006 ). Hal ini, pada gilirannya, dapat menyebabkan efek fenologi, morfologi dan ekologi, termasuk pemendekan tunas, berkurangnya daun per individu, berkurangnya kompleksitas struktural dan penyebaran padang rumput yang lebih lambat. Perubahan-perubahan ini pada akhirnya mempengaruhi stabilitas ekosistem dengan mengubah dinamika sedimen, daur ulang nutrisi dan perlindungan erosi pantai dengan konsekuensi potensial bagi kesejahteraan manusia (Campagne et al., 2015 ; Costanza et al., 1997 ). Dengan berkonsentrasi pada respons metabolik, strategi restorasi dapat disempurnakan dengan ambang batas yang tepat, seperti batas kekeruhan dan suhu spesifik, untuk mengoptimalkan waktu intervensi dan meningkatkan hasil pemulihan lamun.
Studi kami memberikan wawasan berharga, tetapi aspek-aspek tertentu harus dipertimbangkan secara hati-hati ketika mengintegrasikan dan menerapkan temuan-temuan ini. Sementara pendekatan pengambilan sampel musiman kami secara efektif menangkap variasi suhu alami, periode paparan 7 hari mungkin tidak sepenuhnya mencerminkan potensi aklimatisasi jangka panjang spesies, seperti yang disarankan oleh studi-studi durasi panjang baru-baru ini (Egea et al., 2018 ). Meskipun spesies lamun yang berbeda telah menunjukkan tingkat adaptasi yang tinggi terhadap peristiwa stres termal seperti gelombang panas (Nguyen et al., 2020 ; Pazzaglia et al., 2022 ), masih belum jelas apakah spesies tersebut dapat mengembangkan respons adaptif yang sama terhadap peristiwa kekeruhan pulsa atau interaksi beberapa stresor. Oleh karena itu, studi masa depan yang menyelidiki jenis-jenis adaptasi ini (yaitu pada tingkat epigenetik) diperlukan. Selain itu, kondisi mesocosm tidak dapat sepenuhnya mereplikasi kompleksitas lingkungan lapangan di mana berbagai stresor (misalnya salinitas, nutrisi, hidrodinamika) dapat memengaruhi respons (Egea et al., 2018 ; Moreno-Marín et al., 2018 ). Validasi lapangan lebih lanjut terhadap ambang batas ini direkomendasikan, khususnya di berbagai kedalaman padang rumput dan wilayah geografis.
5 KESIMPULAN
Penelitian kami menunjukkan implikasi penting untuk strategi konservasi dan restorasi lamun. Menetapkan ambang kuantitatif untuk kekeruhan yang terkait dengan suhu dapat memandu pemilihan lokasi dan pelestarian habitat lamun seperti P. oceanica (Gacia & Duarte, 2001 ; Ruiz & Romero, 2003 ). Integrasi sifat metabolik ke dalam protokol pemantauan, di luar metrik tradisional seperti cakupan dan kepadatan, memberikan deteksi stres lebih awal dan penilaian keberhasilan restorasi yang lebih komprehensif (Purvaja et al., 2020 ; Stipcich et al., 2022 ). Indikator metabolik seperti produksi primer bersih (NPP) dan efisiensi fotosintesis (ETRmax) dapat berfungsi sebagai metrik sensitif untuk pemantauan habitat yang sedang berlangsung, menawarkan keuntungan dibandingkan metrik berbasis kepadatan tradisional. Mengoperasionalisasikan ambang ini dalam kebijakan pengelolaan pesisir dapat meningkatkan ketahanan terhadap stresor yang disebabkan oleh iklim (Li et al., 2010 ).
Interaksi yang ditunjukkan antara kekeruhan dan suhu sangat relevan untuk Laut Mediterania, yang diklasifikasikan sebagai ‘menghangat dengan cepat’ (Pastor et al., 2020 ). Temuan kami menunjukkan bahwa pengelolaan kualitas air lokal dapat membantu membangun ketahanan terhadap dampak perubahan iklim (Pörtner & Farrell, 2008 ). Penelitian ini mendukung pendekatan terpadu terhadap konservasi, yang menggabungkan ambang batas fisiologis dengan pedoman pengelolaan praktis untuk melestarikan habitat yang berharga ini dan layanan ekosistemnya dalam menghadapi tekanan lingkungan yang meningkat.



